





2022高考化学一轮复习(步步高) 第二章 第7讲 离子反应 离子方程式课件
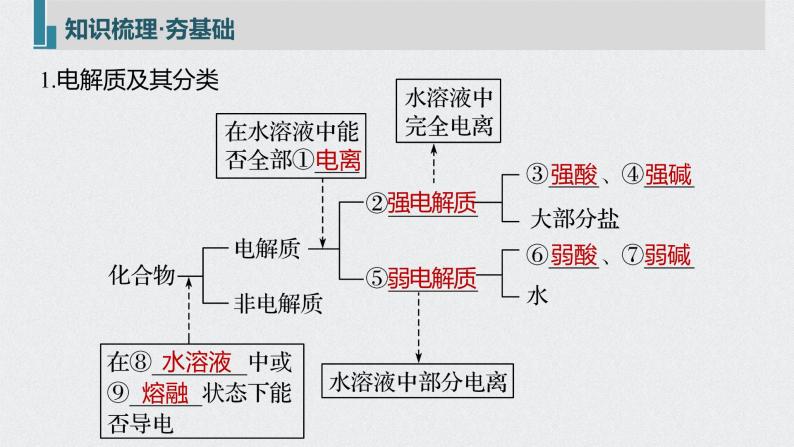
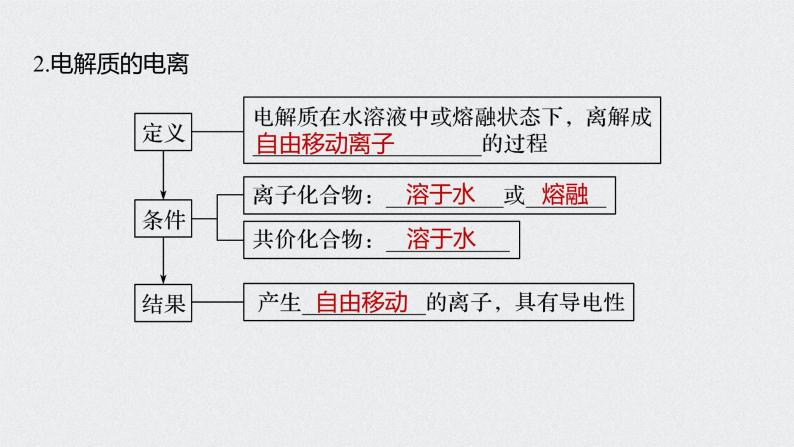
展开1.了解电解质的概念,了解强电解质和弱电解质的概念。2.理解电解质在水中的电离以及电解质溶液的导电性。3.了解离子反应的概念、离子反应发生的条件,能正确书写离子 方程式并能进行有关计算。
考点二 离子反应和离子方程式书写的基本方法
3.电离方程式的书写原则(1)原子守恒、电荷守恒。(2)连接符号:强电解质用“===”,弱电解质用“ ”。(3)多元弱酸分步书写,多元弱碱一步完成。
4.依据元素周期表,熟记常见的强电解质和弱电解质ⅠA:除LiOH外其余都是强碱。ⅡA:除Mg(OH)2、Be(OH)2外其余都是强碱。ⅢA:Al(OH)3是两性氢氧化物,即可看作弱碱,也可看作弱酸。ⅣA:H2CO3、H2SiO3均为弱酸。ⅤA:强酸:HNO3;中强酸:HNO2、H3PO4;NH3·H2O为弱碱。ⅥA:强酸:H2SO4;弱酸:H2SO3、H2S。ⅦA:强酸:HCl、HBr、HI、HClO4等;
弱酸:HF、HClO等。过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2等,它们也都难溶于水。注意 盐不论难溶、易溶,绝大多数都是强电解质。
(1)NaCl溶液在电流的作用下电离成钠离子和氯离子( )错因: 。(2)强电解质都是离子化合物,弱电解质都为共价化合物( )错因:________________________________________________________ 。(3)强电解质溶液的导电性比弱电解质溶液的导电性强( )错因:________________________________________________________ 。
NaCl溶液在电流的作用下发生氧化还原反应
如HCl是强电解质,但是共价化合物,Pb(CH3COO)2是离子化合
导电性的强弱与离子浓度及离子所带电荷数有关,而与电解质的
(4)CO2、NH3溶于水能导电,所以二者为电解质( )错因:________________________________________________________ 。
CO2、NH3均为非电解质,它们溶于水生成的物质H2CO3、
NH3·H2O是弱电解质
现有12种物质:①Al ②稀硝酸 ③HNO3 ④液氨 ⑤CO2 ⑥空气 ⑦NaCl ⑧CaCO3 ⑨NaHCO3 ⑩乙醇 ⑪Al2O3 ⑫石墨按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
(1)单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液。(2)电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如铁、铝等金属单质。(3)本身电离而导电的化合物才是电解质。如CO2、SO2、NH3的水溶液能导电,但均是非电解质。(4)电解质的强弱与电解质溶液导电能力的强弱、溶解性的大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质。
1.分类书写电离方程式(1)强电解质①Ba(OH)2: ;②BaSO4: ;③KAl(SO4)2: 。(2)弱电解质①NH3·H2O: ;②H2CO3: ;
Ba(OH)2===Ba2++2OH-
③Al(OH)3双向电离: Al(OH)3 。 酸式电离 碱式电离
(3)酸式盐①NaHSO4溶于水: ;②NaHSO4熔融: ;③NaHCO3溶于水: 、 。
2.有八种离子:H+、Na+、Ba2+、Ca2+、OH-、Cl-、 。(1)由两种离子相结合形成的物质中,属于酸的是____________________,属于难溶盐的是______________________。(2)写出以上离子组成的弱电解质的电离方程式:__________________________________________________________。
HCl、H2SO4、H2CO3
BaSO4、BaCO3、CaCO3
电离方程式书写的思维模型
1.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。(2)条件在稀H2SO4中分别加入下列物质,能发生反应的请写出有关反应的离子方程式:A.加入BaCl2溶液:_______________________;B.加入CH3COONa溶液:___________________________;C.加入Na2CO3溶液:_________________________;D.加入Zn粒:______________________;
CH3COO-+H+===CH3COOH
Zn+2H+===H2↑+Zn2+
E.加入NaOH溶液:_________________。从A~E可知离子反应发生的条件:①生成 的物质、②生成 的物质、③生成 的物质、④发生 反应。(3)离子反应的本质A~E中,混合后溶液中 的物质的量减少的是 (填字母,下同);H+的物质的量减少的是 ;因此离子反应的本质是溶液中某些离子的物质的量的 。
H++OH-===H2O
2.离子方程式(1)离子方程式:用 来表示反应的式子。(2)离子方程式的意义离子方程式不仅可以表示 ,还可以表示______ 。
实际参加反应的离子符号
3.电解质的“拆分”原则(1)易溶的强电解质(强酸、强碱、大多数可溶性盐)写成离子形式。①常见的强酸、弱酸
注意 浓盐酸、浓硝酸在离子方程式中可拆,浓硫酸一般不拆。
(2)固体之间的反应、浓硫酸(或浓磷酸)与固体之间的反应,不能电离出离子,所以不写离子方程式。如:Ca(OH)2(s)+2NH4Cl(s) CaCl2(s)+2NH3↑+2H2O。
题组一 基本反应离子方程式的书写
1.(1)完成下列反应的离子方程式,注意难溶、气体、难电离微粒的书写形式。①氧化镁溶于稀硫酸 。②AlCl3溶液中滴加过量的氨水 。③将浓硝酸滴到CaCO3固体上 。
MgO+2H+===H2O+Mg2+
Al3++3NH3·H2O===Al(OH)3↓+3
CaCO3+2H+===Ca2++H2O+CO2↑
④小苏打溶液与乙酸溶液混合 。⑤向NaHSO3溶液中加入过量NaHSO4溶液 。
+CH3COOH===CH3COO-+H2O+CO2↑
+H+===H2O+SO2↑
(2)按要求完成下列反应的离子方程式,注意微溶物质、 与碱反应的条件。①澄清石灰水中加入稀盐酸 。②石灰乳与Na2CO3溶液反应 。③Na2SO4溶液与AgNO3溶液混合 。④NH4Cl与NaOH两稀溶液混合 。
OH-+H+===H2O
(3)完成下列教材中重要氧化还原反应的离子方程式,注意单质、氧化物、浓“盐酸、硝酸、硫酸”的书写形式。①过氧化钠溶于水 。②FeCl3腐蚀铜箔 。③用MnO2与浓盐酸共热制Cl2 。
2Na2O2+2H2O===4Na++4OH-+O2↑
2Fe3++Cu===2Fe2++Cu2+
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
④用NaOH吸收Cl2 。⑤铜分别溶于浓、稀硝酸 ; 。⑥铜加热条件下与浓硫酸反应: 。
Cl2+2OH-===Cl-+ClO-+H2O
1.离子方程式书写的关键
2.特殊情况的处理(1)微溶物作为产物视为沉淀,作为反应物处理如下:
(2)铵根离子与碱的反应
题组二 多重反应离子方程式的书写2.完成下列反应的离子方程式(1)Ba(OH)2溶液与H2SO4溶液混合 。(2)Ba(OH)2溶液与(NH4)2SO4溶液混合 。(3)CuSO4溶液与Ba(OH)2溶液混合 。
(4)Fe2O3溶于HI溶液中 。(5)FeO溶于稀HNO3中 。
Fe2O3+6H++2I-===2Fe2++3H2O+I2
多重反应离子方程式书写时的注意点两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)离子之间都能两两结合成难电离(或难溶)的物质或后续离子之间的氧化还原反应,这样的离子反应称为多重反应。在写这类反应的离子方程式时易丢失其中的一组反应。
题组三 离子反应过程中溶液导电性变化的判断3.下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面的括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( )(2)向H2S溶液中通入Cl2直至过量( )(3)向AgNO3溶液通入少量HCl( )(4)向氨水中通入HCl直至过量( )
(5)向NaOH溶液中通入少量Cl2( )(6)向饱和石灰水中不断通入CO2( )
解析 (1)H+与OH-中和生成极弱电解质水,Ba2+与 结合成难溶BaSO4,溶液中自由移动的离子浓度降低。
(2)和(4)都是因发生离子反应,使弱电解质生成强电解质,自由移动的离子浓度增加。(3)和(5)虽然发生了离子反应,但自由移动离子的浓度未发生改变。(6)开始阶段CO2与Ca(OH)2反应生成CaCO3沉淀,离子浓度降低至Ca(OH)2完全反应后,继续通入CO2,CO2和H2O与CaCO3反应生成可溶性的Ca(HCO3)2,自由移动的离子浓度又增加。
(1)电解质溶液的导电原理电解质电离出的阴、阳离子在外加电场作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带的电荷数越多,电解质溶液的导电能力越强。(2)同一温度下,强电解质溶液(a),弱电解质溶液(b),金属导体(c),三者的导电能力相同,若升高温度,它们的导电能力大小顺序为b>a>c。
1.下列说法正确的一组是①不溶于水的盐都是弱电解质②可溶于水的盐都是强电解质③0.5 ml·L-1一元酸溶液中H+浓度为0.5 ml·L-1 ④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子⑥熔融的电解质都能导电A.①③⑤⑥ B.只有④⑤C.②④⑤⑥ D.只有③⑥
解析 不溶于水的盐不一定是弱电解质,如BaSO4难溶于水,但溶于水的部分完全电离,是强电解质,故①错误;电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,故②错误;0.5 ml·L-1一元酸溶液中的H+浓度不一定为0.5 ml·L-1,如醋酸,故③错误;强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,故④正确;电解质溶液导电的原因是溶液中有自由移动的阴、阳离子,故⑤正确;酸在熔融态时均不导电,只有溶于水时才导电,故⑥错误;正确的有④⑤。
2.将NaCl溶于水配成1 ml·L-1的溶液,溶解过程如图所示。下列说法正确的是A.a离子为Cl-,b离子为Na+B.溶液中含有NA个水合Na+C.溶液中存在NaCl Na++Cl-D.NaCl溶解过程需要在容量瓶中进行
解析 钠离子核外有2个电子层,氯离子有3个电子层,即氯离子半径大于钠离子,a离子为Cl-,b离子为Na+,A正确;题目中没有说明溶液的体积,无法计算溶质的物质的量,即无法判断溶液中水合Na+的个数,B错误;
氯化钠是强电解质,全部电离,电离方程式为:NaCl===Na++Cl-,C错误;容量瓶是精密仪器,不能用于溶解,NaCl溶解需要在烧杯中进行,D错误。
3.下列说法正确的是A.三氧化硫的水溶液能导电,所以三氧化硫是电解质B.自由移动离子数目多的电解质溶液导电能力一定强C.NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、D.NH3属于非电解质,但其水溶液能够导电
解析 三氧化硫本身不能电离出离子,SO3是非电解质,A错误;离子数目多的溶液中,离子浓度不一定大,离子所带电荷数不一定多,其导电能力不一定强,B错误;NaHSO4在熔融状态下只能电离出Na+、 ,C错误;NH3是非电解质,但其溶于水后可形成电解质NH3·H2O,溶液能导电,D正确。
B项,应用可逆号;C项,是HS-的水解方程式。
5.铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是A.OH-+HCl===H2O+Cl-B.Ca(OH)2+Cu2+===Ca2++Cu(OH)2C.Fe+Cu2+===Cu+Fe2+D.Fe+2H+===Fe3++H2↑
解析 稀盐酸和石灰水发生中和反应,反应的离子方程式应为H++OH-===H2O,A项错误;氯化铜和澄清石灰水反应生成氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-===Cu(OH)2↓,B项错误;
铁与氯化铜溶液发生置换反应,生成氯化亚铁和铜,反应的离子方程式为Fe+Cu2+===Fe2++Cu,C项正确;铁为活泼金属,与稀盐酸发生置换反应生成Fe2+和氢气,离子方程式为Fe+2H+===Fe2++H2↑,D项错误。
解析 石灰水表面漂着的“白膜”为碳酸钙,用醋酸溶解的离子方程式为CaCO3+2CH3COOH===2CH3COO-+Ca2++H2O+CO2↑,A项错误;
漂白粉溶液在空气中失效,是Ca(ClO)2与空气中的二氧化碳、水反应,离子方程式为Ca2++2ClO-+CO2+H2O===2HClO+CaCO3↓,D项正确。
7.(2020·泰安市高三模拟)下列离子方程式正确的是A.MnO2与浓盐酸反应: MnO2+4HCl(浓) Mn2++Cl2↑+2H2O+2Cl-B.向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性: Ba2++2OH-+2H++ ===BaSO4↓+2H2OC.向次氯酸钙溶液中通入SO2: Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClOD.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
解析 向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性,要求氢氧根和氢离子物质的量相等,氢氧化钡和硫酸氢钠的物质的量的比为1∶2,选项B正确;次氯酸有强氧化性,可以将+4价硫氧化为+6价,选项C错误;离子方程式的电荷不守恒,选项D错误。
8.下列实验过程中产生的现象与图形相符合的是A.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体 积,纵坐标为溶液的导电能力)B.铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉 淀质量)C.CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的 导电能力)D.稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标 为钠离子物质的量)
解析 滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,溶液中离子浓度减小,导电能力下降,恰好完全反应导电性变为零,再随着稀硫酸的滴入,溶液导电能力增加,直到变为定值,故A正确;
铁粉加到一定量CuSO4溶液中发生反应Fe+CuSO4===FeSO4+Cu,根据方程式知每当消耗56 g铁,生成64 g固体铜,所以固体的质量一直在增加,而图像中的固体的质量先变小后变大,故B错误;CO2通入一定量NaOH溶液中,发生的化学反应是CO2+2NaOH=== Na2CO3+H2O、Na2CO3+H2O+CO2===2NaHCO3,根据方程式知钠离子浓度基本不变,所以导电能力基本不变,故C错误;
HCl+NaOH===NaCl+H2O,氢氧化钠和氯化钠都是强电解质,在水中完全电离,所以钠离子的物质的量不变,而图像中的钠离子的物质的量先变小后变大,故D错误。
9.下列离子方程式书写正确的是A.钠与水反应:Na+2H2O===Na++2OH-+H2↑B.稀盐酸与苏打溶液反应: +H+===CO2↑+H2OC.向次氯酸钙溶液中通入过量二氧化碳: Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClOD.铁盐腐蚀铜质电路板:2Fe3++Cu===2Fe2++Cu2+
解析 不符合电子守恒、电荷守恒,离子方程式应该为:2Na+2H2O ===2Na++2OH-+H2↑,A错误;
反应符合事实,遵循离子方程式拆写原则,D正确。
解析 硫化亚铁是难溶性物质,在离子方程式里不能写成离子形式,故A不选;硫化氢有还原性,氯气有氧化性,两者会发生氧化还原反应,生成硫和氯化氢,故B选;
稀硫酸的氧化性是H+体现出来的,H+的氧化性比较弱,不能把铁氧化成Fe3+,只能氧化成Fe2+,故D不选。
11.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:(1)写出反应的离子方程式:____________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填字母)。A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至 恰好完全沉淀C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为:______________________。
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图1中的________曲线表示(填字母)。
解析 加入稀硫酸直至过量,随着反应进行导电性逐渐减弱,恰好反应时导电性接近0,硫酸过量后离子浓度增大,导电性逐渐增强,图中只有C符合。
2024年高考化学一轮复习 第5讲 离子反应 离子方程式课件PPT: 这是一份2024年高考化学一轮复习 第5讲 离子反应 离子方程式课件PPT,共60页。PPT课件主要包含了电解质及电离,真题演练明确考向,课时精练等内容,欢迎下载使用。
新高考化学一轮复习课件 第1章 第2讲 离子反应 离子方程式: 这是一份新高考化学一轮复习课件 第1章 第2讲 离子反应 离子方程式,共60页。PPT课件主要包含了高考化学一轮复习策略,离子反应离子方程式,电解质及电离,离子方程式的正误判断,真题演练明确考向,课时精练等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第2章 第7讲 离子反应 离子方程式 (含解析): 这是一份2022年高考化学一轮复习课件 第2章 第7讲 离子反应 离子方程式 (含解析),共60页。PPT课件主要包含了复习目标,内容索引,考点一电解质及电离,知识梳理·夯基础,电解质及其分类,强电解质,弱电解质,水溶液,电解质的电离,自由移动离子等内容,欢迎下载使用。












