
高三一轮复习化学周练试题117.docx
展开7. 化学与社会发展以及人们生活质量的提高有密切关系。下列的叙述不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.用13C或14C示踪原子可以进行幽门螺旋杆菌的检测
C.用NaHCO3溶液可以洗去蔬菜、水果等的残留农药
D.使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱
8.下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②仅用量筒、烧杯、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量的NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体
A.①③⑤ B.③④⑤ C.②③⑤ D.①③④⑥
9. 设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 0.1 ml CaC2含有的π键的数目为0.1NA
B. 25°C时,pH=13的Na2CO3溶液中由水电离出的OH-数目为0.1NA
C. 明矾作净水剂是利用其水解产物的消毒杀菌作用
D. 4.6 g金属钠与足量氧气反应被氧化成Na2O和Na2O2,生成物中阴离子个数为0.1NA
10. 下列叙述正确的是
A.等浓度的以下溶液:①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③(NH4)2CO3 ④NH4Cl 中
NH4+浓度从小到大的顺序为④<①<③<②
B.20 mL 0.1 ml/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:
c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 ml/L
C.浓度均为1 ml/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>②
D.相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:
c(CH3COO-)=c(HCO3-)+2c(CO32-)
11. 短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A.X单质可以通过铝热法获得
B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
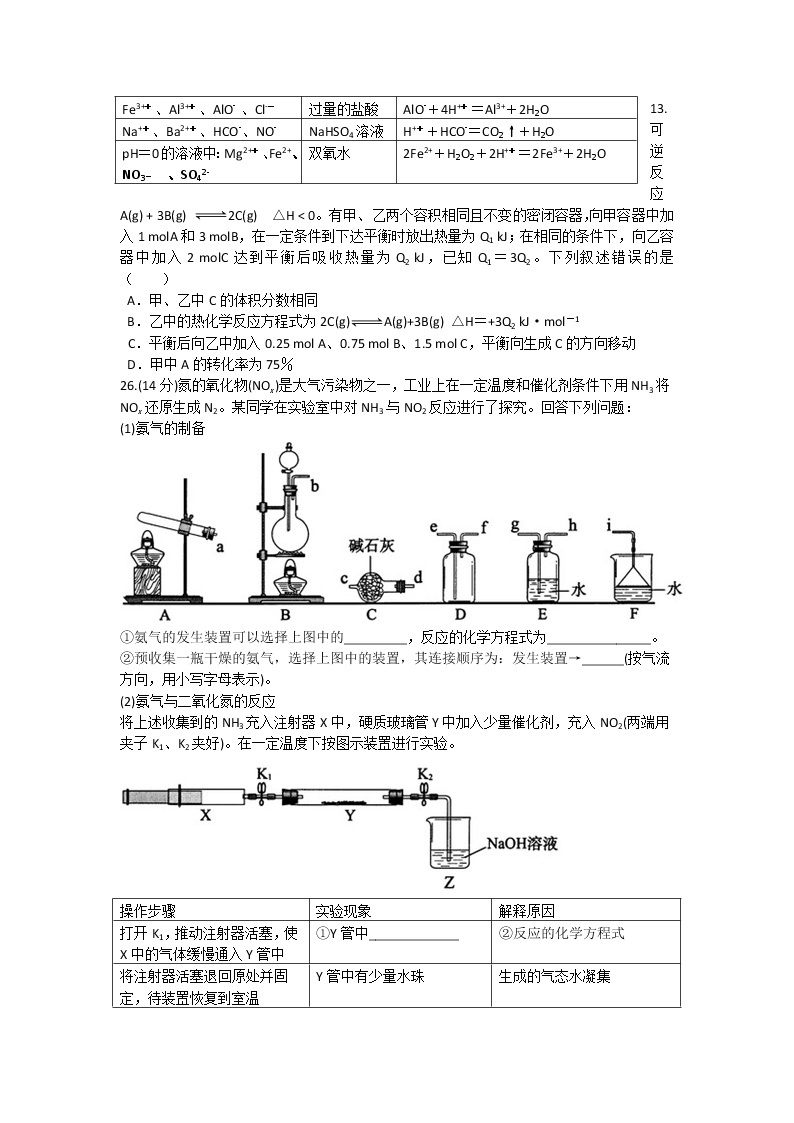
12.下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是( )
13. 可逆反应A(g) + 3B(g) 2C(g) △H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mlA和3 mlB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 mlC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是 ( )
A.甲、乙中C的体积分数相同
B.乙中的热化学反应方程式为2C(g)A(g)+3B(g) △H=+3Q2 kJ·ml-1
C.平衡后向乙中加入0.25 ml A、0.75 ml B、1.5 ml C,平衡向生成C的方向移动
D.甲中A的转化率为75%
26.(14分)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
27.(14分)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
① 2NO2(g)+NaC1(s)NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g)2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+C12(g)2C1NO(g)反应的△H和a的关系为△H=________kJ/ml。
(3)在1L的恒容密闭容器中充入2mlNO(g)和1mlC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
① 由图A可判断T1T2,该反应的△H_____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=____________ml/(L·min)。
③ T2时该反应的平衡常数K=____________。
(4) 一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
28.(15分)草酸亚铁广泛用于涂料、染料及感光材料的生产,也是合成锂离子电池正极材料磷酸亚铁锂的原料。某工厂采用炼钢厂的脱硫渣(主要成分为Fe2O3)生产电池级草酸亚铁晶体的工艺流程如下:
(1)“还原”过程中反应的离子方程式为、Fe+2H+=Fe2++ H2↑。
(2)滤渣2中含有的TiOSO4在热水中易水解,生成H2TiO3沉淀,该反应的化学方程式为。
(3)“滤液”经处理后得到一种农业上常用的化肥,其名称是。
(4)流程图中应进行的操作步骤的名称是。
(5)下图是反应温度、加料时间及分散剂的质量分数对草酸亚铁纯度的影响:
从图象可知,制备电池级草酸亚铁晶体的最佳实验条件是:反应温度为______℃,加料时间为____min,分散剂的质量分数为____。
(6)草酸亚铁晶体(FeC2O4·2H2O)纯度的测定:准确称取W g草酸亚铁晶体于锥形瓶中,加入一定量的稀硫酸溶解,并加热至50℃,用c ml·L-1KMnO4标准溶液滴定,达到滴定终点时,用去V mL标准溶液。滴定反应为(未配平):
FeC2O4·2H2O +KMnO4+H2SO4→Fe2(SO4)3+CO2↑+MnSO4+K2SO4+H2O
则FeC2O4·2H2O的纯度为_______%(用含有W、c、V的代数式表示)。
37.【化学——物质结构与性质】(15分)X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的电负性从大到小的顺序是_______(用元素符号表示,下同)。
(2)写出W的价电子排布式________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是_____, YZ2-的VSEPR模型是______。
(4) X、Y、Z的最简单氢化物的键角从大到小的顺序是_______(用化学式表示),
HYZ3酸性比HYZ2强,其原因是:________________________________________。
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式______,该物质硬度大,推测该物质为____晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(填简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
26.(1)①,。
②发生装置→
(2)
27.(1)
(2)
(3)①,
②③
(4)
28.(1)
(2)
(3)
(4)
(5)℃,min,质量分数为。
(6)%
37.(1)
(2),。
(3), 。
(4),
。
(5),。。
(6)
1-7题答案:A.C.D.B.D.A.B.
26.(1)① A 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O或B NH3·H2O NH3↑+H2O
②d→c→f→e→i
(2)①红棕色气体慢慢变浅②8NH3+6NO27N2 +12H2O
③Z中NaOH溶液产生倒吸现象④反应后气体分子数减少,Y管中压强小于外压
(1)K12/K2 (2) 289 - 2a (3)①<<②0.1 ③ 2
(4) A
(l)Fe+2Fe3+=3Fe2+(2) TiOSO4+2H2O=H2TiO3+H2SO4(3)硫酸铵
(4)洗涤、干燥(5)402520%(6) 30cV/W
37.(1)O>N>C;(2)3d104s1;K、Cr;(3)C≡O;平面三角形;
(4)CH4>NH3>H2O;(5)AlN;原子;sp3;(6)面心立方最密堆积
离子组
试剂X
离子方程式
透明溶液中:
Fe3+、NH4+、SO42-、NO3-
过量的铜粉
2Fe3++Cu=2Fe2++Cu2+
Fe3+、Al3+、AlO2- 、Cl-
过量的盐酸
AlO2-+4H+=Al3++2H2O
Na+、Ba2+、HCO3-、NO3-
NaHSO4溶液
H++HCO3-=CO2↑+H2O
pH=0的溶液中:Mg2+、Fe2+、
NO3_ 、SO42-
双氧水
2Fe2++H2O2+2H+=2Fe3++2H2O
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中
①Y管中_____________
②反应的化学方程式
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝集
打开K2
③_______________
④
①Y管中
②反应的化学方程式
③
④
湖南衡阳名校2024届高三一轮复习1月第1周周练 化学试题(含解析): 这是一份湖南衡阳名校2024届高三一轮复习1月第1周周练 化学试题(含解析),共22页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
湖南衡阳名校2024届高三一轮复习12月第3周周练 化学试题(含解析): 这是一份湖南衡阳名校2024届高三一轮复习12月第3周周练 化学试题(含解析),共17页。试卷主要包含了单选题,实验题,填空题等内容,欢迎下载使用。
湖南衡阳名校2024届高三一轮复习11月第4周周练 化学试题(含解析): 这是一份湖南衡阳名校2024届高三一轮复习11月第4周周练 化学试题(含解析),共19页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。