






化学选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率教学演示课件ppt
展开回忆钠和钾分别与水反应的现象。
比较等物质的量浓度的盐酸和醋酸与大理石反应的快慢。
不同的化学反应快慢是不一样的。怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
以反应Zn+2HCl=ZnCl2+H2为例:可以通过测定哪些数据来确定该反应的快慢?
1、测定单位时间内消耗锌的质量,2、测定同质量的锌完全消失所需的时间3、测定反应停止所需的时间4、测定相同时间内溶液的PH的变化5、测定溶液中的氢离子浓度的变化6、测定相同时间内溶液中的锌离子浓度的增加值7、测定相同时间所收集的氢气的体积或质量8、测定相同时间内溶液的质量的变化量9、加指示剂测定颜色的变化所需的时间
总之:凡是在反应中变化的一切数据都能作为反应快慢的依据。而不变的数据则不能比较。
化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
浓度常用单位:ml/L
时间常用单位:s 、 min、h
化学反应速率常用单位:ml/(L·s) 或 ml/(L·min)
表达式:v = △c/△t
一、化学反应速率的表示
v = △n/(V·△t)
1、通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,所以反应速率是正值。
2、中学阶段的化学反应速率是平均速率。
3、浓度仅指溶液或气体的,★★固体、纯液体的浓度是常数不随条件的变化而变化。
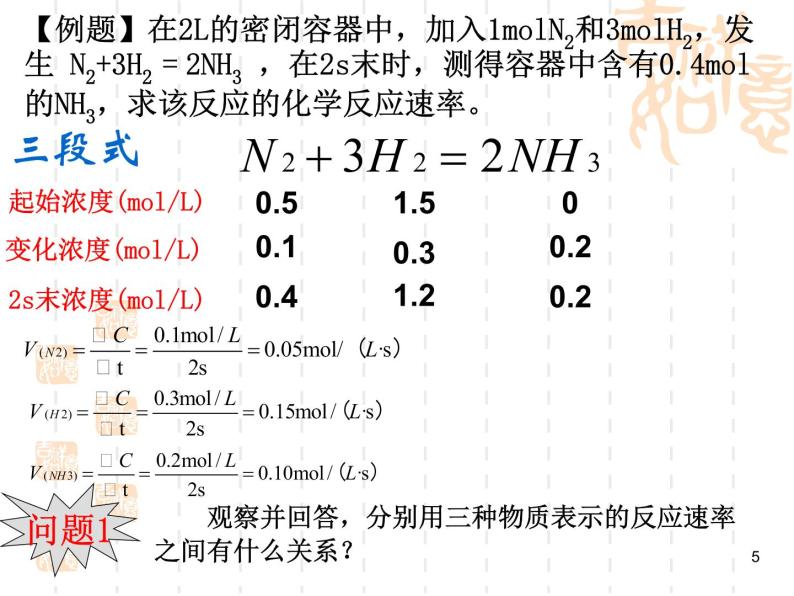
【例题】在2L的密闭容器中,加入1mlN2和3mlH2,发生 N2+3H2 = 2NH3 ,在2s末时,测得容器中含有0.4ml的NH3,求该反应的化学反应速率。
2s末浓度(ml/L)
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
变化浓度(ml/L)
同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。 同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。
如在N2 + 3H2 = 2NH3 中, v(N2):v(H2):v(NH3)=1:3:2
1、用不同的物质来表示反应速率。
例1、反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3ml,则此反应的平均速率可表示为:A、v (O2)=0.01 ml/L·s B、 v (NO)=0.008 ml/L·sC、 v (H2O)=0.003 ml/L·s D、 v (NH3)=0.002 ml/L·s
v (NO)=0.3/(5×30) =0.002 ml/L·s
2、比较反应速率的大小
例2、反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为①VA = 0.15ml·L-1·s-1 ②VB = 0.6ml·L-1·s-1 ③Vc = 0.4ml·L-1·s-1 ④VD = 0.45ml·L-1·s-1 则该反应在不同条件下速率快慢顺序是
④﹥ ②= ③﹥ ①
结论2:在同一反应中,反应速率的大小不能单纯地看数值大小。应化为同一种物质的反应速率再进行比较。
3、根据各物质的反应速率之比写出化学方程式。
例3、某温度下,浓度都是1ml/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4ml/L,c(Y2)=0.8ml/L ,c(Z)=0.4ml/L,则该反应的反应方程式可表示为:
3X2 + Y2 === 2Z
3X2 + Y2 === 2X3Y
习题:已知反应N2 +3H2 2NH3 ,根据下图判断
1、A是______物质的量浓度变化情况
2、C是______物质的量浓度变化情况
3、2分钟内N2的平均速率是多少?
0.5ml/(L· min )
2、化学反应进行的时候,反应物和生成物的浓度都在不断地变化,由于反应体系中一种反应物浓度的变化,必然引起其他物质浓度发生相应的变化。因此,化学反应速率只要用反应体系中任何一种物质(反应物或生成物)的浓度变化来表示,一般以最容易测定的物质表示。
3、在物质的诸多性质中,特别是在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
1、化学反应速率是通过实验测定的。
1、 下列反应中 2 SO2 + O2 2 SO3 起始浓度(ml/L) 0.4 0.2 0 2 s后浓度(ml/L) 0.2求:V(SO2)、V(O2)、V(SO3)
2、在500 mL的密闭容器中装入1.5 ml H2,0.5 ml N2和0.05 ml NH3。若该反应的反应速率 V(H2)= 0.3 ml/(L·min)时,求3分钟末时NH3的浓度?
3、把0.6mlX气体的0.4mlY气体混合于2L容器中,使它们发生如下反应:3X+Y= nZ+2W。2min末已生成0.2mlW,若测知V(z)=0.1ml/(L·min),则⑴上述反应中Z气体的计量数n的值是( )A.1 B.2C.3D.4⑵上述反应在2min末时,已消耗的Y占原来的百分比是( )A.20% B.25%C.33%D.50%
4、在4个不同的容器中,在不同的条件下进行合成氨反应,根据在相同时间内测定的结果判断,生成氨的速率最快的是( ) A.V(H2)= 0.1 ml/L·min B.V(N2)= 0.2 ml/L·min C.V(NH3)= 0.15 ml/L·min D.V(H2)= 0.3 ml/L·min
注:此类题均换算为同一物质的速率为标准比较
5、一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mlN2和3ml H2,3min末测此容器内压强是起始时压强的0.9倍。在此时间内用 H2的量的变化来表示该反应的平均反应速率 是( ) A、0.2 ml/L·min B、0.6 ml/L·min C 、0.1 ml/L·min D、0.1 ml/L·min
6、将固体NH4Br置于密闭容器中,在某温度下,发生下列反应: NH4Br(s) NH3(g)+HBr(g),2HBr(g) Br2(g)+H2(g)2min后,测知H2的浓度为0.5ml/L,HBr的浓度为4ml/L,若上述反应速率用V(NH3)表示,求V(NH3)
高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应速率备课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应速率备课ppt课件,共29页。PPT课件主要包含了2外部因素,类比法借鉴投篮,一个反应经历的过程,有效碰撞的几率,浓度对反应速率的影响,本质原因,压强对反应速率的影响,催化剂,加快化学反应速率,注不说明指正催化剂等内容,欢迎下载使用。
化学选修4 化学反应原理第一节 化学反应速率背景图ppt课件: 这是一份化学选修4 化学反应原理第一节 化学反应速率背景图ppt课件,共16页。PPT课件主要包含了问题1,三步法,结论1,常见题型例举,NH3,化学反应速率的测量等内容,欢迎下载使用。
化学选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率教课内容ppt课件: 这是一份化学选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率教课内容ppt课件,共14页。PPT课件主要包含了1v只取正直,△cH26,△cNH34,△cN22,观察思考等内容,欢迎下载使用。













