






化学选修4 化学反应原理第一节 化学反应与能量变化评课课件ppt
展开化学反应过程中为什么会有能量的变化? 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。 旧键断裂需要吸收能量, 新键形成需要放出能量。 而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。
1、你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应
2、你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗?
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳
反应物具有的总能量 生成物具有的总能量
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
PS: 1、符号:△H 单位: kJ/ml 或 kJ·ml-1 2、反应热描述的是化学反应前后的热量变化 3、反应热描述的是一定温度下的热量变化 4、任何化学反应都有反应热,表现为吸热反应或者放热反应
PS: ΔH=生成物能量-反应物能量 放热反应:ΔH<0或 ΔH为“-” 吸热反应:ΔH>0 或ΔH为“+”
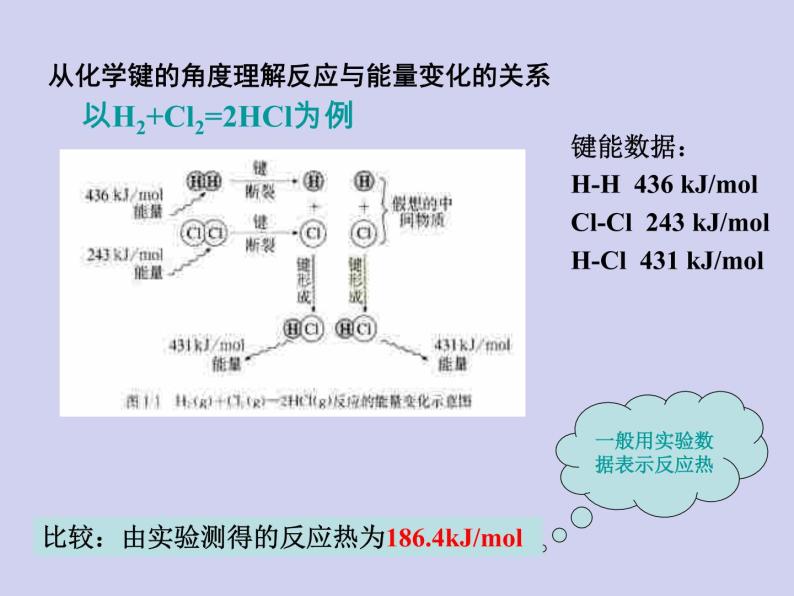
从化学键的角度理解反应与能量变化的关系
以H2+Cl2=2HCl为例
键能数据:H-H 436 kJ/mlCl-Cl 243 kJ/mlH-Cl 431 kJ/ml
一般用实验数据表示反应热
比较:由实验测得的反应热为186.4kJ/ml
上述反应的反应热表示为: ΔH=-184.6kJ/ml,下面的反应该如何表示它的反应热呢? 例1:1mlC与1ml水蒸气反应生成1mlCO和1mlH2,需要吸收131.5kJ的热量。
ΔH=+131.5kJ/ml
例 2:拆开 lml H—H键、lml N-H键、lmlN≡N键分别需要的能量是436kJ、391kJ、946kj,则1ml N2生成NH3的反应热为,1ml H2生成NH3的反应热为。
反应热与物质的量的关系: 质量守恒 能量守恒某一反应中,质量和能量成正比关系热量用Q表示 ①体系向环境做正功,Q>0,释放能量→放热反应②体系向环境做负功,Q<0,得到能量→吸热反应
★判断一个反应是吸热反应还是放热反应的方法:Ⅰ: △H=E2 - E1 > 0为吸热反应 E1不能通过实验测得,∴没有实际的计算意义Ⅱ:反应物分子断键时吸收的总能量Σ反与生成物分子形成新化学键时释放的能量Σ生的相对大小 △H= Σ反- Σ生若: △H > 0 则为吸热反应 △H为“+” , Q<0 △H < 0 则为放热反应 △H为“-” , Q>0Ⅲ:通过实验直接测得→掌握中和热的测定
阅读P3《资料●体系与环境》
破坏1 ml 共价键吸收的能量或形成1 ml 共价键放出的能量
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
生成物释放的总能量大于反应物吸收的总能量
生成物释放的总能量小于反应物吸收的总能量
1、下列叙述正确的是 ( )A.化学反应一定伴随热量的变化B.凡是吸热或放热过程中热量的变化均称为反应热C.若△H<0,则反应物的能量高于生成物的能量D.若△H>0,则反应物的能量高于生成物的能量2、已知:H + H ═ H2;△H=-436KJ/ml,则下列叙述正确的是 ( )A.2个H原子的能量高于1个H2的能量 B.2个H原子的能量低于1个H2的能量C. H原子比H2分子稳定 D.H2分子比H原子稳定
3、下列变化过程中会放出热量的是 ( )①硝酸铵溶于水②物质的燃烧③苛性钠溶于水④生石灰放入水中 ⑤醋酸的电离A.仅①⑤ B.仅②③ C.仅②④ D.②③④
4、下列变化中,属于放热反应的是 ( )A.Ba(OH)2·8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧C.灼热的碳与二氧化碳的反应 D.氯化钠溶于水
ΔH=生成物能量-反应物能量
ΔH=反应物总键能-生成物总键能
第一章 化学反应与能量
第一节 化学反应与能量的变化第二课时 热化学方程式
E(生成物的总能量)- E(反应物的总能量)
E(反应物分子化学键断裂时所吸收的总能量)- E (生成物分子化学键形成时所释放的总能量)
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
与化学方程式相比,热化学方程式有哪些不同?正确书写热化学方程式应注意哪几点?
请看以下几个例子,再思考!
能表示参加反应物质的量和反应热的关系的化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/ml
1、热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。 普通化学方程式只包含物质变化一个部分。
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”, 单位是kJ/ml或J/ml
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/ml
2、热化学方程式需注明反应时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。普通化学方程式不需注明温度和压强。
1、化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”,单位是kJ/ml或J/ml;
2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
3、热化学方程式需注明各物质的状态。 普通化学方程式不需注明物质的状态。
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/ml或J/ml
3、物质后需标聚集状态(s、l、g、aq)
4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。 普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。
阅读 P4 《资料卡片》
4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数
5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
热化学方程式表示的意义
1、反应物和生成物的种类、聚集状态2、反应中各物质的物质的量比和质量比3、反应中放出或吸收的热量。
反应物和生成物前的系数它代表了什么?在方程式中∆H它表示了什么意义? ∆H它的值与什么有关系?
热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。 ∆H(KJ/ml)它表示每摩尔反应所吸收或放出的热量,∆H它的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其∆H不同。
1、当1ml气态H2与1ml气态Cl2反应生成2ml气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。
H2(g)+Cl2(g)=2HCl(g) ∆H =-184.6KJ/ml
而这些书写也是对的!!!
(练习与巩固)依据事实,写出下列反应的热化学方程式∶
(1)1ml碳完全燃烧放出393.5KJ的热量;(2)1克甲醇燃烧生成二氧化碳和液态水时放热22.68KJ;(3)1ml氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。
写出下列反应的热化学方程式(1)1mlC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量(2)0.5mlCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/ml
2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/ml
2.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6KJ/ml
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mlC. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H=-4b kJ/mlD. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+4b kJ/mlE. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/ml
2、已知充分燃烧a g 乙炔气体时生成1ml二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
点拨:热化学方程式书写正误的判断可从物质的聚集状态、△H的正负号、物质的量的大小、单位等主要方面入手
3、沼气是一种能源,它的主要成分是CH4。0.5 ml CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是
A、 2CH4 ( g )+4O2 ( g ) = 2CO2 ( g ) + 4H2O ( l ) ΔH = +890 kJ/ml
B、 CH4 +2 O2 = CO2 + H2O ΔH = -890 kJ/ml
C、 CH4 ( g )+2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = -890 kJ/ml
D、 1/2CH4 ( g )+O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/ml
4、已知在1×105Pa,298K条件下,2ml氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·ml-1B. 2H2(g)+O2(g)=2H2O ΔH=-484kJ·ml-1C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·ml-1D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·ml-1
5、在200℃、101kP时,1mlH2与碘蒸气作用生成HI反应,科学文献表示为: H2(g)+I2(g) 2HI(g) △H=-14.9kJ/ml以上化学方程式指出了反应时的 和 ;括号中的符号表示反应物或生成物的 。6、在25℃、101kPa时,有两个由H2和 O2 化合成1ml H2O的反应,一个生成气态水,一个液态水,化学方程式如下: H2(g)+1/2 O2(g) = H2O(g) △H=-241.8Kj/ml H2(g)+1/2 O2(g)= H2O(I) △H= - 285.8kJ/ ml以上两个反应,产物都是 ,但产物的 不同,
人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt,共36页。PPT课件主要包含了能量变化,问题探究一,放热反应,吸热反应,∆H=,问题探究二,化学键的断裂和形成,我们可以发现,练习与巩固,中和热的测定等内容,欢迎下载使用。
化学选修4 化学反应原理第三节 电解池说课课件ppt: 这是一份化学选修4 化学反应原理第三节 电解池说课课件ppt,共60页。PPT课件主要包含了有关电解,巩固练习,第四章电化学基础,电解原理的应用,精制食盐水,铜的电解精炼,电化学专题3\4,拓展练习,金属的电化学腐蚀,吸氧腐蚀等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二章 化学反应速率和化学平衡第三节 化学平衡多媒体教学课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二章 化学反应速率和化学平衡第三节 化学平衡多媒体教学课件ppt,共18页。PPT课件主要包含了可逆反应练习,蔗糖溶解,化学平衡,逐渐减小,逐渐增大,化学平衡的建立,化学平衡状态,①逆可逆反应,化学平衡状态的判断等内容,欢迎下载使用。













