





高中化学人教版 (新课标)必修2第二章 化学反应与能量综合与测试复习ppt课件
展开本章内容包括化学能与热能、化学能与电能、化学反应速率和限度等三部分内容,经常考查的知识点有常见的吸热反应和放热反应,原电池的工作原理,电极反应式的书写等,原电池的应用、化学反应速率的表示法,外界条件对反应速率的影响,可逆反应,化学平衡的概念及化学平衡的标志,控制化学反应快慢和限度的技术应用等。其命题多以选择题、填空题、简答题的形式出现,其中化学反应的实质、能量转化及化学反应的应用等仍是高考的重点和热点。
●专题归纳1.化学反应的实质化学反应的过程是旧物质的消耗和新物质生成的过程,因此化学反应的本质就是旧化学键断裂和新化学键形成的过程。
2.吸热反应与放热反应吸热反应,从字面上讲就是吸收热量的反应,而放热反应,就是放出热量的反应。若从本质上分析,则可以从两个角度进行理解。一是从化学键的断裂与形成角度;二是从物质本身具有的能量角度。下面就逐一举例说明。
(3)对吸热反应和放热反应理解的两个误区。①吸热反应很难进行,放热反应较易进行。( )吸热反应、放热反应只是从能量的变化角度分析的,吸收热量的化学反应是吸热反应,放出热量的化学反应是放热反应,与反应的难易无关。②吸热反应一定需要加热或点燃,放热反应一定不用加热或点燃。()吸热反应、放热反应与反应条件无必然的关系。有些吸热反应常温下就能进行,如NH4Cl(s)与Ba(OH)2·8H2O(s)的反应,有些放热反应需要加热或点燃才能发生,如木炭的燃烧。
3.化学反应中物质变化、化学键变化、能量变化的关系
4.化学能与热能的相互转化能量的形式有多种。蕴藏在物质内部与化学键的变化相关联的能量为化学能。自然界里的能量除了化学能以外,还有热能、光能、电能等。化学反应伴随着能量变化是化学反应的一大特征,从能量形式上看,主要是化学能与热能之间的相互转化。化学物质中的化学能通过化学反应转化为热能,是人类生存和发展的动力之源;而热能转化为化学能又是人们进行科学研究,创造新物质不可或缺的条件和途径。
5.化学反应中能量变化的计算(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则:ΔQ=E(生成物)-E(反应物)。(2)用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成物分子成键时放出的总能量,ΔQ表示能量变化,则:ΔQ=Q(吸)-Q(放)。
(2015·山东省潍坊市五县高一下学期期中)以下叙述错误的是( )A.氢气与氯气反应后,体系的能量降低B.需要加热才能发生的反应一定是吸热反应C.若生成物的总能量高于反应物的总能量,则反应过程吸收能量D.化学反应的实质是旧化学键的断裂和新化学键的形成
【解析】 A.氢气与氯气反应是化合反应属于放热反应,故体系能量降低,A正确;B.吸热反应不一定需要加热,例如:Ba(OH)2·8H2O和NH4Cl反应,不需要加热,但却是吸热反应,故B错误;C.若生成物的总能量高于反应物的总能量,则反应过程吸收能量,若反应物的总能量高于生成物的总能量,则反应过程放出能量,故C正确;D.化学反应的实质是旧化学键的断裂和新化学键的形成,D正确,此题选B。【答案】 B
下列变化过程属于吸热的是( )A.NH4Cl的溶解B.SO2的催化氧化C.NO2转化成N2O4D.生石灰转化为熟石灰【解析】 A.NH4Cl溶解是吸热过程,正确;B.SO2的催化氧化是化合反应,属于放热反应,错误;C.NO2转化成N2O4是化合反应,属于放热过程,错误;D.生石灰变熟石灰是化合反应,属于放热反应,错误。【答案】 A
(2015·广东省东莞市莞美学校高一下学期第一次月考)下列说法正确的是( )A.化学反应未必伴随能量变化B.放热反应全部不需要加热即可发生C.需要加热条件的化学反应都是吸热反应D.化学变化中的能量变化主要由化学键变化引起的【解析】 化学反应过程中必然伴随有能量变化,而化学反应可以分为旧键断裂和新键形成两个过程,前者吸热,后者放热,化学反应的吸放热取决于两个过程的热量多少。【答案】 D
金刚石和石墨是碳元素的两种单质(同素异形体)。在100 kPa时,1 ml金刚石和1 ml石墨在氧气中完全燃烧放出的热量分别为395.4 kJ和393.5 kJ,下列说法不正确的是( )A.1 ml石墨转化为1 ml金刚石时要吸收1.9 kJ的热能B.1 ml石墨比1 ml金刚石的能量低C.1 ml石墨的总键能比1 ml金刚石的总键能小1.9 kJD.石墨比金刚石稳定
【解析】 石墨和金刚石完全燃烧都生成CO2,1 ml金刚石完全燃烧时比1 ml石墨多放热395.4 kJ-393.5 kJ=1.9 kJ,说明1 ml金刚石比1 ml石墨的能量高,石墨比金刚石稳定。【答案】 C
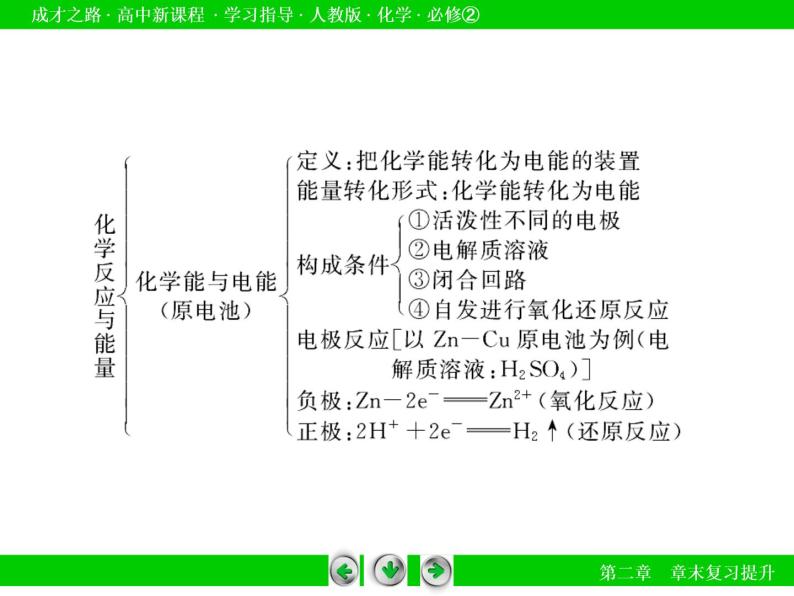
●专题归纳1.原电池的构成一般符合以下条件:(1)具有活动性不同的两极,较活泼的金属作负极,发生氧化反应;较不活泼的金属或非金属(石墨等)作正极得到电子,发生还原反应,本身不变。(2)具有电解质溶液。(3)用导线相连,组成闭合回路,或具备将化学能转变为电能的条件。(4)能自发地发生氧化还原反应。许多题目都围绕上述条件进行原电池的判断。
原电池的构造及工作原理
2.原电池的工作原理。(1)负极和正极。①负极。a.电极材料——较活泼的金属;b.电子流向——流出电子的一极;c.反应类型——发生氧化反应的一极;d.离子流向——阴离子移向的一极。
②正极。a.电极材料——较不活泼的金属或能导电的非金属;b.电子流向——流入电子的一极;c.反应类型——发生还原反应的一极;d.离子流向——阳离子移向的一极。(2)电极反应式的书写。负极:还原剂-ne-===氧化产物;正极:氧化剂+ne-===还原产物。
3.原电池电极反应式的书写(1)书写方法按照负极发生氧化反应,正极发生还原反应的规律,根据原电池总反应式正确判断出两极物质反应生成的产物,然后结合电解质溶液所能提供的离子,结合质量守恒、电荷守恒配平电极反应式。具体步骤为:①列物质,标得失;②选离子,配电荷;③配个数,巧用水;④两式加,验总式。
4.原电池原理的应用(1)加快化学反应速率。(2)比较金属活动性强弱。(3)防止金属的腐蚀(设计成原电池的正极)。(4)设计化学电源。
(2015·经典习题选萃)Al—Mg在不同的电解质溶液中分别构成原电池A、B。如图所示:
(1)指出各池中的负极材料并写出其电极反应式。①负极材料:A池________,B池________。②电极反应式:A池:正极:_______________________,负极:________________________。B池:正极:_____________________,负极:_____________________。(2)从构成原电池的几个组成部分来看,判断原电池负极,除了要考虑金属的活泼性外,还要考虑_____________。
(2015·浙江省杭州地区重点中学高一第二学期期中)我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O===4Al(OH)3,下列判断不正确的是( )A.电池工作时,电子由铝板沿导线流向铂网B.铂电极做成网状,可增大与氧气的接触面积C.正极反应为:O2+H2O+2e-===2OH-D.该电池通常只需要更换铝板就可继续使用
【解析】 A.根据电池总反应可知Al为负极,所以电池工作时,电子由铝板沿导线流向铂网,正确;B.网状结构可增大表面积,所以铂电极做成网状,可增大与氧气的接触面积,正确;C.正极上O2得电子生OH-,配平可得电极方程式为:O2+2H2O+4e-===4OH-,错误;D.该电池负极铝板参与反应,逐渐减少,所以该电池通常只需要更换铝板就可继续使用,正确。【答案】 C
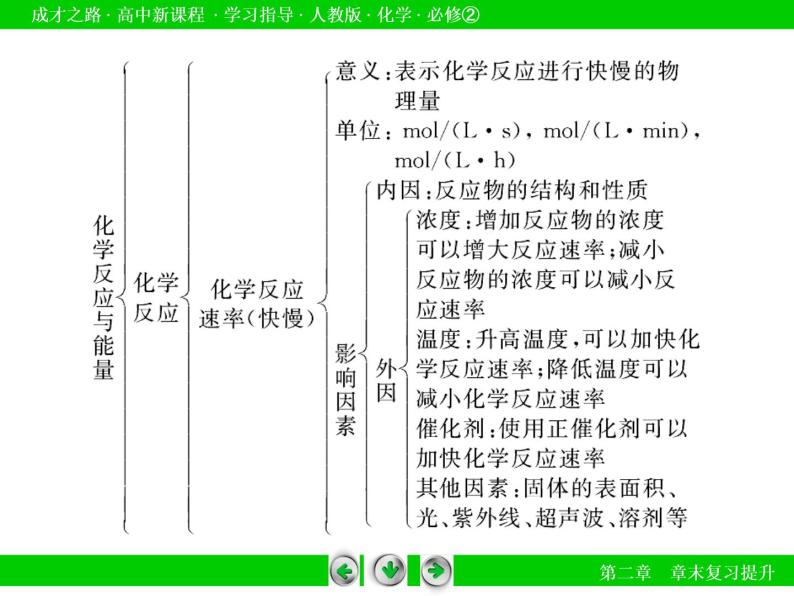
化学反应速率、化学反应限度
(2)影响化学反应速率的因素。增大化学反应速率的五种方法:增大反应物浓度;增大压强;升高温度;加入催化剂;增大固体的表面积。
2.化学反应的限度(1)对化学平衡状态理解的“三种误区”。①反应物完全转化成生成物。()可逆反应中反应物不能100%的转化,反应物和生成物共存。②化学反应停止了。()反应达到化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行,只是正反应速率等于逆反应速率。③外界条件改变对平衡状态无影响。()任何化学平衡状态均是相对的、有条件的,当外界条件变化时,化学平衡状态也会发生相应的变化。
(2)化学平衡状态判断的“两种误区”。①各组分的浓度相等证明反应达到平衡状态。()②各组分的分子数等于化学计量数之比证明反应达到平衡状态。()反应达到化学平衡状态时各组分的浓度保持不变,但不一定相等,也不一定等于化学计量数之比。
(3)A.根据质量守恒定律,气体的总质量不变,因为密闭容器的容积不变,所以气体的密度为定值,则容器内气体密度保持不变不能说明反应达到平衡,错误;B.因为该密闭容器绝热,所以若反应没有达到平衡,容器内温度会发生变化,所以当容器内温度不再变化时,反应达到平衡状态,正确;C.断裂3 ml H—H键的同时,断裂6 ml N—H键,说明正反应速率等于逆反应速率,反应达到平衡状态,正确;D.反应消耗N2、H2与产生NH3的速率都表示正反应速率,不能说明反应达到平衡状态,错误。【答案】 (1)B (2)B (3)BC
(2015·山东省淄博市一中高一下学期期中)(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则①反应的化学方程式为_____________________;②0~10 s内,用Z表示的化学反应速率_____________;
②0~10 s内,用Z表示的化学反应速率____________________;③X的转化率为________(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比);
高中化学人教版 (新课标)必修2第四章 化学与自然资源的开发利用综合与测试复习ppt课件: 这是一份高中化学人教版 (新课标)必修2第四章 化学与自然资源的开发利用综合与测试复习ppt课件,共46页。PPT课件主要包含了第四章,章末复习提升,金属的冶炼方法,答案②①③,●专题归纳,化石燃料的利用,●典例透析,海水资源的开发利用,环境污染与绿色化学等内容,欢迎下载使用。
2020-2021学年第二节 资源综合利用,环境保护备课ppt课件: 这是一份2020-2021学年第二节 资源综合利用,环境保护备课ppt课件,共60页。PPT课件主要包含了第四章,有机物,无机物,碳元素,氧氮硫,2煤的综合利用,煤的焦化,焦炉气,煤焦油,可燃性气体等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt: 这是一份高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt,共56页。PPT课件主要包含了有机化合物,第三章,章末复习提升,●典例透析,答案A,有机物的空间构型,除杂和检验方法等内容,欢迎下载使用。













