






高中化学人教版 (新课标)选修4 化学反应原理第二节 化学电源教课内容课件ppt
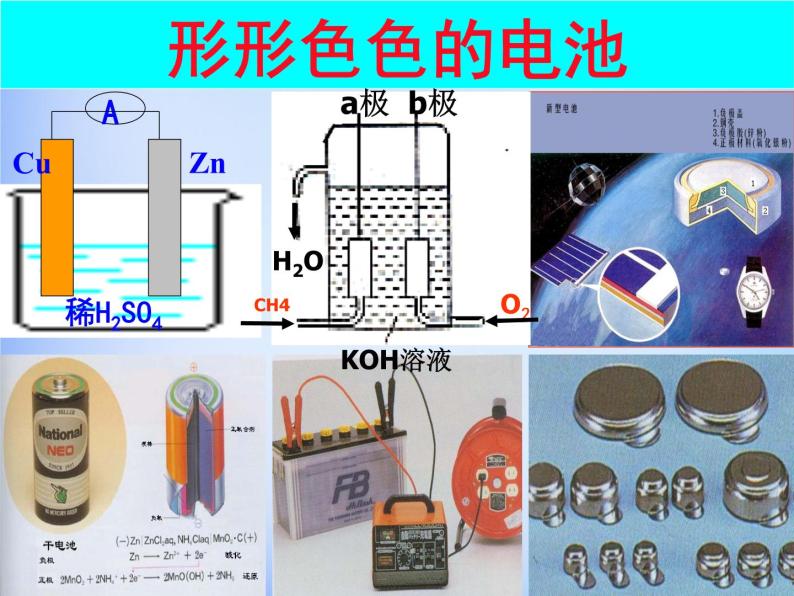
展开用于汽车的铅蓄电池和燃料电池
用于“神六”的太阳能电池
在日常生活和学习中,你用过哪些电池,你知道电池的其它应用吗?
将化学能转换成电能的装置
将太阳能转换成电能的装置
将放射性同位素自然衰变时产生的热能通过热能转换器转变为电能的装置
将化学能变成电能的装置
①一次电池又称不可充电电池——干电池②二次电池又称充电电池——蓄电池③燃料电池——氢氧燃料电池
正极:Ag2O + H2O+ 2e- =2Ag+2OH-
负极:Zn +2OH--2e- =Zn(OH)2
总反应: Zn+Ag2O + H2O = Zn(OH)2 +2Ag
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高,适用于大电流和连 续放电
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
PbO2 + 4H++SO42-+2e- =2PbSO4 +2H2O
铅蓄电池充电的反应则是上述反应的逆过程
PbSO4 +2e- =Pb + SO42-
PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42-
2PbSO4+2H2O=Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
比能量低、废弃电池污染环境
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
镍镉电池、镍氢电池、银锌电池、锂电池、锂离子电池……
燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能直接转换成电能的化学电源。(氢气、甲烷、肼、甲醇、氨等燃料电池……)
碱性电解质(KOH)负极: 2H2-4e-+4OH-==4H2O正极: O2+2H2O+4e-==4OH-总反应: 2H2+O2==2H2O
若把氢氧化钾换成硫酸,电极反应式又该如何呢?
酸性电解质:负极: 2H2-4e-==4H+正极: O2+4H++4e-==2H2O总反应:2H2+O2==2H2O
若将上述电池的电解液换成质子交换膜,所形成的电池就是质子交换膜电池,质子交换膜能允许氢离子通过,请写出质子交换膜电池的电极反应式和总反应式。
负极: 2H2-4e-==4H+正极: O2+4H++4e-==2H2O总反应:2H2+O2==2H2O
①氧化剂与还原剂在工作时不断补充; ②反应产物不断排出; ③能量转化率高(超过80%),普通的只有30%,有利于节约能源。 缺点:体积较大、附属设备较多 优点:能量转换率高、清洁、对环境好 其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极 ②电极材料一般不参加化学反应,只起传导电子的作用。
若将上述碱性电池中的燃料换成甲烷,请写出电极反应式和总反应式。
总反应式:CH4+2O2+2KOH=K2CO3+3H2O正极:2O2+8e-+4H2O=8OH-负极:CH4-8e-+10OH-=CO32-+7H2O
若将上述碱性电池中的燃料换成甲醇,请写出电极反应式和总反应式。
总反应:2CH3OH+3O2+4KOH=2K2CO3+6H2O
正极:3O2+12e-+6H2O=12OH-
负极:2CH3OH-12e-+16OH-=2CO32-+12H2O
怎样书写燃料电池的电极反应式和总反应式?
熔融盐燃料电池是一种高温燃料电池。其工作原理是在负极通入燃料,在正极通入氧气,使用高温熔融盐作为电解质。某燃料电池使用碳酸钾作为熔融盐电解质,在一极通入一氧化碳,在另一极通入二氧化碳和氧气的混合气,已知该电池的一个电极反应式为:CO+CO32--2e-=2CO2,请根据原电池的工作原理,写出另一电极反应的电极反应式和总反应方程式。
固体氧化物燃料电池是一种采用固体氧化物作为电解质的燃料电池。该电池中的固体氧化物电解质是一种特殊的固体电解质,能够允许氧离子通过。其工作原理是在负极通入燃料,在正极通入氧气,而氧气所形成的氧离子能够通过氧化物电解质。某燃料电池使用固体氧化物作为电解质,在一极通入一氧化碳,在另一极通入氧气,请根据原电池的工作原理,写出电极反应式和总反应方程式。
掌握每一类典型电池的正负极、电极反应;了解每一类电池的优缺点;对其它电池有初步的认识
冲击高考题: 1、(江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s下列说法错误的是 ( )A 电池工作时,锌失去电子B 电池正极电极反应式为: 2MnO2s+H2Ol+2e=Mn2O3s+2OHaqC 电池工作时,电子由正极通过外电路流向负极D 外电路中每通过02 ml电子,锌的质量理论上减少65 g
2:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式: ,此时电池内总的反应式: 。
CH4+10OH- - 8e-=CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
高中化学第二节 化学电源课文课件ppt: 这是一份高中化学第二节 化学电源课文课件ppt,共14页。PPT课件主要包含了发明电池的故事,燃料电池等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础第二节 化学电源教学演示ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础第二节 化学电源教学演示ppt课件,共50页。PPT课件主要包含了七嘴八舌谈电池,用途广泛的电池,化学电池,一次电池,二次电池,燃料电池,思考与讨论,燃料电池的规律,化学电池的组成等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 化学电源授课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 化学电源授课课件ppt,共27页。PPT课件主要包含了形形色色的电池,用途广泛的电池,化学电池,你知道吗,银锌钮扣电池,普通干电池,碱性锌-锰干电池,铅蓄电池,放电过程总反应,氧化反应等内容,欢迎下载使用。













