






人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡教课内容课件ppt
展开1、什么叫饱和溶液?什么叫不饱和溶液?
一定温度下,不能再溶解溶质的溶液叫饱和 溶液。能继续溶解溶质的溶液叫不饱和溶液。
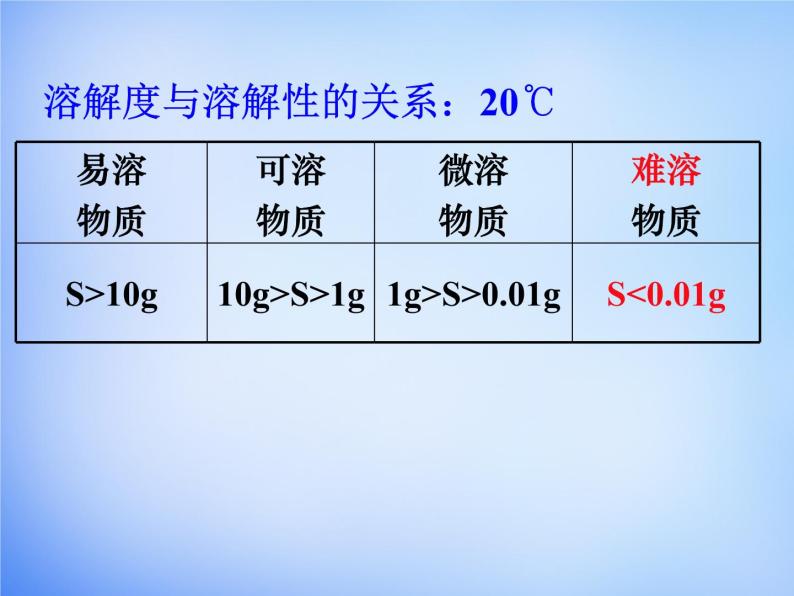
2、溶解性是指:___________________________ 溶解性是物质的_______性质。 溶解性大小跟 ___________________有关。
一种物质溶解在另一种物质中的能力。
物质的溶解性只能粗略表示物质的溶解能力的强弱,为了精确表示物质的溶解能力,化学上引入了“溶解度”的概念。
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。
注意:条件:一定温度。标准:100克溶剂 状态:饱和状态 单位:克 任何物质的溶解是有条件的,在一定的条件下某物质的溶解量也是有限的,不存在无限可溶解的物质。
溶解度与溶解性的关系:20℃
讨论: ⑴ NaCl在水溶液里达到溶液平衡状态时有何特征?
⑵ 要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
NaCl的溶解速率与结晶速率相等;并且只要溶解平衡的条件不变,该溶液中溶解的NaCl的量就是一个恒定值。
在饱和NaCl溶液中加入浓盐酸
NaCl饱和溶液中有固体析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl: Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
一、Ag+和Cl-的反应能进行到底吗?
认真阅读 思考与交流表3—4
(1)当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?
(2)有沉淀生成的复分解类型的离子反应能不能完全进行到底呢?
不能,沉淀即是难溶电解质,不是绝对不溶,只不过溶解度很小,难溶电解质在水中存在溶解平衡。
(3)难溶电解质的定义是什么?难溶物的溶解度是否为0?
习惯上,将溶解度小于0.01g的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0
(1)生成沉淀的离子反应能发生的原因
2、难溶电解质的溶解平衡
化学上通常认为残留在溶液中的离子浓度小于10-5ml/L时,沉淀达到完全。
(2)AgCl溶解平衡的建立
当v(溶解)= v(沉淀)时, 得到饱和AgCl溶液,建立溶解平衡
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
(4)溶解平衡的特征:
(3)溶解平衡的概念:
(5)影响难溶电解质溶解平衡的因素:
a、绝对不溶的电解质是没有的。b、同是难溶电解质,溶解度差别也很大。c、易溶电解质做溶质时只要是饱和溶液也可 存在溶解平衡。
①内因:电解质本身的性质
a、浓度:加水,平衡向溶解方向移动。
b、温度:升温,多数平衡向溶解方向移动。
练:书写碘化银、氢氧化镁溶解平衡的表达式
⑵、表达式: 平衡时:Ksp=[c(Mn+)]m·[c(Am—)]n
⑶、溶度积规则 任意时刻:Qc = [c(Mn+)]m·[c(Am—)]n 当: Qc > Ksp 过饱和,析出沉淀, Qc = Ksp饱和,平衡状态 Qc < Ksp 未饱和。
3、溶度积⑴、溶度积(Ksp):难溶电解质的溶解平衡中,离子浓度幂的乘积。
练习1:在100mL 0.01ml/LKCl 溶液中,加入 1mL 0.01ml/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10) ( ) A.有AgCl沉淀析出 B.无AgCl沉淀 C.无法确定 D.有沉淀但不是AgCl
c(Cl-)=(O.O1×0.1) ÷0.101=9.9×10-3ml/L
c(Ag+)=(O.O1×0.001) ÷0.101=9.9×10-5ml/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
练习2:已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图1(饱和Ag2SO4溶液中c(Ag+)=0.034ml/L)。若t1时刻在上述体系中加入100mL 0.020ml/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
原溶液中: c(SO42-)=c(Ag+) ÷2=0.034ml/L÷2=0.017ml/L加入Na2SO4后: c(Ag+)=0.034ml/L÷2=0.017ml/L c(SO42-)=(0.017ml/L+0.020ml/L) ÷2=0.0185ml/L则QC= c(Ag+)2× c(SO42-)=0.0172×0.0185=5.35×10-6因QC
如:工业原料氯化铵中混有氯化铁,加氨水调 pH值至7~8
Fe3+ + 3NH3•H2O=Fe(OH)3↓+3NH4+
② 加沉淀剂 如:沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂
Cu2++S2-= CuS↓ Hg2++S2-= HgS↓
硫酸中硫酸根浓度大,使平衡向沉淀方向移动,有利于沉淀的生成。
例:已知Fe3+在PH3到4之间开始沉淀,在PH7到8之间沉淀完全,而Fe2+,Cu2+在8到9之间开始沉淀11到12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
例:为什么硫酸钡在硫酸中的溶解度比在纯水 中小。
先把Fe2+氧化成Fe3+,然后调PH至7到8使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
氧化剂可用:氯气、双氧水、氧气等(不引入杂质)
调PH可用:氧化铜、碳酸铜等(不引入杂质)
氧化剂:硝酸、高锰酸钾、氯气、氧气、双氧水等
调PH:氨水、氢氧化钠、氧化铜、碳酸铜
1、如果要除去某溶液中的SO42-,你选择加 入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成;不可能使要除去的离子通过沉淀完全除去,因为不溶是相对的,沉淀物在溶液中存在溶解平衡。
生成沉淀的离子反应的本质
反应生成沉淀使溶液中某些离子浓度变得更小。
认识1:生成沉淀的离子反应之所以能够发生,在于生成物的溶解度很小。
认识2:难溶电解质的溶解度尽管很小,但不会为0。
认识3:溶解度小于0.01g的电解质称为难溶电解质,残留在溶液中的离子浓度小于1X10-5ml/L,就认为反应完全了。
例1. 在1L含1.0×10-3mlL-1 的SO42-溶液中,注入0.01ml BaCl2溶液(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 4×10-10 ml2L-2
解:c(Ba2+)=0.01ml/L,c(SO42-)=0.001ml/L,生成BaSO4沉淀后,Ba2+过量,剩余的即[Ba2+]=0.01-0.001=0.009ml/L. [SO42-]=Ksp/[Ba2+]= 1.1×10-10/9.0×10-3=1.2×10-8(ml/L) 因为,剩余的即[SO42-]=1.2×10-8ml/L<1.0×10-5ml/L 所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度≤10-5ml/L时,认为离子已沉淀完全或离子已有效除去。
例2. 用5%的Na2SO4溶液能否有效除去误食的Ba2+?已知:Ksp(BaSO4)=1.1×10-10ml2L-2
解:5% 的Na2SO4溶液中的[SO42-]≈0.352ml/L, [Ba2+]=(1.1×10-10ml2L-2)/ (0.352ml/L) =2.9×10-10mlL-1 因为剩余的[Ba2+]< 10-5ml/L 所以有效除去了误食的Ba2+。
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是( )A、MgO B、MgCO3C、NaOH D、Mg(OH)2
2.向0.1ml/LAgNO3溶液的试管中滴加0.1ml/LNaCl溶液,至不再有白色沉淀生成为止。取其中澄清溶液,逐滴加入饱和Na2S溶液,有无沉淀生成?如果先向AgNO3溶液中加Na2S溶液至沉淀完全,再向上层清液中滴加NaCl,情况又如何?试解释原因。是否可以用Na2SO4代替Na2S?
没有沉淀生成。Ag2S饱和溶液中Ag+太少,不能生成AgCl沉淀。
不可以,设c(SO42-)=0.1ml/L,为使而之沉淀,c(Ag+)=(1.4×10-5/0.1)1/2=1.18×10-2ml/L。而在AgCl饱和溶液中c(Ag+)=(1.8×10-10)1/2=1.34×10-5ml/L
3.在粗制CuSO4·5H2O晶体中常含有杂质Fe2+ 。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱到溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。试解释原因。溶解性:Fe(OH)2>Cu(OH)2>Fe(OH)3。3.小结Ksp的大小与沉淀转化的关系。对于同类型的难溶电解质, Ksp的大小与溶解度的大小一致, Ksp较大的沉淀可以转化为Ksp较小的沉淀。
注意: 分步沉淀 溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序沉淀,叫作分步沉淀。 对同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全;如AgCl、AgBr、AgI 对不同类型的沉淀,其沉淀先后顺序要通过计算才能确定。如AgCl和Ag2CrO4 一般认为沉淀离子浓度小于1.0×10-5 ml/L时,则认为已经沉淀完全
例1:如果溶液中Fe3+和Mg2+的浓度均为0.10 ml/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么?
pOH = 10.8 , pH = 3.2
Mg2+开始沉淀的pH值为:
pOH = 4.9, pH =9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
已知25℃,AgI的饱和溶液中c(Ag+)为1.22×10-8ml·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5ml·L-1。若在5mL含有KCl和KI各为0.01ml·L-1的溶液中,加入8mL0.01ml·L-1AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是: 。
答案:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
a 、难溶于水的盐溶于酸中如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸
b 、难溶于水的电解质溶于某些盐溶液如:Mg(OH)2溶于NH4Cl溶液
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因
在溶液中存在Mg(OH)2的溶解平衡: Mg(OH)2(s) ⇌Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,1、NH4+直接结合OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
2、NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
思考:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?
由于人体内胃酸的酸性较强(pH0.9-1.5),如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使Qc < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体中毒。
所以,不能用BaCO3作为内服造影剂“钡餐”。
而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”。
练习 试用Qc与Ksp的关系 解释以下问题:(1) FeS能溶于浓硝酸或盐酸。(2) CuS能溶于浓硝酸; (3) AgCl能溶于氨水;
解析:(1) H2SFeS Fe2+ + S2- S + NO + H2O
小结:难溶电解质溶解的规律
不断减小溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解
1、从难溶电解质溶解平衡移动的角度来解释石灰岩溶洞的形成。
CaCO3 Ca 2+ + CO3 2-
CO2 + CO3 2- + H2O = 2HCO3 - (CaHCO3可溶)
Ca(HCO3)2 == CaCO3↓ + H2O +CO2↑
3.在AgNO3溶液中逐滴加入氨水,先生成难溶于 水的AgOH沉淀,继续加入氨水, AgOH沉淀溶 解,请从溶解平衡移动的角度解释沉淀溶解的 过程.
信息:Cu2+ 和 Ag+ 更易与NH3 生成[Cu(NH3)4]2+ 和 [Ag(NH3)2]+
演示实验 3-4、3-5
注意:记录现象,写出相应的方程式
问题:如果将上述两个实验中沉淀生成和转化的操作步骤颠倒顺序,会产生什么结果?
沉淀不会转化。沉淀只是从溶解度小的向溶解度更小的方向转化
沉淀转化的实质:沉淀转化的条件:
平衡体系中离子浓度改变,沉淀溶解平衡发生移动一般是难溶的物质转化成更加难溶的物质(两者溶解度差别越大,转化越容易)
溶解度大的沉淀:溶度积常数大的沉淀
溶解度小的沉淀:溶度积常数小的沉淀
① 锅炉除水垢(CaSO4)
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀.锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
② 一些自然现象的解释
练习3:龋齿的形成原因及防治方法
(1) 牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是: 。
发酵生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
(2)已知Ca5(PO4)3F的KSP=2.8×10-61,比Ca5(PO4)3OH更难溶,牙膏里的氟离子会与Ca5(PO4)3OH反应。请用离子方程式表示使用含氟牙膏防止龋齿的原因
(实验3-4、3-5 沉淀转化)
【练习】 4)试用平衡移动原理解释下列事实 CaCO3不溶于水,但却能溶于稀盐酸中。
CaCO3(s) CO32-(aq) + Ca2+(aq)
ZnS沉淀转化为CuS沉淀
(1).在1试管中加入ZnSO4溶液,再滴入Na2S溶液,观察现象。(2).静置后倾去上层清液,蒸馏水洗涤沉淀2-3次。(3).向沉淀中滴加适量的CuSO4溶液,观察现象。
实验现象:有白色沉淀出现,白色沉淀转化成为黑色沉淀。
为什么白色的ZnS沉淀会转化成为黑色的CuS沉淀?
ZnS在水中存在沉淀溶解平衡:
CuS在水中存在沉淀溶解平衡:
ZnS与CuS是同类难溶物,Ksp(ZnS) >Ksp(CuS),CuS的溶解度远小于ZnS的溶解度。
当向ZnS沉淀上滴加CuSO4溶液时, ZnS溶解产生的S2-与 CuSO4溶液中的Cu2+足以满足Qc>Ksp(CuS)的条件, S2-与Cu2+结合产生CuS沉淀并建立沉淀溶解平衡。 CuS沉淀的生成,使得S2-的浓度降低,导致S2-与Zn2+的Qc
ZnS沉淀转化为CuS沉淀的总反应:
ZnS(s) + Cu2+(aq) = CuS(s) + Zn2+
探究活动 —— AgCl能和KI溶液反应吗?
[实验演示] 向盛有10滴0.1ml/L AgNO3 溶 液的试管中滴加0.1ml/LNaCl溶液, 至不再有白色沉淀生成。向其中滴加 0.1ml/L KI溶液,观察实验现象。[实验现象]
白色沉淀渐渐转化为黄色。
请从平衡移动的角度分析沉淀从白色转变成黄色的可能原因。
信息:KSP(AgCl)=1.8 × 10-10 KSP(AgI)=8.3 × 10-17
(1)求溶液中c(Ag+)有多大?
(2)向该溶液加入KI,使I-浓度达到0.1ml/L
KSP=c(Ag+) 平×c(Cl-)平
溶液中c(Ag+)×c(I-) = 1.34×10-5×10-1 = 1.34×10-6
KSP(AgI)=8.3×10-17
c(Ag+)×c(I-) > KSP(AgI)
AgCl+I- = AgI+Cl-
改变条件,原沉淀溶解平衡发生移动,遵循勒沙特列 原理:
沉淀的转化是_________________________ ___________________。沉淀的转化实质是_____________的移动。通常,一种沉淀可转化为更难溶的沉淀,两种难溶物的__________差别越大,这种转化的趋势就越大。
一种难溶电解质转化为另一种难溶电解质的过程
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
沉淀转化的应用 举例1
1、在工业废水中常含有 Cu2+、Hg2+、Pb2+等重金属离子,处理时通常投入 FeS固体以 除去这些离子,试解释其原因?
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因 。
生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
5Ca2++3PO43-+F-=Ca5(PO4)3F↓
沉淀转化的应用 举例2
例:将足量的ZnS粉末加入到10mL0.001ml·L-1的CuSO4溶液中,是否有CuS沉淀生成?请通过计算后回答。已知: Ksp(ZnS)=1.6×10-24 ml 2 ·L - 2 Ksp(CuS) =1.3×10-36 ml 2 ·L - 2
解:在ZnS沉淀溶解平衡体系中产生的硫离子浓度为:[S2-]=[Zn2+]=(Ksp)1/2 =(1.6×10-24 ml 2 ·L - 2 )1/2=1.26×10-12 ml ·L - 1
Qc (CuS) =C(Cu2+) ·C(S2-) =1.0×10- 3ml ·L-1 ×1.26×10-12ml ·L-1 =1.26×10-15ml2·L-2
因为:Qc(CuS) > Ksp(CuS),所以ZnS沉淀会转化为CuS沉淀。
有关一种沉淀为什么转化为另一种沉淀的定量计算:
人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件,共20页。PPT课件主要包含了课堂练习,②溶度积规则,pH32,pH91等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡多媒体教学ppt课件,共19页。PPT课件主要包含了课堂练习,②溶度积规则,pH32,pH91等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件,共13页。













