人教版 (新课标)必修1第一节 金属的化学性质第2课时教学设计
展开【温故知新】
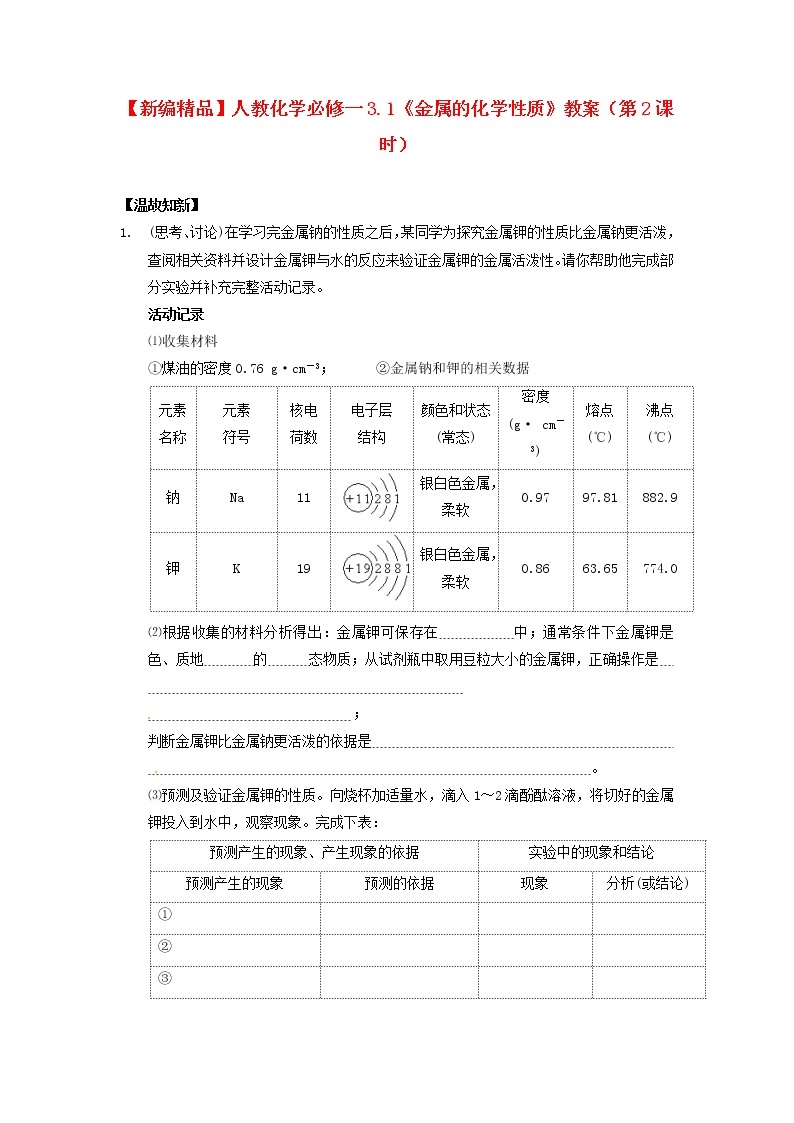
(思考、讨论)在学习完金属钠的性质之后,某同学为探究金属钾的性质比金属钠更活泼,查阅相关资料并设计金属钾与水的反应来验证金属钾的金属活泼性。请你帮助他完成部分实验并补充完整活动记录。
活动记录
⑴收集材料
①煤油的密度0.76 g·cm-3; ②金属钠和钾的相关数据
⑵根据收集的材料分析得出:金属钾可保存在 中;通常条件下金属钾是 色、质地 的 态物质;从试剂瓶中取用豆粒大小的金属钾,正确操作是
;
判断金属钾比金属钠更活泼的依据是
。
⑶预测及验证金属钾的性质。向烧杯加适量水,滴入1~2滴酚酞溶液,将切好的金属钾投入到水中,观察现象。完成下表:
①请将预测实验中产生的现象和产生现象的依据填入以上表格中;
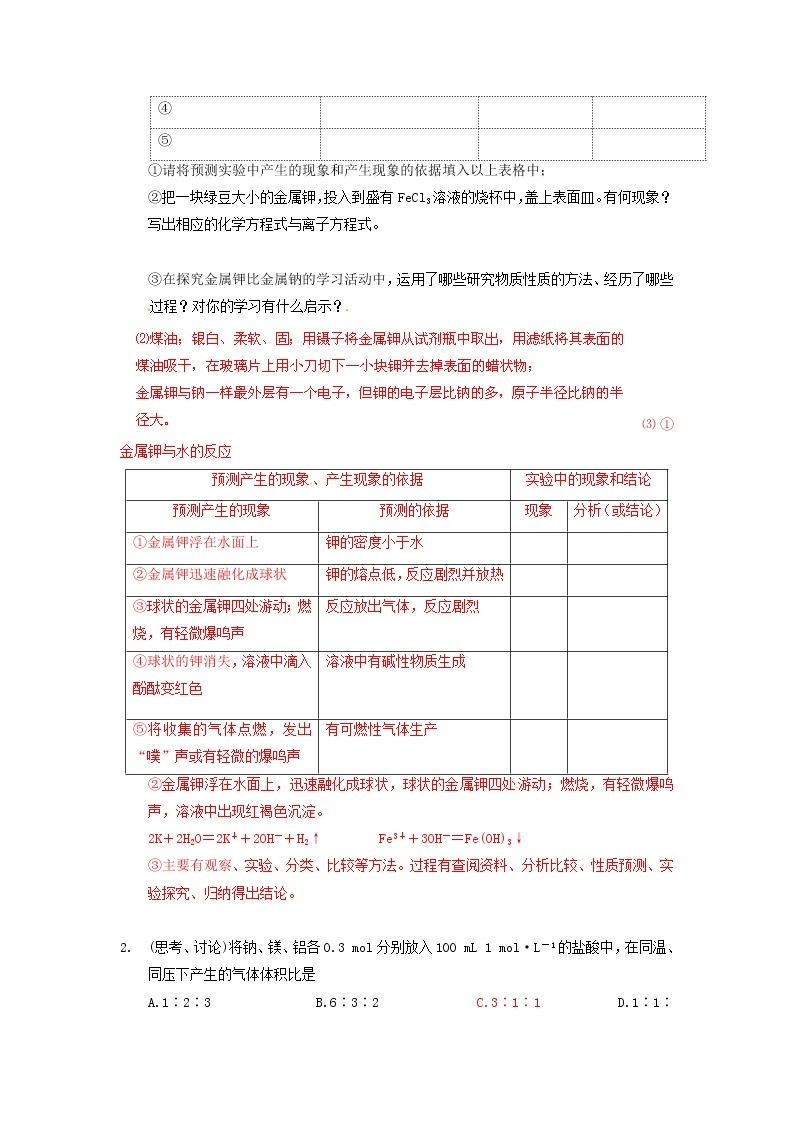
②把一块绿豆大小的金属钾,投入到盛有FeCl3溶液的烧杯中,盖上表面皿。有何现象?写出相应的化学方程式与离子方程式。
③在探究金属钾比金属钠的学习活动中,运用了哪些研究物质性质的方法、经历了哪些过程?对你的学习有什么启示?
⑶①金属钾与水的反应
②金属钾浮在水面上,迅速融化成球状,球状的金属钾四处游动;燃烧,有轻微爆鸣声,溶液中出现红褐色沉淀。
2K+2H2O=2K++2OH-+H2↑ Fe3++3OH-=Fe(OH)3↓
③主要有观察、实验、分类、比较等方法。过程有查阅资料、分析比较、性质预测、实验探究、归纳得出结论。
(思考、讨论)将钠、镁、铝各0.3 ml分别放入100 mL 1 ml·L-1的盐酸中,在同温、同压下产生的气体体积比是
A.1∶2∶3 B.6∶3∶2 C.3∶1∶1 D.1∶1∶1
【课堂生成】
【课堂研讨】
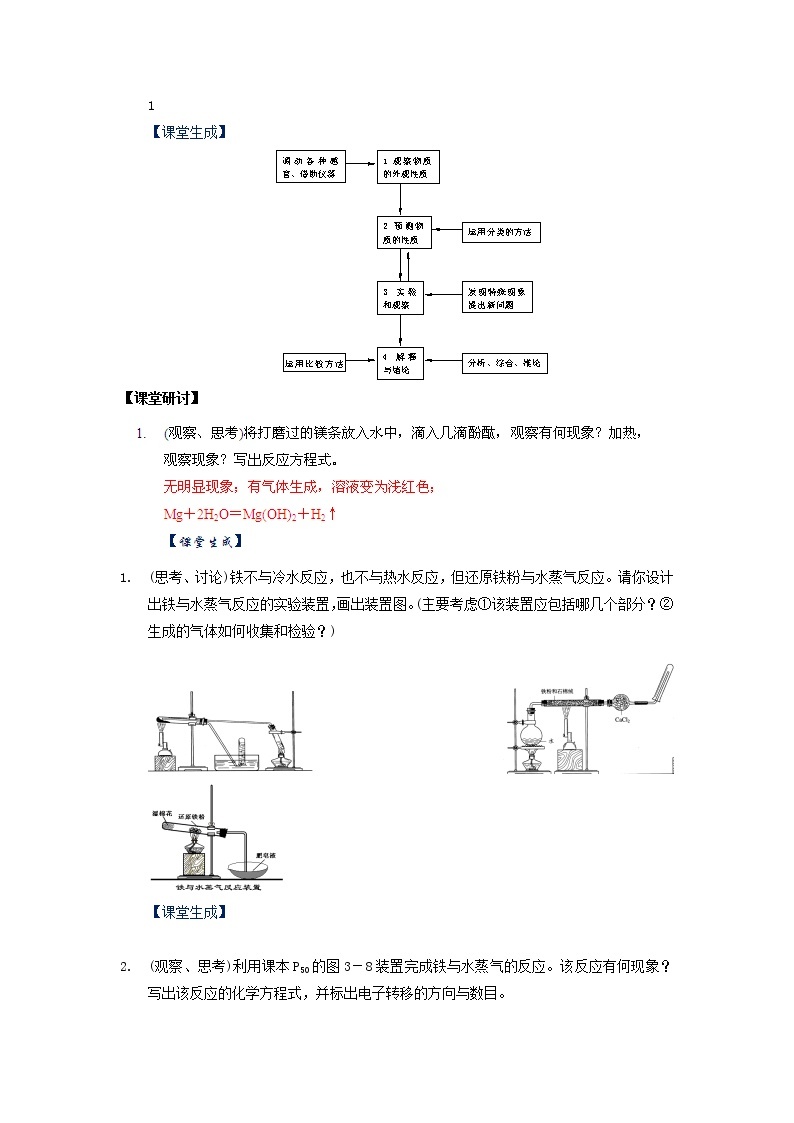
(思考、讨论)铁不与冷水反应,也不与热水反应,但还原铁粉与水蒸气反应。请你设计出铁与水蒸气反应的实验装置,画出装置图。(主要考虑①该装置应包括哪几个部分?②生成的气体如何收集和检验?)
【课堂生成】
(观察、思考)利用课本P50的图3-8装置完成铁与水蒸气的反应。该反应有何现象?写出该反应的化学方程式,并标出电子转移的方向与数目。
现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声。
3Fe+4H2OFe3O4+4H2
【课堂生成】
【巩固练习】
完成《课时作业本》P127页的10题与P128。
由铁、锌、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是
A.铁 B.锌 C.铝 D.镁
两种金属混合物粉末15 g,与足量的盐酸反应时生成标准状况下11.2 L氢气,符合上述情况的金属混合物是
A.Mg、Fe B.Zn、Ag C.Al、Zn D.Mg、Al
将11.5 g钠、9 g铝、28 g铁分别投入200 mL 1 ml/L的盐酸中,下列分析结果正确的是
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应的速率仅次于钠,但产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
把一质量为2.3 g的钠用一铝箔(上面用针刺有许多小孔)包好,放入到足量水中,理论上可收集到氢气(标准状况下)
L L C.略大于1.12L D.略小于1.12 L
等质量的两份铝粉分别与足量的氢氧化钠溶液和稀硫酸反应,若消耗两溶液的体积相等,则两溶液的物质的量浓度之比是
A.1∶2 B.2∶3 C.3∶2 D.1∶1
质量比为2∶3的金属铝分别跟足量稀H2SO4和NaOH溶液反应,则产生H2的体积比是(同条件下)
A.1∶2 B.1∶3 C.2∶3 D.3∶2
10.Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物。
⑴取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为a L。①请写出该反应的离子方程式;②混合物中的Al的物质的量是多少?(用含字母的数学式表示)。
①2Al+2H2O+2OH-=2AlO2-+3H2↑
② EQ \f(a,33.6) ml
⑵另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为b L。①该反应中转移电子的物质的量是多少?②混合物中Fe的质量为多少克?(用含字母的数学式表示)
① EQ \f(b,11.2) ml ②2.5(b-a) g
将一定质量的铝分为两等份,一份投入到100 mL的盐酸中恰好完全反应后得到氯化铝溶液和氢气;另一份加入到100 mL 2 ml/L的NaOH溶液恰好完全反应。则
⑴两份铝充分反应后共得到H2的体积为多少(标况下)? 13.44 L
⑵盐酸的物质的量浓度为多少? 6 ml/L
元素
名称
元素
符号
核电
荷数
电子层
结构
颜色和状态(常态)
密度
(g· cm-3)
熔点
(℃)
沸点
(℃)
钠
Na
11
银白色金属,柔软
0.97
97.81
882.9
钾
K
19
银白色金属,柔软
0.86
63.65
774.0
预测产生的现象、产生现象的依据
实验中的现象和结论
预测产生的现象
预测的依据
现象
分析(或结论)
①
②
③
④
⑤
预测产生的现象、产生现象的依据
实验中的现象和结论
预测产生的现象
预测的依据
现象
分析(或结论)
①金属钾浮在水面上
钾的密度小于水
②金属钾迅速融化成球状
钾的熔点低,反应剧烈并放热
③球状的金属钾四处游动;燃烧,有轻微爆鸣声
反应放出气体,反应剧烈
④球状的钾消失,溶液中滴入酚酞变红色
溶液中有碱性物质生成
⑤将收集的气体点燃,发出“噗”声或有轻微的爆鸣声
有可燃性气体生产
化学必修1第一节 金属的化学性质教学设计: 这是一份化学必修1第一节 金属的化学性质教学设计,共6页。教案主要包含了金属与酸和水的反应等内容,欢迎下载使用。
2020-2021学年第三章 金属及其化合物第一节 金属的化学性质教案及反思: 这是一份2020-2021学年第三章 金属及其化合物第一节 金属的化学性质教案及反思,共4页。教案主要包含了金属与非金属的反应等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第一节 金属的化学性质教学设计: 这是一份高中化学人教版 (新课标)必修1第一节 金属的化学性质教学设计,共5页。教案主要包含了铝与氢氧化钠溶液的反应等内容,欢迎下载使用。