
高中化学人教版 (新课标)必修1第二章 化学物质及其变化第三节 氧化还原反应教案
展开必修一第二章第三节 氧化还原反应
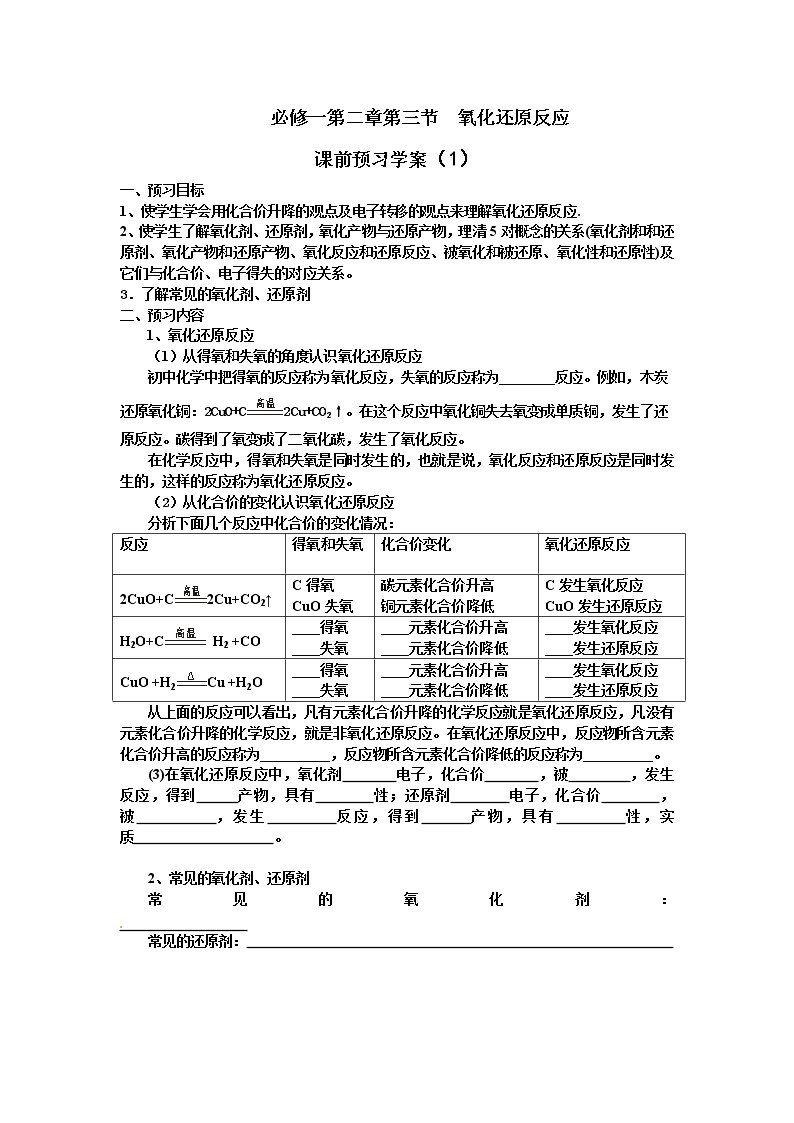
课前预习学案(1)
一、预习目标
1、使学生学会用化合价升降的观点及电子转移的观点来理解氧化还原反应.
2、使学生了解氧化剂、还原剂,氧化产物与还原产物,理清5对概念的关系(氧化剂和和还原剂、氧化产物和还原产物、氧化反应和还原反应、被氧化和被还原、氧化性和还原性)及它们与化合价、电子得失的对应关系。
3.了解常见的氧化剂、还原剂
二、预习内容
1、氧化还原反应
(1)从得氧和失氧的角度认识氧化还原反应
初中化学中把得氧的反应称为氧化反应,失氧的反应称为________反应。例如,木炭还原氧化铜:2CuO+C2Cu+CO2↑。在这个反应中氧化铜失去氧变成单质铜,发生了还原反应。碳得到了氧变成了二氧化碳,发生了氧化反应。
在化学反应中,得氧和失氧是同时发生的,也就是说,氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
(2)从化合价的变化认识氧化还原反应
分析下面几个反应中化合价的变化情况:
反应
得氧和失氧
化合价变化
氧化还原反应
2CuO+C2Cu+CO2↑
C得氧
CuO失氧
碳元素化合价升高
铜元素化合价降低
C发生氧化反应
CuO发生还原反应
H2O+C H2 +CO
____得氧
____失氧
____元素化合价升高
____元素化合价降低
____发生氧化反应
____发生还原反应
CuO +H2Cu +H2O
____得氧
____失氧
____元素化合价升高
____元素化合价降低
____发生氧化反应
____发生还原反应
从上面的反应可以看出,凡有元素化合价升降的化学反应就是氧化还原反应,凡没有元素化合价升降的化学反应,就是非氧化还原反应。在氧化还原反应中,反应物所含元素化合价升高的反应称为__________,反应物所含元素化合价降低的反应称为__________。
(3)在氧化还原反应中,氧化剂 电子,化合价 ,被 ,发生 反应,得到 产物,具有 性;还原剂 电子,化合价 ,被 ,发生 反应,得到 产物,具有 性,实质 。
2、常见的氧化剂、还原剂
常见的氧化剂:
常见的还原剂:
三、提出疑惑
同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中
疑惑点
疑惑内容
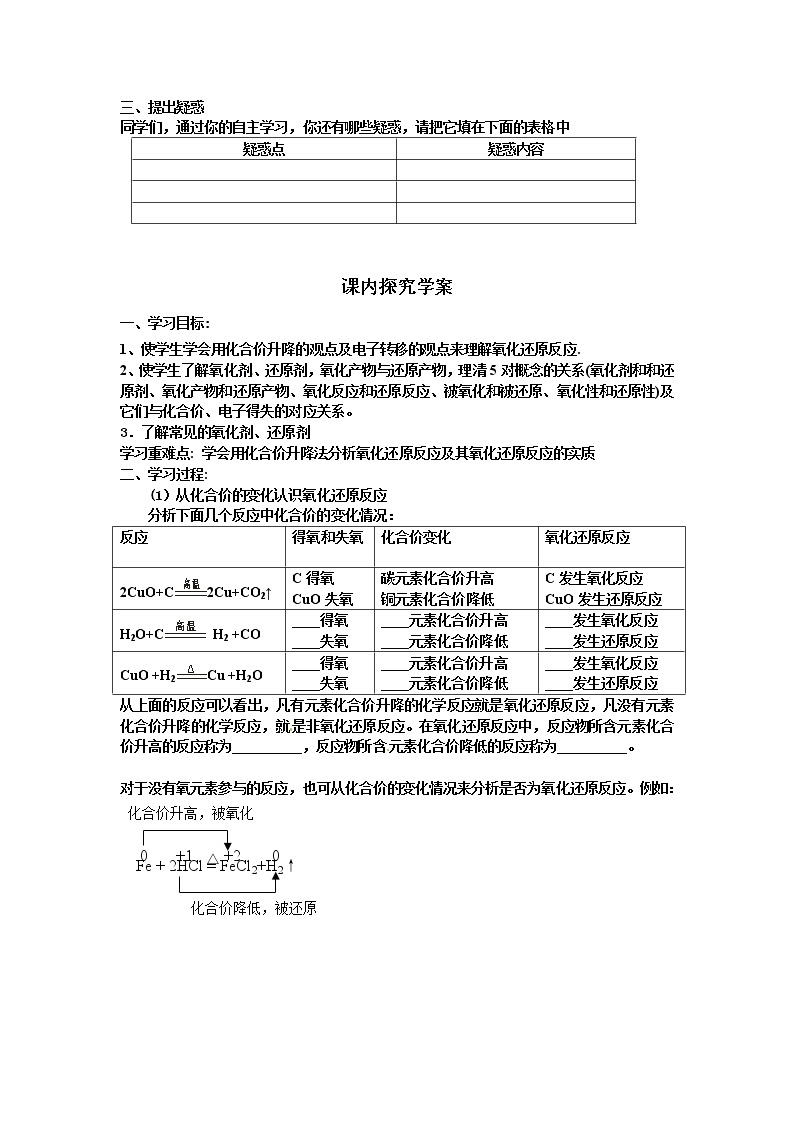
课内探究学案
一、学习目标:
1、使学生学会用化合价升降的观点及电子转移的观点来理解氧化还原反应.
2、使学生了解氧化剂、还原剂,氧化产物与还原产物,理清5对概念的关系(氧化剂和和还原剂、氧化产物和还原产物、氧化反应和还原反应、被氧化和被还原、氧化性和还原性)及它们与化合价、电子得失的对应关系。
3.了解常见的氧化剂、还原剂
学习重难点: 学会用化合价升降法分析氧化还原反应及其氧化还原反应的实质
二、学习过程:
(1)从化合价的变化认识氧化还原反应
分析下面几个反应中化合价的变化情况:
反应
得氧和失氧
化合价变化
氧化还原反应
2CuO+C2Cu+CO2↑
C得氧
CuO失氧
碳元素化合价升高
铜元素化合价降低
C发生氧化反应
CuO发生还原反应
H2O+C H2 +CO
____得氧
____失氧
____元素化合价升高
____元素化合价降低
____发生氧化反应
____发生还原反应
CuO +H2Cu +H2O
____得氧
____失氧
____元素化合价升高
____元素化合价降低
____发生氧化反应
____发生还原反应
从上面的反应可以看出,凡有元素化合价升降的化学反应就是氧化还原反应,凡没有元素化合价升降的化学反应,就是非氧化还原反应。在氧化还原反应中,反应物所含元素化合价升高的反应称为__________,反应物所含元素化合价降低的反应称为__________。
对于没有氧元素参与的反应,也可从化合价的变化情况来分析是否为氧化还原反应。例如:
化合价降低,被还原
0
+2
+1
0
△
Fe + 2HCl = FeCl2+H2↑
化合价升高,被氧化
化合价降低,被还原
0
+1
0
-1
Na + Cl2 = 2NaCl
化合价升高,被氧化
判断化学反应是否属于氧化还原反应,关键是要观察和判断反应前后的化合价是否有升降的变化。正确判断化合价变化要做到两点:
要掌握常见元素的化合价。元素的化合价与其最外层的电子数有密切关系,如钠原子、镁原子、铝原子最外层的电子数分别为1、2、3,它们均容易失去最外层的电子形成稳定结构,所以化合价分别为+1价、+2价、+3价,氯元素、氧元素的最外层电子数分别为7、6,它们分别得到1个和2个电子形成稳定结构,所以它们的化合价分别为-1价和-2价。
(2)从电子转移的角度来认识氧化还原反应
氧化还原反应中化合价的变化的本质是电子的转移。以下列两个反应来分析化合价变化与电子转移的关系:
化学反应
2Na +Cl22NaCl
H2 +Cl22HCl
化合价的变化
钠元素由____价升高到____价
氯元素由____价降低到____价
氢元素由____价升高到____价
氯元素由____价降低到____价
电子转移
钠原子的最外层为____个电子,氯原子最外层为____个电子,在反应过程中,钠原子____1个电子形成钠离子,氯原子____1个电子形成氯离子,两种离子都达到稳定的结构
氢原子的最外层为____个电子,氯原子最外层为____个电子,在反应过程中,双方各以最外层的1个电子组成共用电子对,达到稳定结构。但共用电子对____氯原子,____氢原子
化合价变化与电子转移关系
化合价降低,得到电子
0
+1
0
-1
Na + Cl2 = 2NaCl
化合价升高,失去电子
化合价降低,电子对偏向
0
+1
0
-1
H2 + Cl2 = 2HCl
化合价升高,电子对偏离
从上面的分析可知,在氧化还原反应中,化合价升高是由于该元素原子在反应中失去电子或电子对偏离的过程,化合价降低是由于该元素原子在反应中得到电子或电子对偏向的过程。也就是说,氧化还原反应的本质是化学反应有电子转移(得失或偏移)。
(3)氧化还原反应的概念
在中学化学中,对氧化还原反应的认识过程可以归纳如下表:
填表
得氧和失氧观
化合价升降观
电子得失观
氧化反应
还原反应
氧化还原反应
特 征
实 质
氧化还原反应有下列两种关系:
①还原剂----化合价升高—失去电子—被氧化—发生氧化反应
②氧化剂-----化合价降低—得到电子—被还原—发生还原反应
三、当堂检测
1、判断下列反应属于氧化还原反应的是( )
A.、CaO+H2O=Ca(OH)2
B、2Mg + O2 2MgO
C、Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑
D、Cu(OH)2 CuO + H2O
2、氧化还原反应的实质是( )
A、氧元素的得与失 B、化合价的升降
C、电子的得失或偏移 D、分子中原子重新组合
3、下列反应属于非氧化还原反应的是( )
A、Fe2O3+3CO2Fe+3CO2 B、NH4NO3N2O↑+2H2O
C、2NaHCO3Na2CO3+CO2↑+H2O D、Cu2(OH)2CO32CuO+CO2↑+H2O
4、有关氧化还原反应的下列叙述正确的是 ( )
A 氧化剂发生还原反应,还原剂发生氧化反应
B 氧化剂被氧化,还原剂被还原
C 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D 氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
课后练习与提高
1、下列反应中不属于氧化还原反应的是( )
A、Cl2+Na2SO3+H2O=Na2SO4+2HCl B、2HgO2Hg+O2↑
C、2NaCl+H2SO4Na2SO4+2HCl↑ D、Mg+2HCl=MgCl2+H2↑
2、某元素在化学反应中由化合态变为游离态(单质),则该元素( )
A、一定被氧化 B、一定被还原
C、可能被氧化 D、可能被还原
3、下列反应中,不是氧化还原反应的是 ( )
①H2+Cl22HCl ②Na2CO3+2HCl==2NaCl+H2O+CO2↑ ③2H2O2H2↑+O2↑
④CuO+2HNO3==Cu(NO3)2+H2O ⑤2HgO2Hg+O2↑
A. ②④ B. ①③ C. ①②③ D. ④⑤
4、下列反应中氯元素全部被氧化的是( ),全部被还原的是( ),部分被氧化的是( ),部分被还原的是( )。
A、4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
B. 2NaCl(熔融)2Na+Cl2↑
C、
D、Cl2+H2O=HCl+HclO
5、下列反应中不属于氧化还原反应的是( )
A、Cl2+Na2SO3+H2O=Na2SO4+2HCl B、2HgO2Hg+O2↑
C、2NaCl+H2SO4Na2SO4+2HCl↑ D、Mg+2HCl=MgCl2+H2↑
6、在反应中,元素x的原子将电子转移给元素Y的原子,则下列说法正确的是( )
A、元素X被氧化 B、元素Y被氧化
C、元素X发生还原反应 D、元素Y发生还原反应
7、下列反应既是氧化反应,又是离子反应的是( )
A、钠在氯气中燃烧
B、锌片放入硫酸铜溶液中
C、二氧化碳通入澄清的石灰水中
D、氯化钠溶液中加入硝酸银溶液
8、下列反应中,一种物质既被氧化又被还原的是( )
A、2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
B、CaCO3CaO+CO2↑
C、Na2CO3+2HCl===2NaCl+CO2↑+ H2O
D、3NO2+ H2O===2HNO3+NO
课内探究学案答案:
(1)
反应
得氧和失氧
化合价变化
氧化还原反应
2CuO+C2Cu+CO2↑
C得氧
CuO失氧
碳元素化合价升高
铜元素化合价降低
C发生氧化反应
CuO发生还原反应
H2O+C H2 +CO
__C__得氧
_H2O_失氧
_ C ___元素化合价升高
__H__元素化合价降低
_ C ___发生氧化反应
__ H __发生还原反应
CuO +H2Cu +H2O
__H__得氧
___CuO失氧
__氢__元素化合价升高
___铜_元素化合价降低
___氢元素_发生氧化反应
___铜元素_发生还原反应
氧化反应、还原反应
(2)
化学反应
2Na +Cl22NaCl
H2 +Cl22HCl
化合价的变化
钠元素由_0___价升高到___+1_价
氯元素由__0__价降低到___-1_价
氢元素由__0__价升高到_+1___价
氯元素由__0__价降低到__-1__价
电子转移
钠原子的最外层为__1_个电子,氯原子最外层为___7_个电子,在反应过程中,钠原子_失去___1个电子形成钠离子,氯原子_得到___1个电子形成氯离子,两种离子都达到稳定的结构
氢原子的最外层为__1__个电子,氯原子最外层为_7__个电子,在反应过程中,双方各以最外层的1个电子组成共用电子对,达到稳定结构。但共用电子对___偏向_氯原子,_偏离___氢原子
化合价变化与电子转移关系
化合价降低,得到电子
0
+1
0
-1
Na + Cl2 = 2NaCl
化合价升高,失去电子
化合价降低,电子对偏向
0
+1
0
-1
H2 + Cl2 = 2HCl
化合价升高,电子对偏离
(3)
得氧失氧观点
化合价升降观点
电子转移观点
氧化反应
得到氧的反应
化合价升高的反应
失去电子的反应
还原反应
失去氧的反应
化合价降低的反应
得到电子的反应
氧化还原的关系
得氧失氧同时发生
化合价升降同时发生(且升降总数相等)
得失电子同时发生(且得失电子总数相等)
氧化还原反应
有氧得失的反应
有化合价升降的反应
有电子转移的反应
当堂检测:
1、B 2、C 3、CD 4、A
课后练习与提高:
1、C 2、CD 3、A 4、B、C、D、D 5、C 6、AD 7、B
8、AD
氧化还原反应 学案(2)
课前预习学案
一、预习目标
1、进一步认识有关氧化还原反应的概念,理解氧化还原反应的概念和本质
2.了解氧化还原反应与四大反应类型的关系。
3、了解氧化剂与还原剂的强弱比较。
二、预习内容
1、(1)置换反应一定____氧化还原反应
(2)复分解反应一定____氧化还原反应
(3)化合反应和分解反应与氧化还原反应的关系_____________________________________
2、(1)根据反应方程式判断
氧化性:_________>_________
还原性:_________>_________
三、提出疑惑
同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中
疑惑点
疑惑内容
课内探究学案
一、学习目标:
1.进一步理解氧化还原反应的概念和本质
2.掌握氧化还原反应与四大反应类型的关系。
3.氧化剂与还原剂的强弱比较。
学习重难点:
氧化剂与还原剂的强弱比较。
二、学习过程
1、四种基本反应类型与氧化还原反应的关系
初中化学学习的四种基本反应类型是根据反应物和生成物的类别以及反应前后物质种类的多少来划分的。这四类反应的特点可以表示如下:
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应(A+BC=AC+B)
复分解反应(AB+CD=AD+CB)
氧化还原反应是看反应前后的元素有没有化合价的变化,也就是说,氧化还原反应的分类标准与初中化学中学习的四种基本反应类型之间的关系可以归纳如下:
(1)置换反应:置换反应的生成物与反应物中有不同的单质,同种元素由单质变为化合物(或由化合物变为单质)时,一定会有化合价的变化,所以一定____氧化还原反应。
(2)复分解反应:复分解反应是阴阳离子间的相互交换,在反应中离子所带的电荷不变,即一定没有化合价的变化,所以一定____氧化还原反应。
(3)化合反应;化合反应可能属于氧化还原反应,也可能不属于氧化还原反应。例如:
2Cu+O22CuO(_________反应 )
CO2+H2O== H 2C O3(________反应 )
(4)分解反应:分解反应可能属于氧化还原反应,也可能不属于氧化还原反应。例如:
KMnO4K2MnO4+MnO2+O2↑(________反应 )
Cu(OH)2CuO+H2O(________反应 )
四种基本反应类型与氧化还原的关系还可以用数学上的“集合”思想来理解与记忆(如图)。
2、物质的氧化性、还原性强弱比较
(1)根据反应方程式判断
氧化性:_________>_________
还原性:_________>_________
(2)根据元素化合价(价态规律)
元素处于最高价,只有________;元素处于最低价,只有________;元素处于中间价态,既有________又有________。物质若含有多种元素,其性质是这些元素性质的综合体现。如 HCl,既有氧化性(由____元素表现出的性质),又有还原性(由____元素表现出的性质)。
(3)根据金属活动性顺序判断
4、氧化还原反应的基本规律及应用(要求较简单)
(1)守恒律:化合价有升必有降,电子有得必有失。对于一个氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
三、当堂检测:
1、下列叙述正确的是( )
A、置换反应一定是氧化还原反应
B、化合反应一定是氧化还原反应
C、中和反应一定是氧化还原反应
D、复分解反应一定是氧化还原反应
2、从硫元素的化合态上判断,下列物质中的硫元素不能表现氧化性的是( )
A、Na2S B、S C、SO2 D、H2SO4
3、根据下面三个化学方程式:
I2+SO2+2H2O=H2SO4+2HI
2FeCl2+Cl2 = 2FeCl3
2FeCl3+2HI= 2FeCl2+2HCl+I2
有关物质的还原性强弱的顺序是( )
A、I->Fe2+>Cl->SO2 B、Cl->Fe2+>SO2>I- C、Fe2+>I->Cl->SO2 D、SO2> I->Fe2+>Cl-
4、在 K2Cr2O7 + 14HCl= 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂,氧化产物是 ;
(2)此反应若转移了12mol的电子,则生成氯气 L(标准状况)。
课后练习与提高
1、已知可以发生下列化学反应:
(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br-
由上述反应可以推断氧化剂的氧化性强弱顺序为( )
A、Br2>Fe3+>I2 B、Fe3+>Br2>I2 C、I2>Br2>Fe3+ D.Br2>I2>Fe3+
2、下列叙述正确的是 ( )
A 元素的单质可由氧化或还原含该元素的化合物来制得
B 得电子越多的氧化剂,其氧化性就越强
C 阳离子只能得到电子被还原,只能作氧化剂
D 含有最高价元素的化合物不一定具有强的氧化性
3、已知在某温度时发生如下三个反应:
⑴ C+CO2=2CO ⑵ C+H2O=CO+H2 ⑶ CO+H2O=CO2+H2 由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是 ( )
A C>CO>H2 B CO>C>H2 C C>H2>CO D CO>H2>C
4、下列粒子不具有氧化性的是( )
A、Fe B、Cl2 C、H+ D、O2
5、单质X和Y相互反应生成化合物XY(其中X为+2价,Y为-2价)。下列叙述中,正确的是( )
①X被氧化;②X是氧化剂;③X具有氧化性;④XY既是氧化产物也是还原产物;⑤XY中的Y2-具有还原性;⑥XY中X2+具有氧化性;⑦Y的氧化性比XY中的X2+的氧化性强
A、①④⑤⑥⑦ B、①③④⑤ C、②④⑤ D、①②⑤⑥⑦
6、在MnO2 + 4HCl(浓)△ MnCl2 + Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系是:
A、两者质量相等 B、后者是前者的3倍
C、前者是后者的1/2 D、前者是后者的1/4
7、已知反应:①2A-+C2==2C-+A2 ②2C-+B2==2B-+C2 ③2D-+C2==2C-+D2,判断下列说法正确的是 ( )
A. 氧化性:A2>B2>C2>D2 B. D-不能被B2氧化
C. 氧化能力:B2>C2>D2 D. 还原性:A->B-
8、已知下列分子或离子在酸性条件下都能氧化 KI,自身发生如下变化:
Fe3+→Fe2+ ;Cl2 →Cl- ; MnO4-→Mn 2 + ;HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到 I2 最多的是( )
A. Fe3+ B. Cl2 C.MnO4- D.HNO2
9、R、X、Y和Z是四种元素,它们常见化合价均为+2,且X2+与单质R不反应;X2++Z===X+Z2+;Y+Z2+===Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合( )
A、R2+>X2+>Z2+>Y2+ B、X2+>R2+>X2+>Z2+
C、Y2+>Z2+>R2+>X2+ D、Z2+>X2+>R2+>Y2+
10.请把符合要求的化学反应方程式的编号填入括号内:
(1)既属于分解反应又是氧化还原反应的是( )
(2)属于化合反应,但不是氧化还原反应的是( )
(3)既属于化合反应,又是氧化还原反应的是( )
(4)属于分解反应,但不是氧化还原反应的是( )
(5)不属于四种基本反应类型的氧化还原反应的是( )
A. 2NaHCO3 = Na2CO3+ CO2 + CO2↑ B.2Na+ Cl2 = 2NaCl
C.Zn+CuSO4=ZnSO4+Cu D.
E.CaO+ CO2= CaCO3 F. 4FeS2+11O2 = 2Fe 2O3+8SO2
11、根据反应
(1)2P+5Br2+8H2O=2H3PO4+10HBr
(2)Cl2+2HBr=2HCl+Br2
(3)2KMn04+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
推断氧化性(氧化剂)由强到弱的顺序是 。
还原性(还原剂)由强到弱的顺序是 。
12、在①S2- ②Fe3+ ③Fe2+ ④Mg2+ ⑤、 ⑥Cl- ⑦H+ ⑧SO2 ⑨Fe ⑩HCl粒子中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
1、A 2、A 3、D 4、氯、K2Cr2O7、Cl2
四、课后练习与提高答案:
1、A 2、AD 3、A 4、A 5、A 6、C 7、CD 8、C
9、A 10、D、E、B、A、F
11、KMn04 > Cl2 > Br2 > H3PO4 ;P >HBr> HCl> MnCl2 12、Fe3+、、Mg2+ 、H+ ;S2-、Cl-、、Fe ;Fe2+、S、HCl
高考化学一轮复习教案第2章第8讲 氧化还原反应的配平及计算(含解析): 这是一份高考化学一轮复习教案第2章第8讲 氧化还原反应的配平及计算(含解析),共13页。
2022高考化学一轮复习教案:第2章 第8讲 氧化还原反应的配平及计算: 这是一份2022高考化学一轮复习教案:第2章 第8讲 氧化还原反应的配平及计算,共13页。
2022高考化学一轮复习教案:第2章 第7讲 氧化还原反应的规律及应用: 这是一份2022高考化学一轮复习教案:第2章 第7讲 氧化还原反应的规律及应用,共20页。













