




人教版 (新课标)选修6 实验化学实验3-6 食醋中总酸量的测定试讲课课件ppt
展开1.进一步规范滴定管、容量瓶的使用。练习酸碱滴定的基本操作,了解其应用。2.学习食醋中总酸量测定的原理、方法和操作技术。3.熟悉液体试样中组分含量的测定方法,体验用化学定量分析方法解决实际问题的过程。4.培养学生实事求是的科学态度。
一、酸碱滴定曲线的测绘1.pH计pH计是一种用于测量溶液pH的仪器,也叫酸度计。它由一对电极和一个电位计组成,工作时两个电极插入待测溶液,组成一个原电池,该原电池与一个精密电位计连接,用以测量其电动势。待测溶液所产生的电动势随溶液pH的不同而变化,所测溶液的电动势在电表上直接转换成pH显示出来。
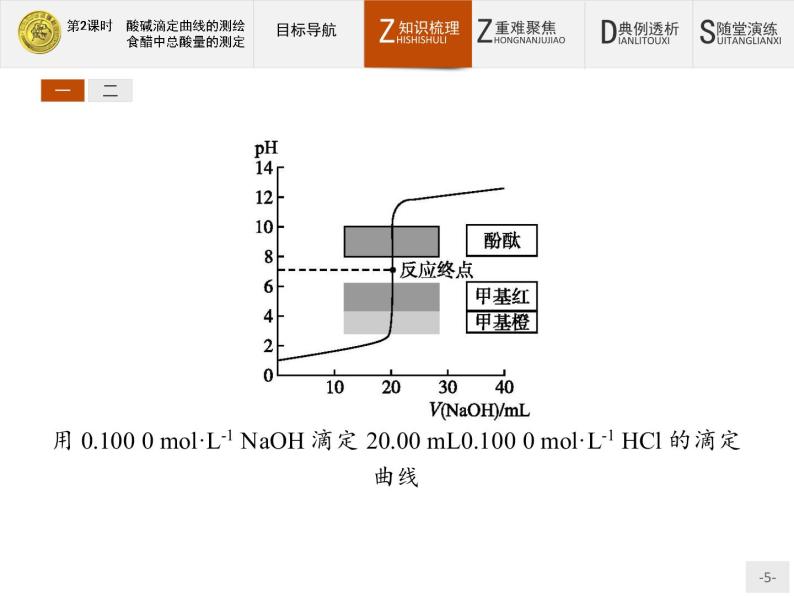
2.滴定曲线酸碱滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液pH为纵坐标,绘出溶液pH随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液pH的变化情况,特别是滴定终点附近溶液pH的突变情况。滴定接近终点时,很少量的碱或酸就会引起溶液pH突变。酸、碱的浓度不同,pH突变范围不同。这对于酸碱滴定中选择合适的酸碱指示剂具有重要意义。选择变色范围与滴定时pH突变范围相吻合的指示剂即可,这样不会造成较大误差(在允许范围内)。
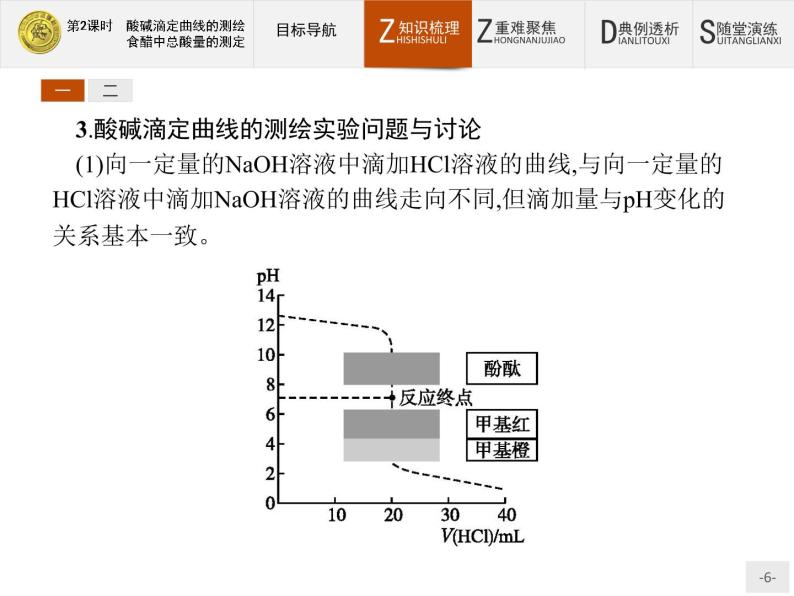
3.酸碱滴定曲线的测绘实验问题与讨论(1)向一定量的NaOH溶液中滴加HCl溶液的曲线,与向一定量的HCl溶液中滴加NaOH溶液的曲线走向不同,但滴加量与pH变化的关系基本一致。
(2)pH计数据测量准确,精度高,但操作复杂,受外界温度、酸度影响大。pH试纸操作简单,受外界温度影响小,但数据准确度差,受人为因素影响大。
二、食醋中总酸量的测定实验原理食醋中的主要成分是醋酸(乙酸),同时也含有少量其他弱酸,如乳酸等,均可被强碱准确滴定。滴定时反应的化学方程式是:因此在本实验中用NaOH溶液滴定食用醋,测出的是总酸量,分析结果用含量最多的醋酸表示,通常选用酚酞作指示剂,测定结果的单位为g·L-1。国家标准规定酿造食醋总酸含量不得低于35 g·L-1。
为何选用酚酞作为指示剂,而不能用甲基橙?提示:由于食醋中的乙酸、乳酸等有机酸皆为弱酸,强碱滴定弱酸,滴定的pH突变在碱性范围内。变色范围:甲基橙为3.1~4.4,酚酞为8.2~10.0,因此酚酞变色范围与滴定终点更接近,误差较小,故选酚酞作指示剂。
一、酸碱滴定曲线的测绘实验注意事项1.所使用酸、碱物质的量浓度尽量不要大于0.100 0 ml·L-1,否则将影响pH计的测量准确度。2.滴定过程中要使酸碱及时混合充分,需要随时搅拌。利用玻璃棒搅拌容易损坏pH计电极头上的玻璃球,经常取出电极又影响测量的准确性,所以使用电磁搅拌器可以有效地提高准确度。3.滴定过程中应当随时注意pH的变化,如果出现在变化范围之外的明显变化,应当重新标定pH计。4.使用与计算机相连的pH传感器的连续测定,会得到理想的实验效果。
二、食醋中总酸量的测定实验注意事项1.最好用白醋。若样品为颜色较深的食醋,需用蒸馏水稀释5倍以上,直到溶液颜色变得很浅,无碍于观察酚酞溶液的颜色变化为止。如果经稀释或活性炭脱色后颜色仍较深,则此品牌食醋不适于用酸碱指示剂滴定法测定总酸含量,可使用pH滴定法进行测定。2.为了减小随机误差,应适当增加平行测定次数,通常平行测定三次。3.在一组测定数据中,若某个实验数据与其他数据相差较大,这一数据称为异常值,一般将其舍弃。为了保证测定结果的准确度,应重新滴定一次。4.为消除CO2对实验的影响(因为碳酸会消耗一定量NaOH溶液),所使用的配制NaOH溶液和稀释食醋的蒸馏水应加热煮沸2~3 min,以尽可能除去溶解的CO2。
三、酸碱中和滴定的误差分析以一元酸和一元碱的中和滴定为例:因c标、V待分别代表标准液浓度、所取待测液体积,均为定值,故可代入上式计算。但是实际中,c标、V待都可能引起误差,一般可把各因素引起的误差转移到V标上。若V标偏大,则测定结果偏大;若V标偏小,则测定结果偏小,故通过分析V标的变化情况,可分析滴定的误差。
引起误差的可能因素有以下几种:
1.视(读数)误读及结果(读取消耗的标准液体积):若起始平视,终点仰视,则V标偏大,c待偏大。若起始平视,终点俯视,则V标偏小,c待偏小。若先仰视后俯视,则V标偏小,c待偏小。若先俯视后仰视,则V标偏大,c待偏大。注意:滴定管中液体读数时精确到0.01 mL。一般需滴定2~3次,取其平均值。
2.洗(仪器洗涤)滴定管需要用待测液润洗,锥形瓶不能润洗。错误洗法导致结果:(1)滴定管仅用水洗,使标准液变稀,故消耗标准液的体积变大,V标变大,结果偏大。(2)移液管仅用水洗,则待测液变稀,所取待测液溶质的物质的量变少,V标变小,结果偏小。(3)锥形瓶用待测液洗过,则瓶内待测液溶质的量偏多,V标偏大,结果偏大。(4)第一次滴定完后,锥形瓶内液体倒去后,尚未清洗,接着第二次滴定,滴定结果如何,取决于上次滴定情况如何。
3.漏(液体溅漏)(1)滴定过程中锥形瓶内液体溅出,则结果偏小。(2)终点已到,滴定管下端尖嘴有液滴,则V标偏大,测定结果偏大。4.泡(滴定管尖嘴有气泡)正确操作应在滴定前把尖嘴管中的气泡赶尽,最后也不能出现气泡。如滴定开始有气泡,后气泡消失,则结果偏大;若先无气泡,后有气泡,则结果偏小。5.色(指示剂变色控制与选择)滴定时,眼睛应紧盯着锥形瓶内溶液的颜色变化。指示剂变色后应半分钟内不复原。如变色后立即复原,则结果偏小。另外,同一种滴定,选择的指示剂不同,测定结果不同。
6.杂(标准物含杂质)用于配制标准液的固体应该是纯净物。但其中有可能混有杂质,称量时又按所需标准物固体质量来称取,故一般均会产生误差,在此杂质又分两种情况:(1)杂质与待测液不反应。如NaOH中含NaCl,所配的NaOH溶液浓度变小,滴定盐酸时,NaCl不参与反应,所需标准液的体积偏大,故测定结果偏大。
(2)若杂质与待测液反应,则应作具体分析。关键:比较与等物质的量的待测物反应消耗的杂质质量和标准物的质量。若消耗杂质的质量较大,则相当于削弱了原标准液的作用能力,故与一定量待测物反应时,消耗标准液的体积变大,测定结果偏大。或者可用等质量的杂质、标准物分别与待测物反应,根据消耗的待测物质量的多少来判断。如杂质作用待测物的质量越多,说明作用能力被增强,故测定结果偏小。
知识点1 酸碱中和滴定曲线绘制及误差分析【例题1】 (1)实验室用标准NaOH溶液来滴定盐酸,测定盐酸浓度,若用酚酞作指示剂,下列操作可能使测定结果偏低的是 。 A.碱式滴定管中装碱液前未用标准液润洗2~3次B.开始实验时,碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失C.盛盐酸的锥形瓶用待测盐酸润洗2~3次D.锥形瓶内溶液的颜色由无色变为浅红色,立即记下滴定管内液面所在刻度E.滴定前平视,滴定终点时俯视滴定管刻度
(2)下图为某浓度的NaOH溶液滴定10.00 mL一定浓度的盐酸的示意图。根据图像分析:①HCl溶液的浓度是 ,NaOH溶液的浓度是 ;②x= 。
(3)现有四瓶溶液,分别是NaCl(0.1 ml·L-1)、HCl(0.1 ml·L-1)、NaOH(0.1 ml·L-1)和酚酞溶液(0.1%),不用其他试剂把它们一一鉴别开来,实验步骤如下:①各取溶液少许,两两混合,根据现象不同分成两组:Ⅰ组是HCl和 ,Ⅱ组是NaOH和 。 ②取Ⅱ组中C、D混合液,不断滴入Ⅰ组中A溶液,若无明显现象,则A是 ,B是 。 ③取已鉴别出的B溶液2 mL,滴入3滴C溶液,再加入D溶液4 mL,在整个过程中无明显变化,则C是 ,D是 。
解析:(1) 其中γ标、γ待分别为标准酸或碱的元数、待测酸或碱的元数。决定c待大小的因素在于V标的误差,A中未用标准碱液润洗,使V标增大,c待偏高;B中由于气泡的存在使V标增大;C中由于锥形瓶用待测液润洗,使V标增大;D中颜色变红,立即停止,由于混合不均匀,V标过小;E中俯视终点刻度,使V标减小,故D、E符合。(2)由图可知,未滴定时,pH=1,说明盐酸中H+浓度为0.100 0 ml·L-1,即盐酸浓度为0.100 0 ml·L-1,而加入20.00 mL NaOH溶液可以中和10.00 mL 0.100 0 ml·L-1盐酸,说明NaOH溶液浓度为0.050 00 ml·L-1,n(NaOH)=0.050 00 ml·L-1×0.02 L=0.001 ml。
(3)两两相互混合后,酚酞遇NaOH变红为Ⅱ组,Ⅰ组为NaCl和HCl。Ⅱ组中混合液若加入Ⅰ组中HCl,则红色消失,而加入Ⅰ组中的A无明显现象,说明A是NaCl,B是HCl。如果B(HCl)加入C(若为酚酞)无明显现象,再加入D(若为NaOH)则出现红色,而题目中一直无明显变化,则C为NaOH,D为酚酞。答案:(1)DE(2)①0.100 0 ml·L-1 0.050 00 ml·L-1②0.001(3)①NaCl 酚酞②NaCl HCl③NaOH 酚酞
点拨滴定过程中任何错误操作都可能导致c标、V标、V待的误差,但在实际操作中认为c标是已知的,V待是固定的,所以一切的误差都归结为对V标的影响,V标偏大,则c待偏大,V标偏小,则c待偏小。误差分析的关键是要体会错误操作与正确操作的对比,从而得出c待是偏大、偏小还是不变。
知识点2 食醋中总酸量的测定【例题2】 某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100 mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500 mL、0.100 0 ml·L-1 NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液)Ⅰ.实验步骤:(1)用滴定管量取10.00 mL市售白醋样品,置于100 mL容量瓶中,加蒸馏水(已煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液。(2)用酸式滴定管取待测食醋溶液20.00 mL于 中。 (3)将碱式滴定管用标准NaOH溶液润洗后,再盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。(4)滴定,并记录NaOH溶液的终读数。重复滴定2~3次。
Ⅱ.实验记录及数据处理:则c(样品)= ml·L-1;样品总酸量为 g/100 mL。
解析:Ⅰ.实验步骤:(1)为便于计算,一般将食醋稀释10倍后,制得试样。(2)食醋作为待测液,一般应放在锥形瓶中,用标准液(NaOH溶液)滴定待测液。Ⅱ.实验记录及数据处理:实验中出现的异常值,应舍去。答案:Ⅰ.锥形瓶 Ⅱ 4.50 Ⅲ.(1)不合理,因为第四组数据与前3组相差较大,属异常值,应舍去(2)7.74~9.70 酚酞点拨掌握中和滴定实验,要抓住两个关键:一是解决实验中的有关问题,如仪器的使用,操作(滴定前的准备,有关仪器的检漏、洗涤、润洗,指示剂的选择等),误差分析等,通过动手实验,增强学习的实效性。二是理解中和滴定的实验原理,解决好有关计算的问题。
1 2 3 4
1某研究小组为测定食用白醋中醋酸的含量进行了如下操作,其中正确的是( )A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中B.称取4.0 g NaOH加入到1 000 mL容量瓶中,加水至刻度,配成1.00 ml·L-1 NaOH标准溶液C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
解析:本题考查一定物质的量浓度溶液的配制及酸碱中和滴定实验。A项,应用酸式滴定管量取;B项,称取4.0 g NaOH后要在烧杯中溶解,冷却至室温后转移到1 000 mL容量瓶加水至刻度,配制成标准溶液,NaOH的物质的量浓度为0.100 0 ml·L-1;D项,滴定过程中眼睛应注视锥形瓶中溶液颜色的变化。答案:C
2将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
解析:A选项,氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确。B选项,醋酸中滴加氢氧化钠溶液,酸性减弱,pH增大,B正确。C选项,醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项,醋酸中滴加氢氧化钠,即使醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误。答案:D
3下列几种情况,(其他操作均正确)对中和滴定结果无影响的是( )A.滴定前标准液在“0”刻度以上B.盛未知浓度溶液的锥形瓶里有少量蒸馏水C.滴定管用蒸馏水冲洗后即注入标准液D.滴定终点读数时,俯视滴定管的刻度
解析:A项由于滴定前标准液在“0”刻度以上,滴定中用去“0”刻度以上的那部分标准液的体积不在滴定后读出的V标内,也就是实际用去的标准溶液的体积比V标要大,所以这样操作使待测溶液浓度偏小。B项盛装待测液的锥形瓶内若有水,虽然使锥形瓶内的溶液浓度变稀,但待测溶液中溶质的物质的量没有变化,因而对测定结果无影响。C项滴定管用蒸馏水冲洗后,未用标准溶液润洗,使滴定管内的标准溶液变稀,V标变大,导致待测溶液浓度偏大。D项滴定管滴定前读数正确,滴定后,读数时视线俯视,使V标读数变小,结果使待测溶液浓度偏小。答案:B
4(1)邻苯二甲酸氢钾(相对分子质量为204.2)可以用于标定NaOH溶液的浓度,反应如下:KHC8H4O4+NaOH KNaC8H4O4+H2O准确称取0.510 5 g KHC8H4O4晶体,溶于水后加入酚酞指示剂,用NaOH溶液滴定至溶液呈淡红色,消耗20.00 mL NaOH。计算NaOH溶液的浓度(结果保留四位有效数字)。(2)测定食醋的总酸度:食醋中除醋酸(CH3COOH)外,还含有少量其他有机酸。食醋的总酸度以每1 000 mL食醋中含醋酸(其他酸也折算为醋酸)的质量(g)表示,通常写作w(CH3COOH)。用移液管移取50.00 mL市售食醋,置于250 mL容量瓶中,用水稀释至刻度。再从中量取25.00 mL,用(1)小题已知浓度的NaOH溶液滴定,消耗碱液的体积为V(mL),请写出w(CH3COOH)的计算式。
解析:第(1)小题要求由质量、摩尔质量以及体积、浓度分别求出酸和碱的物质的量,再根据中和反应中酸、碱物质的量关系式求得碱的浓度。第(2)小题在上题求得c(NaOH)的基础上,同样利用酸碱中和反应求得食醋稀释后CH3COOH的物质的量,经换算后求得w(CH3COOH)的表示式。与(1)题相比要经过换算以及正确理解w(CH3COOH)的含义,难度略有上升。(2)对中和滴定知识及其应用的拓展延伸考查,是高考“变中求新”的具体体现,也是考查学科能力和学科内综合的重要方式,该题就是以中和滴定知识为依托的递进关联型考题。
高中化学人教版 (2019)选择性必修3第二节 醇酚优质课件ppt: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002469_t3/?tag_id=26" target="_blank">第二节 醇酚优质课件ppt</a>,共25页。PPT课件主要包含了一苯酚的分子结构,二苯酚的物理性质,苯酚的化学性质,+H+,苯酚的氧化反应,+3Br2,+3HBr,+3HNO3,+3H2O,浓硫酸等内容,欢迎下载使用。
化学第二单元 溶液的酸碱性教学演示课件ppt: 这是一份化学第二单元 溶液的酸碱性教学演示课件ppt,共12页。PPT课件主要包含了学习目标,交流讨论,归纳小结,课堂探究,课堂练习等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解获奖ppt课件: 这是一份鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解获奖ppt课件,文件包含新教材精创322盐类水解的原理PPT鲁科版选择性必修1共23张PPTpptx、新教材精创322盐类水解的原理学案鲁科版选择性必修1docx、新教材精创322盐类水解的原理教学设计鲁科版选择性必修1docx、新教材精创322盐类水解的原理练习原卷版鲁科版选择性必修1docx、新教材精创322盐类水解的原理练习解析版鲁科版选择性必修1docx等5份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













