






化学选修6 实验化学第二单元 物质的获取实验2-5 乙酸乙酯的制备及反应条件探究优秀ppt课件
展开1.制取乙酸乙酯,初步体验有机物的制取过程和特点。2.探究浓硫酸在生成乙酸乙酯反应中的作用。3.体验通过实验的方法获取知识的过程。
一、乙酸乙酯的制备1.实验原理乙酸和乙醇在催化剂存在的条件下加热可以发生酯化反应生成乙酸乙酯。化学方程式为CH3COOH+CH3CH2OHCH3 COOCH2CH3+H2O,该反应是可逆反应,H+可以作酯化反应的催化剂。
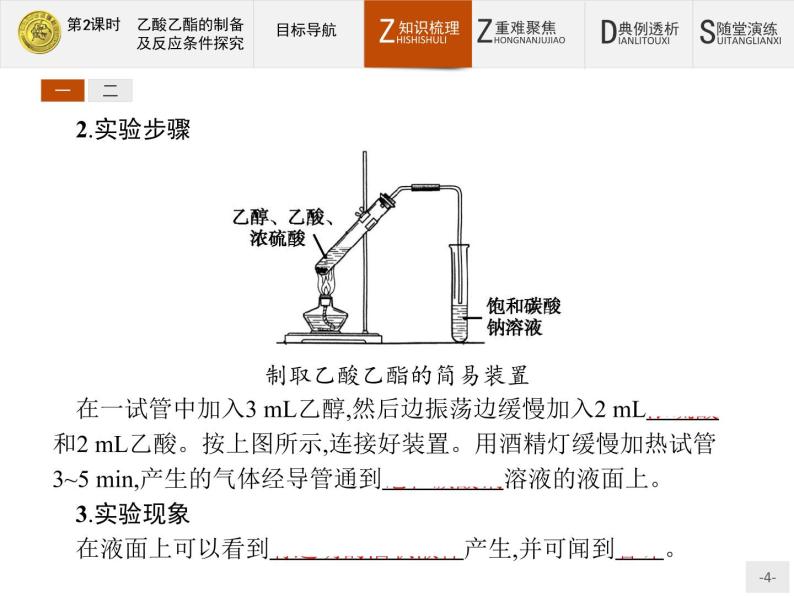
2.实验步骤制取乙酸乙酯的简易装置在一试管中加入3 mL乙醇,然后边振荡边缓慢加入2 mL浓硫酸和2 mL乙酸。按上图所示,连接好装置。用酒精灯缓慢加热试管3~5 min,产生的气体经导管通到饱和碳酸钠溶液的液面上。3.实验现象在液面上可以看到有透明的油状液体产生,并可闻到香味。
4.浓硫酸在生成乙酸乙酯反应中的作用探究在酯化实验中,三种不同条件下酯化反应进行的快慢不同:没有酸催化时,几乎没有乙酸乙酯生成;浓硫酸催化时生成的乙酸乙酯的量最多,形成相同厚度的有机层时间最短;稀硫酸或稀盐酸催化时,生成少量的乙酸乙酯,形成相同厚度的有机层时间较长,说明浓硫酸在该反应中起了催化剂、吸水剂的作用,而稀硫酸、稀盐酸等无机酸仅起了催化剂的作用,没有促进化学平衡向酯化反应方向移动。探究浓硫酸在该反应中作用时应注意哪些问题?提示:每次实验乙酸和乙醇取用的体积要相同,加热的时间也要相同,这样更有可比性。反应结束后用直尺测有机层厚度,然后将饱和碳酸钠溶液和蒸出产物倒入分液漏斗内分液,回收有机层。
二、乙酸乙酯制备反应的特征1.该反应为可逆反应物质的量相等的乙酸和乙醇,不能全部转化为乙酸乙酯,因为乙酸和乙醇的酯化反应是可逆反应,当反应达到平衡后,各组分的浓度保持不变,不改变影响化学平衡的条件,乙酸乙酯的含量不会增加。2.提高乙酸转化率的方法欲提高生成乙酸乙酯反应的限度,提高乙酸的转化率,可以采取的措施有:增加乙醇的用量,使化学平衡向正反应方向移动,可以提高乙酸的利用率;增加浓硫酸的用量,利用浓硫酸吸水使化学平衡向正反应方向移动;加热将生成的乙酸乙酯及时蒸出,通过减少生成物的浓度使化学平衡向正反应方向移动。
3.乙酸乙酯水解的最佳条件由于酯化反应为可逆反应,而稀硫酸、稀盐酸等无机酸催化酯化反应的效果较浓硫酸差,因此探索乙酸乙酯发生水解反应时,不利于酯化反应的稀无机酸催化剂有利于酯的水解。因此,乙酸乙酯的水解用稀无机酸的催化效果比用浓硫酸的效果好;同时由于乙酸乙酯水解生成了乙酸,其反应的化学方程式为CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH,如果用无机碱催化乙酸乙酯的水解,会使碱与生成的酸反应,降低生成物乙酸的浓度,从而使化学平衡更容易向水解的方向移动,所以,乙酸乙酯水解的适宜条件为无机酸或无机碱催化,最佳条件是用无机碱催化乙酸乙酯水解。
乙酸乙酯制备实验的注意事项1.反应物混合加入试剂顺序为乙醇、浓硫酸、乙酸。由于反应物中有浓硫酸,所以加入3 mL乙醇后要边振荡试管边缓慢加入2 mL 浓硫酸和2 mL乙酸,防止浓硫酸与乙醇、乙酸混合时放出大量热量,造成液体飞溅。浓硫酸不宜最后滴加,以免在滴加浓硫酸的过程中乙酸与乙醇过早发生反应。
2.蒸馏操作本实验中制取乙酸乙酯的装置是一种边反应、边蒸馏的简易装置,加热应缓慢,反应温度不宜过高,温度过高时会产生乙醚和亚硫酸等杂质,而且会使过多乙醇、乙酸未经反应就脱离反应体系,降低乙酸乙酯的产率。也防止高温使有机物炭化或其他副反应发生。
3.饱和碳酸钠溶液的作用及导气管口位置中和挥发出来的乙酸,生成醋酸钠(便于闻乙酸乙酯的香味);溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,利于分层。导出乙酸乙酯的导气管不要伸到饱和Na2CO3溶液中,应在饱和Na2CO3溶液上方一点。防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。4.实验装置改进试管斜向上倾斜45°使试管受热面积增大,弯导管起到导气兼冷凝的作用。导气管选用长一点的好,这样可以更好地冷凝生成物,减少乙酸乙酯的损失。为了减少乙酸乙酯的损失,也可以做如下图所示的改进:在球形干燥管下端连接一短玻璃管,将其插入饱和碳酸钠溶液液面下2~3 cm处,这样既可增加冷凝效果,又可洗涤乙酸乙酯,除去乙酸、乙醇等杂质,同时又能防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
5.实验中采取的加快反应的措施(1)加热可加快反应,同时可及时分离出产物。(2)乙酸、乙醇都是无水的。(3)使用催化剂,加快反应。
知识点1 乙酸乙酯的制取【例题1】 已知下列数据:
某学生在实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min。③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:(1)配制该混合溶液的主要操作步骤为 ;写出制取乙酸乙酯的化学方程式: 。 (2)上述实验中饱和碳酸钠溶液的作用是 (填字母)。 A.中和乙酸和乙醇B.中和乙酸并吸收部分乙醇C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出D.加速酯的生成,提高其产率(3)步骤②中需要小火均匀加热操作,其主要理由是 。
(4)指出步骤③所观察到的现象: ;分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤除去 (填名称)等杂质;为了干燥乙酸乙酯可选用的干燥剂为 (填字母)。 A.P2O5B.无水Na2SO4C.碱石灰D.NaOH固体(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有: 。
解析:(1)浓硫酸与水、乙醇等液体混合时都会放出大量的热,为防止混合时液体飞溅,操作方法与浓硫酸的稀释类似。
(2)饱和碳酸钠溶液与乙醇不反应,故“中和乙酸和乙醇”说法错误;而“加速酯的生成,提高其产率”是加热的作用,不是饱和碳酸钠溶液的作用。(3)步骤②中需要小火均匀加热操作,因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,且温度过高可能发生其他副反应。(4)从饱和碳酸钠溶液中分离出乙酸乙酯层后,用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤除去其中的碳酸钠:Na2CO3+CaCl2 CaCO3↓+2NaCl,由于乙醇既易溶于有机溶剂乙酸乙酯中,也易溶于水中,所以饱和碳酸钠溶液并未将乙酸乙酯中的乙醇除净,用饱和食盐水或饱和氯化钙溶液洗涤,还能除去其中的乙醇;最后乙酸乙酯的干燥应该选用中性的无水Na2SO4,为防止其水解,酸性干燥剂P2O5和碱性干燥剂碱石灰、NaOH固体不宜选用。(5)从装置2比装置1多出的温度计、分液漏斗和冷凝管考虑作答。
答案:(1)在一个30 mL大试管中注入4 mL乙醇,再边振荡边缓缓加入1 mL浓硫酸和4 mL乙酸(2)BC(3)因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,且温度过高可能发生其他副反应(4)在浅红色碳酸钠溶液层上方有无色液体生成,并闻到香味,振荡后碳酸钠溶液层红色变浅 碳酸钠、乙醇 B(5)a.增加了温度计,有利于控制发生装置中反应液温度;b.增加了分液漏斗,有利于及时补充反应混合液以提高乙酸乙酯产量;c.增加了冷凝装置,有利于收集产物
点拨实验室制取乙酸乙酯是最重要的有机实验之一。本题考查了制备乙酸乙酯的原理、操作、产品的净化和对新装置的评价等内容。本题的亮点是第(5)题,以实验室制取乙酸乙酯为背景,组合了多个实验的实验装置优点于一身。
知识点2 其他类似有机物的制取【例题2】 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完。装置d的作用是 。 (2)液溴滴完后,经过下列步骤分离提纯:①向a中加入10 mL水,然后过滤除去未反应的铁屑;②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。 (3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必需的是 (填入正确选项前的字母)。 A.重结晶B.过滤C.蒸馏D.萃取(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。 A.25 mLB.50 mLC.250 mLD.500 mL
解析:因为Cl、Br属于同一主族,所以此题应联系氯及其化合物的性质,再结合反应 进行分析:(1)由HCl遇空气有白雾出现,可知HBr遇空气也有白雾出现;(2)溴苯中含有Br2、HBr、苯等杂质,所以加入氢氧化钠溶液的作用是把Br2、HBr变成易溶于水而不易溶于有机物的盐,再经水洗可除去;溴苯与苯均属于有机物且互溶的液体,用蒸馏方法分离;(4)烧瓶作反应器时,加入液体体积不能超过其容积的 ,所以选择B较合适。答案:(1)HBr 吸收HBr和Br2(2)除去HBr和未反应的Br2 干燥(3)苯 C(4)B
1 2 3 4
1下列操作中错误的是( )A.除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯B.混有乙酸的乙酸乙酯用饱和碳酸钠溶液进行除杂C.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶D.提取溶解在水中的少量碘:加入CCl4,振荡、静置、分层,放出有机层再蒸馏解析:A错误:①酯化反应是可逆反应,不可能进行完全;②引入了新的杂质乙醇和硫酸。正确的做法是加入饱和碳酸钠溶液,振荡,静置分层,分液。答案:A
2利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
解析:A项,制乙酸乙酯时,导管末端不应插入液面以下,否则容易发生倒吸;B项,制备氢氧化亚铁时,滴管应插入液面以下,否则生成的氢氧化亚铁容易被氧化为氢氧化铁;C项,石油的蒸馏装置中温度计的水银球应位于蒸馏烧瓶的支管口处;D项为实验室制乙烯装置,正确。答案:D
3取实验室制乙酸乙酯所得到的乙酸乙酯与饱和Na2CO3溶液的混合物适量,沿试管壁慢慢加入紫色石蕊溶液0.5 mL,这时石蕊溶液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象,叙述正确的是( )A.石蕊层仍为紫色,有机层无色B.石蕊层为三层环,由上而下是红、紫、蓝C.石蕊层有两层,上层为紫色,下层为蓝色D.石蕊层为三层环,由上而下是蓝、紫、红解析:乙酸乙酯与水互不相溶,且密度比水的小,当加入紫色石蕊溶液时,乙酸乙酯在上层,石蕊溶液在下层,由于不振荡,所以石蕊与饱和Na2CO3溶液仅接触未混匀,由于Na2CO3水解使溶液呈碱性,故接触面下的颜色为蓝色。而上层的乙酸乙酯中含乙酸杂质,使接触面上的石蕊溶液显红色。而中间的石蕊溶液仍显紫色。答案:B
4如图在试管甲中先加入2 mL 95%的乙醇,并在摇动下缓慢加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸钠(CH3COONa)。将试管甲固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按图连接好装置进行实验,当试管乙中有明显现象时停止实验。
试回答:(1)实验时,应对试管甲缓慢加热,其目的是 。 (2)写出试管甲中发生反应的化学方程式: 。 (3)加入浓硫酸的作用是 、 、 。 (4)该实验中球形管丙的作用是 。 (5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因: 。
解析:本题是实验室制取乙酸乙酯的实验,实验中的乙酸是由乙酸钠和硫酸反应产生的;实验中使用了球形管来防止倒吸,若不使用球形管只用导管,导管末端不能插入饱和碳酸钠溶液中。
高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002464_t3/?tag_id=26" target="_blank">第二节 烯烃 炔烃获奖ppt课件</a>,共17页。PPT课件主要包含了13-丁烯烃,①12加成,②14加成,与不饱和键的加成,①与碳碳双键加成,②与碳碳三键加成,解析如图,已知下列反应,一定条件,如果要合成等内容,欢迎下载使用。
选择性必修1第二单元 化学反应的方向与限度集体备课ppt课件: 这是一份选择性必修1第二单元 化学反应的方向与限度集体备课ppt课件,共13页。PPT课件主要包含了学习目标,交流讨论,课堂探究,ADE,ABDE,ABDF,ABC,ABE,ABCDE等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度课前预习ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度课前预习ppt课件,共13页。PPT课件主要包含了学习目标,复习回顾,常见的可逆反应有,交流讨论,可逆反应有哪些特征,化学平衡状态的特征,课堂练习等内容,欢迎下载使用。













