

【化学】山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试
展开山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试
第Ⅰ卷 选择题(共48分)
一、单项选择题(本题包括16个小题,每小题3分,共48分)
1. 下列依据热化学方程式得出的结论正确的是( )
A.已知2C(s)+2O2(g)===2CO2(g) ΔH=a kJ·mol-1, 2C(s)+O2(g)===2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含1 mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3 kJ
C.已知P(白磷,s)===P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g) + I2(g)2HI(g) ΔH=-a kJ·mol-1向密闭容器中加入2 mol H2和2 mol I2(g),充分反应后放出的热量小于2a kJ
2.如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为
MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
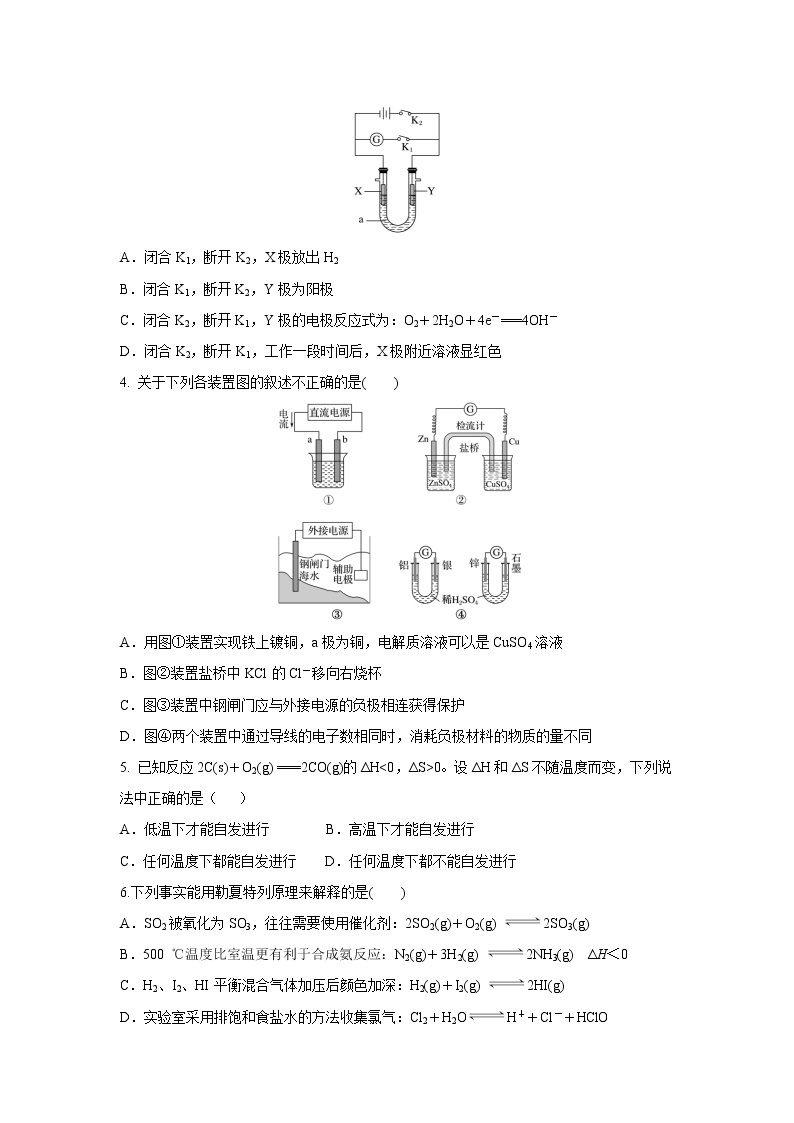
3.如图所示装置中,X是铁,Y是石墨,a是硫酸钠溶液。实验开始前,在U形管的两边同时各滴入几滴酚酞溶液,下列叙述正确的是( )
A.闭合K1,断开K2,X极放出H2
B.闭合K1,断开K2,Y极为阳极
C.闭合K2,断开K1,Y极的电极反应式为:O2+2H2O+4e-===4OH-
D.闭合K2,断开K1,工作一段时间后,X极附近溶液显红色
4. 关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
5. 已知反应2C(s)+O2(g) ===2CO(g)的ΔH<0,ΔS>0。设ΔH和ΔS不随温度而变,下列说法中正确的是( )
A.低温下才能自发进行 B.高温下才能自发进行
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
6.下列事实能用勒夏特列原理来解释的是( )
A.SO2被氧化为SO3,往往需要使用催化剂:2SO2(g)+O2(g) 2SO3(g)
B.500 ℃温度比室温更有利于合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0
C.H2、I2、HI平衡混合气体加压后颜色加深:H2(g)+I2(g) 2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气:Cl2+H2OH++Cl-+HClO
7. 在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系密度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥ B. ①③④⑥ C. ②③④⑥ D. ①③④⑤
8. 某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K= B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
9. 10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列物质,能减慢反应速率但又不影响氢气生成量的是( )
A. K2SO4固体 B. CH3COONa溶液 C. CuSO4溶液 D. Na2CO3溶液
10. 根据vt图分析外界条件改变对可逆反应A(g)+3B(g) 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是 ( )
A.使用了催化剂、增大压强、减小反应物浓度、降低温度
B.升高温度、减小压强、减小反应物浓度、使用了催化剂
C.增大反应物浓度、使用了催化剂、减小压强、升高温度
D.升高温度、减小压强、增大反应物浓度、使用了催化剂
11. 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总
12. 水的电离平衡曲线如图所示,下列说法正确的是( )
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
13.相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )
A. 相同浓度的两溶液,分别与锌粒(大小和形状均相同)反应,开始时反应速率相同
B. 相同浓度的两溶液,c(CH3COOˉ) < c(Clˉ)
C. 分别中和pH相等、体积相等的两溶液,盐酸所需NaOH的物质的量较多
D. pH=3的两溶液分别加水稀释10倍后,醋酸溶液的pH比盐酸大
14. 常温下,浓度相同的稀溶液:①NH4Cl溶液、②NH4Al(SO4)2溶液、③CH3COONH4溶液、④氨水中,c(NH4+)由大到小的排列顺序为( )
A.①>②>③>④ B.②>①>④>③
C.②>①>③>④ D.④>③>②>①
15.下列有关难溶电解质及其溶度积常数Ksp的说法正确的是( )
A. 常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp 减小
B. Ksp越大,难溶电解质的溶解能力越强
C. 过滤沉淀时,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗的AgCl少
D.工业上去除废水中的重金属离子,只能使用可溶性沉淀剂,如Na2S, (NH4)2 S等
16. 室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是( )
A. 酸性强弱:HX>HY>HZ
B. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C. 各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D. HZ的电离方程式为:HZH++Z-
第Ⅱ卷 选择题(共52分)
二、非选择题(本题包括4小题,共52分)
17. (8分)在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为 (填化学式)
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变 (填“变大”“变小”或“不变”)
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为
18.(14分)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的△H= kJ·mol-1;该反应的平衡常数K= (用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟内v(H2O)= ,CO的转化率α(CO)= 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0 B. P1>P2>P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
19. (20分)水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:
根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力 CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力 CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3HCO,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO)∶c(H2CO3)变化关系如下表:
c(HCO) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序 ___。
④已知25 ℃时, CO水解反应的平衡常数Kh =KW/ Ka2=[HCO][ OH-] / [ CO]
=2×10-4 mol·L-1,当溶液中c(HCO)︰c( CO)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)= mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-) (填“增大”或“减小”或“不变”)。
20.(10分)滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则[Na+]-[CH3COO-]的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差分析:在本实验的滴定过程中,下列操作会使实验结果偏大的是____________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e. 滴定前平视读数,滴定后俯视读数
【参考答案】
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
D | C | D | B | C | D | B | D | B | D |
11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
B | A | B | C | C | B |
|
|
|
|
17.(8分,每空2分)
(1) H2 (2)紫色向D处移动 (3) 变大 (4) O2+4e- +2H2O=4OH-
18.(14分,每空2分)
(1)-246.1 K12·K2·K3 (2)AC (3) 0.003 15 % (4)AB (5)2.0(2-3之间即可)
19. (20分,每空2分)
(1)把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液点在试纸的中部,变色后与标准比色卡对照读数 小于
(2)等于 小于
(3) ①> ②B ③c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+) ④pH=10
(4) 1.8×10-8 不变
20、(10分)
I. (每空1分)(1)1 (2)1% (3)> 9.9×10-7
Ⅱ. (每空2分)(1)溶液由无色恰好变为浅红色,并在半分钟内不褪色
(2)0.075
(3)ab








