化学选修4 化学反应原理第1节 化学反应的热效应教案
展开化学学科课时教学设计
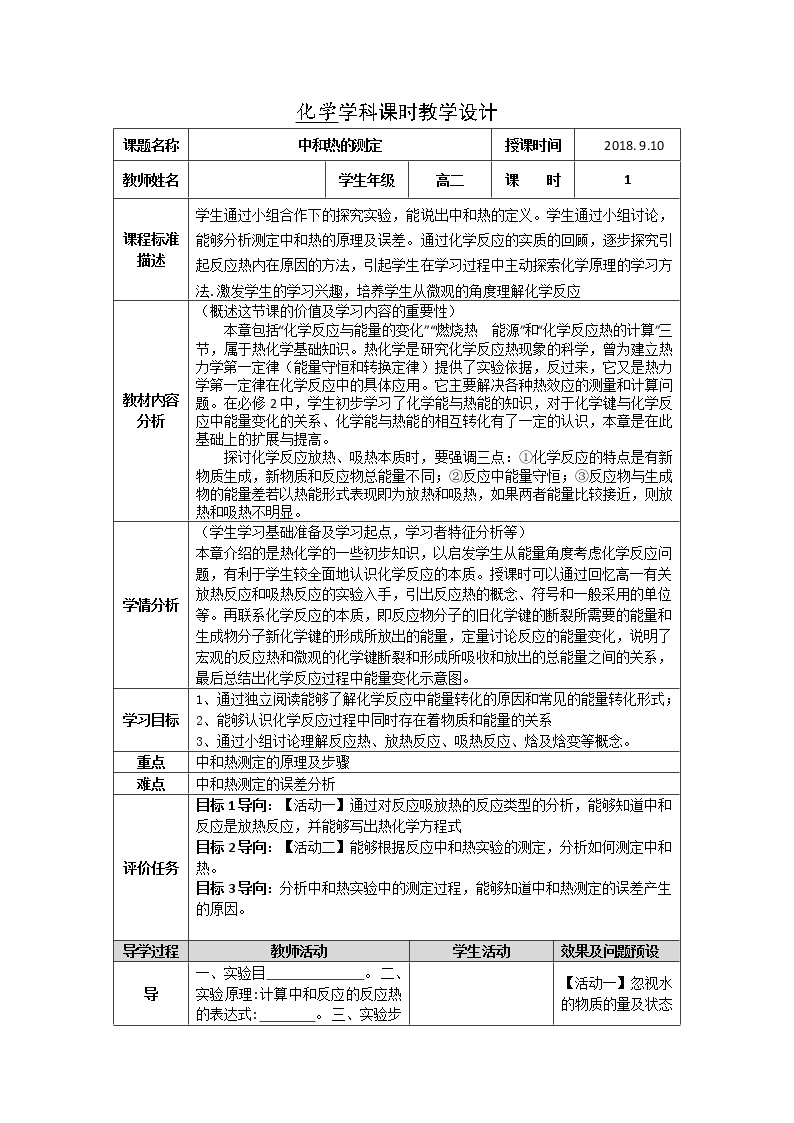
课题名称 | 中和热的测定 | 授课时间 | 2018. 9.10 | |||||||||||||||||||||||||||||||||||||
教师姓名 |
| 学生年级 | 高二 | 课 时 | 1 | |||||||||||||||||||||||||||||||||||
课程标准描述 | 学生通过小组合作下的探究实验,能说出中和热的定义。学生通过小组讨论,能够分析测定中和热的原理及误差。通过化学反应的实质的回顾,逐步探究引起反应热内在原因的方法,引起学生在学习过程中主动探索化学原理的学习方法.激发学生的学习兴趣,培养学生从微观的角度理解化学反应 | |||||||||||||||||||||||||||||||||||||||
教材内容分析 | (概述这节课的价值及学习内容的重要性) 本章包括“化学反应与能量的变化”“燃烧热 能源”和“化学反应热的计算”三节,属于热化学基础知识。热化学是研究化学反应热现象的科学,曾为建立热力学第一定律(能量守恒和转换定律)提供了实验依据,反过来,它又是热力学第一定律在化学反应中的具体应用。它主要解决各种热效应的测量和计算问题。在必修2中,学生初步学习了化学能与热能的知识,对于化学键与化学反应中能量变化的关系、化学能与热能的相互转化有了一定的认识,本章是在此基础上的扩展与提高。 探讨化学反应放热、吸热本质时,要强调三点:①化学反应的特点是有新物质生成,新物质和反应物总能量不同;②反应中能量守恒;③反应物与生成物的能量差若以热能形式表现即为放热和吸热,如果两者能量比较接近,则放热和吸热不明显。 | |||||||||||||||||||||||||||||||||||||||
学情分析 | (学生学习基础准备及学习起点,学习者特征分析等) 本章介绍的是热化学的一些初步知识,以启发学生从能量角度考虑化学反应问题,有利于学生较全面地认识化学反应的本质。授课时可以通过回忆高一有关放热反应和吸热反应的实验入手,引出反应热的概念、符号和一般采用的单位等。再联系化学反应的本质,即反应物分子的旧化学键的断裂所需要的能量和生成物分子新化学键的形成所放出的能量,定量讨论反应的能量变化,说明了宏观的反应热和微观的化学键断裂和形成所吸收和放出的总能量之间的关系,最后总结出化学反应过程中能量变化示意图。 | |||||||||||||||||||||||||||||||||||||||
学习目标 | 1、通过独立阅读能够了解化学反应中能量转化的原因和常见的能量转化形式; 2、能够认识化学反应过程中同时存在着物质和能量的关系 3、通过小组讨论理解反应热、放热反应、吸热反应、焓及焓变等概念。 | |||||||||||||||||||||||||||||||||||||||
重点 | 中和热测定的原理及步骤 | |||||||||||||||||||||||||||||||||||||||
难点 | 中和热测定的误差分析 | |||||||||||||||||||||||||||||||||||||||
评价任务 | 目标1导向:【活动一】通过对反应吸放热的反应类型的分析,能够知道中和反应是放热反应,并能够写出热化学方程式 目标2导向:【活动二】能够根据反应中和热实验的测定,分析如何测定中和热。 目标3导向:分析中和热实验中的测定过程,能够知道中和热测定的误差产生的原因。
| |||||||||||||||||||||||||||||||||||||||
导学过程 | 教师活动 | 学生活动 | 效果及问题预设 | |||||||||||||||||||||||||||||||||||||
导 | 一、实验目 。 二、实验原理:计算中和反应的反应热的表达式: 。 三、实验步骤:1.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两小孔,正好使温度计和环形玻璃搅拌棒通过,如图所示。 |
| 【活动一】忽视水的物质的量及状态 | |||||||||||||||||||||||||||||||||||||
思 | 2.用一个量筒最取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。 3.用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。 4.把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。 | 1.两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失。填碎纸条的作用是为了达到保温、隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
| 【活动一】 | |||||||||||||||||||||||||||||||||||||
议 | 1.大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议? 2.温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么? 3.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入? 4.实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗? | 3.因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。 4.为了保证50 mL 0.50 mol·L-1的盐酸完全被NaOH中和,采用50 mL 0.55 mol·L-1 NaOH溶液,使碱稍稍过量。若使HCl过量,亦可。 | 【活动二】
| |||||||||||||||||||||||||||||||||||||
展 | 5.重复实验步骤2~4三次。
实验数据处理:取三次测量所得数据平均值作为计算依据。
| 2.因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净。冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。
| 【活动二】 | |||||||||||||||||||||||||||||||||||||
评 |
产生误差可能的原因有: 1.量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算,若实际量取时,多于50 mL或小于50 mL都会造成误差)。 2.温度计的读数有误。
| 5.隔热操作不到位,致使实验过程中热量损失。 6.测了酸后的温度计未用水清洗而立即去测碱的温度,致使热量损失。
| 【活动三】 | |||||||||||||||||||||||||||||||||||||
检 | 1.本实验中若把50 mL 0.50 mol·L-1的盐酸改为50 mL 0.50 mol·L-1醋酸(弱酸)溶液,所测结果是否会有所变化?为什么? 2.若改用100 mL 0.50 mol·L-1的盐酸和100 mL 0.55 mol·L-1的NaOH溶液,所测反应热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?
| |||||||||||||||||||||||||||||||||||||||
堂测设计 | 1.下列关于化学反应的说法中不正确的是( ) A.化学反应过程中一定有能量释放出来 B.化学反应的特征是有新物质生成 C.化学反应的过程实际上是一个旧键断裂、新键生成的过程 D.在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等 2.下列图像分别表示反应过程中的能量变化,其中表示化学反应吸收能量的是
3.已知拆开1 mol 中的化学键要吸收436 kJ的能量,拆开1 mol 中的化学键要吸收498 kJ的能量,形成气态水中1 mol H—O键要放出465 kJ的能量。若反应+═O(g)中生成2 mol O(g) 需 (填“放出”或“吸收”)能量 kJ。 | |||||||||||||||||||||||||||||||||||||||
板书设计 | 中和热的测定 一、中和热反应的原理 二、中和热实验的注意事项 | |||||||||||||||||||||||||||||||||||||||
教学反思 |
| |||||||||||||||||||||||||||||||||||||||
检查结果及修改意见:合格[ ] 不合格[ ]
组长(签字): 检查日期: 年 月 日
人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化教案设计: 这是一份人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化教案设计,共4页。教案主要包含了中和热的测定,知识点一 中和热的测定等内容,欢迎下载使用。
高中化学鲁科版选修4 化学反应原理第2章 化学反应的方向、限度与速率第4节 化学反应条件的优化——工业合成氨教案及反思: 这是一份高中化学鲁科版选修4 化学反应原理第2章 化学反应的方向、限度与速率第4节 化学反应条件的优化——工业合成氨教案及反思,共3页。
鲁科版选修4 化学反应原理第3节 化学反应的速率教学设计: 这是一份鲁科版选修4 化学反应原理第3节 化学反应的速率教学设计,共3页。