

高中化学苏教版必修二专题3 有机化合物的获得与应用第一单元 化石燃料与有机化合物第二课时精练
展开第二课时 化学反应的限度
1.新制氯水呈黄绿色的原因是什么?写出氯气与水反应的化学方程式。
提示:氯水中存在Cl2分子而呈黄绿色;Cl2+H2OHCl+HClO。
2.Fe3+具有强氧化性,能将I-氧化成I2,你能写出FeCl3溶液与KI溶液反应的离子方程式吗?
提示:2Fe3++2I-===2Fe2++I2。
3.密闭容器中进行化学反应:N2+3H22NH3,增大该反应速率的措施有哪些?
提示:升高温度、增大压强、使用催化剂均能加快该反应的化学反应速率。
[新知探究]
探究1 2H2+O22H2O和2H2O2H2↑+O2↑是可逆反应吗?
提示:不是,因为可逆反应必须是在同一条件下正、逆反应同时进行。
探究2 新制氯水中存在哪些分子和离子?由此判断氯气与水的反应能不能进行到底?
提示:新制氯水中存在Cl2、H2O、HClO的分子,存在H+、Cl-、ClO-和OH-离子。氯气与水的反应不能进行到底。
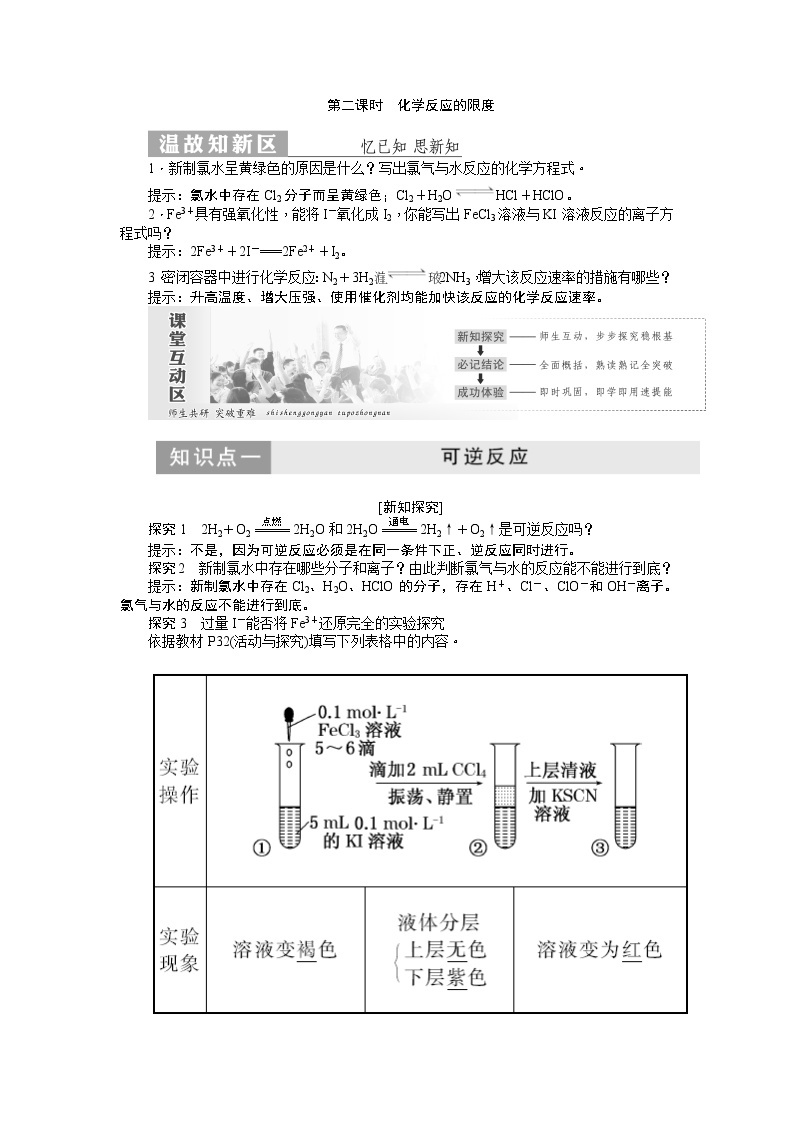
探究3 过量I-能否将Fe3+还原完全的实验探究
依据教材P32(活动与探究)填写下列表格中的内容。
[必记结论]
(1)可逆反应的概念:在同一条件下正反应方向和逆反应方向均能进行的化学反应。
(2)可逆反应的特点:
①正向反应和逆向反应同时进行。
②一定条件下,反应物不可能全部转化为生成物,即反应物的转化率不可能达到100%。
(3)表示:书写可逆反应的化学方程式时不用“===”而用“”。如N2和H2合成氨的化学方程式为
N2+3H22NH3 。
[成功体验]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)CO2+H2OH2CO3与H2CO3CO2+H2O互为可逆反应。( )
(2)可逆反应中一种反应物过量时,另一反应物可完全转化。( )
(3)可逆反应应用“”表示。( )
(4)可逆反应中先进行正反应再进行逆反应。( )
答案:(1)√ (2)× (3)√ (4)×
2.今有下列四组反应,其中属于可逆反应的是( )
A.2H2+O22H2O和2H2O2H2↑+O2↑
B.CaO+CO2===CaCO3和CaCO3CaO+CO2↑
C.NH4ClNH3↑+HCl↑和HCl+NH3===NH4Cl
D.SO2+H2O===H2SO3和H2SO3===SO2+H2O
解析:选D 可逆反应是指在同一条件下,同时向正、逆反应方向进行的反应,所以可逆反应必须是指在同一条件下,方向相反的两个反应同时进行,A、B、C中两反应的条件不同,不是可逆反应。
[新知探究]
探究1 在一定条件下,一个可逆反应进行到最大限度就是达到化学平衡状态,这时正、逆反应都停止了吗?
提示:可逆反应达化学平衡后,反应并没有停止,正、逆反应仍在进行。只是正、逆反应速率相等。
探究2 化学平衡状态是如何建立的?可逆反应在建立平衡状态的过程中,正、逆反应速率是如何变化的?依据化学平衡建立的图像填写下列空白。
化学平衡的建立(以N2+3H22NH3为例)
(1)反应开始时:v(正)最大,v(逆)为0。
(2)反应过程中:反应物浓度逐渐减小→v(正)逐渐减小,生成物浓度逐渐增大→v(逆)从 0 开始逐渐增大。
(3)反应达到平衡时:v(正)=v(逆),反应物和生成物的浓度保持不变。
探究3 一定温度下,密闭容器中进行反应:H2(g)+I2(g) 2HI(g),当容器的压强保持不变时,能否判断该反应处于平衡状态?若将反应改为N2(g)+3H2(g) 2NH3(g),当容器的压强保持不变时,反应是否处于平衡状态。
提示:不能判断反应是否处于平衡状态。若将反应改为N2(g)+3H2(g) 2NH3(g),当密闭容器中气体的压强保持不变时,表明反应处于平衡状态。
[必记结论]
1.化学平衡状态的概念
一定条件下的可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态,称为化学平衡状态。
2.化学平衡状态的标志
(1)v(正)=v(逆)
(2)各组分的物质的量浓度或百分含量保持不变
3.化学平衡状态的特征
[成功体验]
3.关于可逆反应达到化学反应限度的说法错误的是( )
A.改变外界条件不能改变化学反应限度
B.正、逆反应速率相等
C.各组分的含量不随时间的变化而变化
D.是动态平衡
解析:选A 化学反应限度可以通过改变外界条件来改变。
4.下列关于可逆反应的化学平衡的说法中,正确的是( )
A.当达到化学平衡时,反应物已完全转化为生成物
B.化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时,正、逆反应均已停止
解析:选B 当可逆反应达到化学平衡时,正、逆反应速率相等,但并未停止,此时反应体系中各成分的浓度不再改变(但不一定相等),当外界条件发生改变时,平衡可能被破坏,B正确,C、D错误;可逆反应中,反应物的转化率达不到100%,A错误。
———————————————[关键语句小结]————————————————
1.可逆反应的“二同一不完全”:
可逆反应中,正、逆两个反应是在“同”一条件下“同时”进行的,反应物不能“完全”转化。
2.化学平衡状态的含义及“五字特征”:
(1)含义:在一定条件下的可逆反应中,当正、逆反应速率相等时,体系中各组分的浓度保持不变的状态。
(2)“五字特征”——逆、等、动、定、变。
3.化学平衡状态判断的“两大依据”:
(1)根本依据:v(正)=v(逆);
(2)直接依据:各组分的浓度不再变化。
[例1] 在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1
解析:选B 假设SO2、O2完全转化为SO3,则c(SO2)=c(O2)=0,c(SO3)=0.4 mol·L-1;假设SO3完全转化为SO2和O2,则c(SO2)=0.4 mol·L-1,c(O2)=0.2 mol·L-1,c(SO3)=0,而可逆反应的特点是反应不能进行到底,故A、C错误,B正确;又因为反应物SO2和生成物SO3不可能同时减小,故D错误。
解答该类型题目的方法和依据
(1)方法:先假设反应物100%转化为生成物,求出c(反应物)的最小值和c(生成物)的最大值;再假设生成物100%转化为反应物,求出c(反应物)的最大值和c(生成物)的最小值,最后讨论分析。
(2)依据:可逆反应中反应物的转化率小于100%。
1.对于可逆反应2SO2+O22SO3,在混合气体中充入一定量 18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于SO3和O2中
C.只存在于SO2和O2中
D.存在于SO2、SO3和O2中
解析:选D 可逆反应的特点,正、逆反应同时进行,反应物与生成物共存。
[例2] 一定温度下,在恒容密闭容器中进行的可逆反应:2NO2(g) 2NO(g)+O2(g)。判断下列描述中反应处于平衡状态的是________________。
①单位时间内生成n mol O2的同时生成 2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤密闭容器中压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
解析:①中单位时间内生成n mol O2的同时,必消耗 2n mol 的NO2,所以①能说明反应达到平衡状态;②中描述的都是正反应方向的速率,不能说明反应是否处于平衡状态;③中无论反应是否达平衡状态,同向的速率之比一定为化学方程式的相应物质的化学计量数比;④中混合气体的颜色不变,即c(NO2)保持不变,说明反应处于平衡状态;⑤⑥因该反应是一个反应前后气体物质的量不等的反应,容器的体积固定,故气体的压强不变,气体的平均相对分子质量不变,均能说明反应处于平衡状态。
答案:①④⑤⑥
可逆反应达平衡状态的标志
(1)直接标志:
①v(正)=v(逆)≠0。
a.同一种物质的生成速率等于消耗速率;
b.在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比;
c.在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比。
②各组分的浓度保持一定。
a.各组分的浓度不随时间的改变而改变;
b.各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
(2)间接标志:
①反应体系中总压强不随时间变化(适用于反应前后气体体积不等的反应)。
②混合气体的密度不随时间变化(适用于等压条件下反应前后气体体积不等的反应和等容条件下有固、液体参与或生成的反应)。
③对于反应混合物中存在有颜色的物质的可逆反应,若体系颜色不再变化,则反应达到平衡状态。
若将一定温度下密闭容器中进行的可逆反应改为H2(g)+I2(g) 2HI(g),则例2中的④、⑤、⑥三项的描述中反应处于平衡状态的是__________。
答案:④
[例3] 在2 L的密闭容器中有如图所示的反应,看图按要求回答下列问题:
(1)图中所示的反应物:Ⅰ是________,Ⅱ是________。
(2)写出图中表示的化学方程式:
Ⅰ________________________________________________________________________,
Ⅱ________________________________________________________________________。
(3)在图Ⅱ中,以0~10 s内的平均反应速率计算,t=6 s时A的浓度是________ mol·L-1。
解析:在图Ⅰ和图Ⅱ中,都是A的浓度随反应的进行不断减小至不变,B、C的浓度随反应的进行不断增大至不变,所以A为反应物,B、C为生成物。不同的是图Ⅰ中A的最终浓度为0,图Ⅱ中不为0,所以图Ⅰ中的反应是不可逆反应,而图Ⅱ中的反应是可逆反应。图Ⅱ中,10 s时,变化的c(A)=1.2 mol·L-1-0.8 mol·L-1=0.4 mol·L-1,所以6 s时变化的c(A)=6 s×=0.24 mol·L-1,此时c(A)=0.96 mol·L-1。
答案:(1)A A (2)3A===2B+C AB+2C (3)0.96
图像题解题三步曲
一看——看图像:①看面:弄清纵、横坐标的含义。②看线:弄清线的走向。③看点:弄清曲线点的含义。④看量的变化:弄清是浓度变化还是物质的量变化。
二想——想规律:看完线后联想外界条件对化学反应速率的影响规律。
三判断——通过对比分析,作出正确判断。
2.某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论错误的是( )
A.该反应的化学方程式为2Z+Y3X
B.反应开始至2 min末,X的反应速率为0.2 mol·(L·s)-1
C.该反应是由正、逆反应同时开始的,最终建立平衡
D.若增加或减少X的物质的量,反应速率一定会发生明显的变化
解析:选B 从图中横、纵坐标及曲线的变化趋势可找到X、Y、Z转化的物质的量之比,即可写出该反应的化学方程式2Z+Y3X,故A项正确。根据反应速率的计算公式,可求出X的反应速率:v(X)=≈0.067 mol·(L·s)-1,故B项错误。根据题图中曲线均不通过原点,可判断该可逆反应是由正、逆反应同时开始的,故C项正确。因X为气体,改变其物质的量,必然会导致其浓度的改变,因此反应速率也会随之改变,故D项正确。
1.下列反应体系中,不属于可逆反应的是( )
A.Cl2溶解于水
B.氨气溶解于水
C.工业合成氨
D.Na2CO3+CO2+H2O===2NaHCO3和
2NaHCO3Na2CO3+CO2↑+H2O
解析:选D A项,Cl2溶于水存在反应:Cl2+H2OHCl+HClO;B项,NH3溶于水存在反应:NH3+H2ONH3·H2O;C项,N2+3H22NH3;D项,两反应的条件不同,不是可逆反应。
2.假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( )
A.A2+3B22AB3
B.2AB2+B22AB3
C.2A2B+5B2===4AB3
D.2AB2+B2===2AB3
解析:选B 由图可知反应物用AB2、B2表示,生成物用AB3表示,反应后反应物与生成物共存,说明反应不能进行到底,为可逆反应,结合反应前后原子守恒可知反应方程式为2AB2+B22AB3。
3.对化学反应限度的叙述,错误的是( )
A.化学反应的限度不可改变
B.反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关
D.任何可逆反应都有一定的限度
解析:选A 化学反应的限度可通过改变外界条件而改变。
4.可逆反应N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
解析:选C 当正反应速率等于逆反应速率时,可逆反应达到平衡状态。根据化学方程式中NH3和H2的计量关系,可以看出正反应在单位时间内有3 mol H2发生化合反应,必定同时生成2 mol NH3,故有2v正(H2)=3v正(NH3)。这时逆反应如果同时有2 mol NH3发生分解反应,NH3的物质的量就相当于没有变化,好像“表面上静止”达到平衡状态。所以当2v正(H2)=3v逆(NH3)时,NH3的正、逆反应速率相等,说明反应已达到平衡状态,C正确;不能用同一方向的速率证明反应达到平衡,A错误;B、D比值关系错误。
5.在一体积为10 L的容器中,通入一定量的CO和H2O,850 ℃时发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=________mol·L-1·min-1。
(2)如图中4~5 min该反应________(填“是”或“否”)处于平衡状态;判断理由________________________。
解析:(1)观察题图可知,在0~4 min,CO的浓度从0.20 mol·L-1减少到0.08 mol·L-1,则v(CO)==0.03 mol·L-1·min-1。
(2)在4~5 min,反应物CO、H2O(g)浓度不再减小,则生成物CO2、H2的浓度也应该不再增大,故此时处于平衡状态。
答案:(1)0.03 (2)是 反应物的浓度不再变化
高中化学苏教版必修二专题3 有机化合物的获得与应用第一单元 化石燃料与有机化合物第一课时练习: 这是一份高中化学苏教版必修二专题3 有机化合物的获得与应用第一单元 化石燃料与有机化合物第一课时练习,共14页。
高中化学苏教版必修二第二单元 微粒之间的相互作用力习题: 这是一份高中化学苏教版必修二第二单元 微粒之间的相互作用力习题,共3页。
化学必修二第二单元 化学反应中的热量课时训练: 这是一份化学必修二第二单元 化学反应中的热量课时训练,共14页。













