四川省宜宾市第四中学校2020届高三下学期第四学月考试理综-化学试题
展开7.化学,就在身旁。下列说法错误的是
A.常见医用口罩的过滤层主要材质是聚丙烯,其结构简式为
B.气溶胶是固态或液态颗粒分散在气体介质中所形成的分散系
C.为了防止蛋白质变性,疫苗等生物制剂要冷冻保藏
D.中医经典方剂“清肺排毒汤”,其处方组成中的生石膏化学式为CaSO4·2H2O
8.下列条件下,可以大量共存的离子组是
A.pH=11的溶液中:Na+、K+、Cl-、CO32-
B.含有大量CH3COO-的溶液中:H+ 、K+、SO42-、NO3-
C.某无色透明溶液中:Na+、Cu2+、SO42-、OH-
D.0.1 mol/L的H2SO4溶液中:K+、Ba2+、Cl-、NO3-
9.下列图示方法不能完成相应实验的是
A.实验室制取并收集NH3 B.分离SiO2和NH4Cl
C.检验草酸晶体中是否含有结晶水 D.验证热稳定性:Na2CO3>NaHCO3
10.第26届国际计量大会修订了阿伏加德罗常数的定义,并于2019年5月20日正式生效。NA表示阿伏伽德罗常数的值,下列说法正确的是
A.8.8g乙酸乙酯中所含共用电子对数为1.3NA
B.常温常压下28gFe与足量浓硝酸混合,转移电子数为1.5NA
C.标准状况下,2.24LCl2与CH4反应完全,形成C一Cl键的数目为0.1NA
D.常温下pH=12的NaOH溶液中,由水电离出的氢离子的数目为10-12NA
11.短周期元素X、Y、Z、M的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列说法正确的是
A. 原子半径:M>Z>Y>X B. 4种元素中Y的非金属性最强
C. Z的氧化物的水化物是强酸 D. 元素X可与元素M形成共价化合物XM2
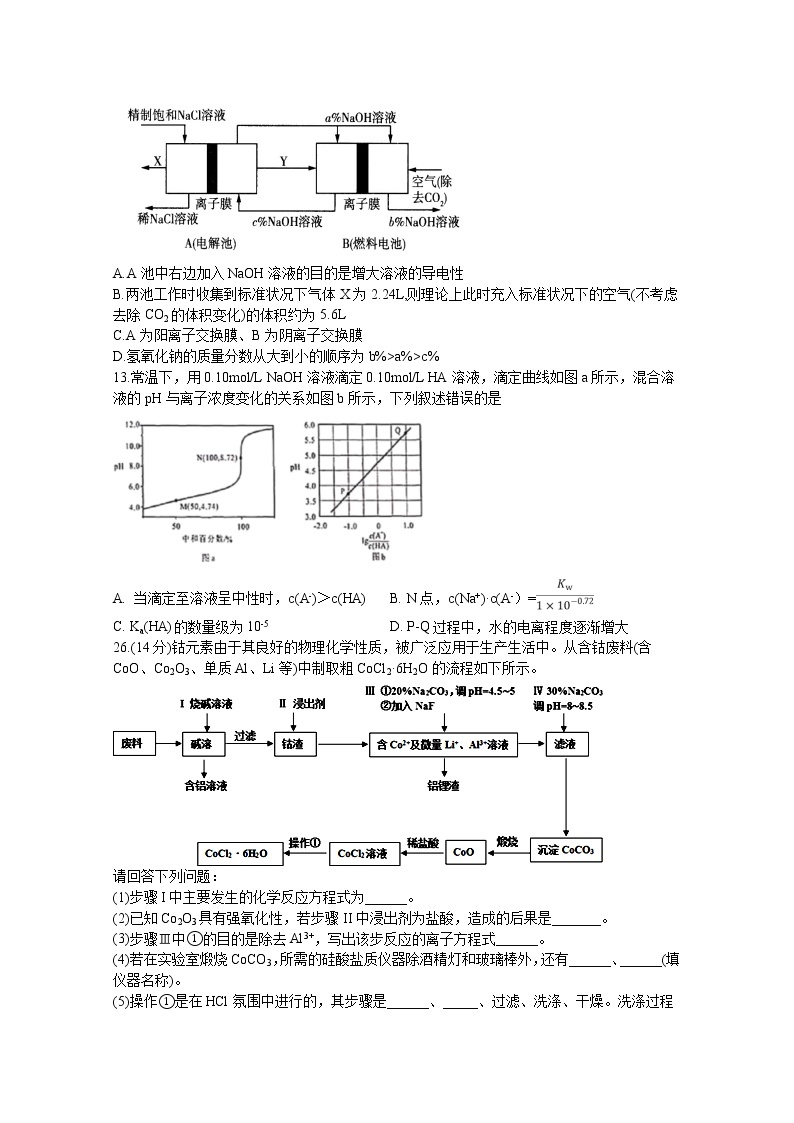
12.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,工作原理如图所示,其中各电极未标出。下列有关说法错误的是
A.A池中右边加入NaOH溶液的目的是增大溶液的导电性
B.两池工作时收集到标准状况下气体X为2.24L,则理论上此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为5.6L
C.A为阳离子交换膜、B为阴离子交换膜
D.氢氧化钠的质量分数从大到小的顺序为b%>a%>c%
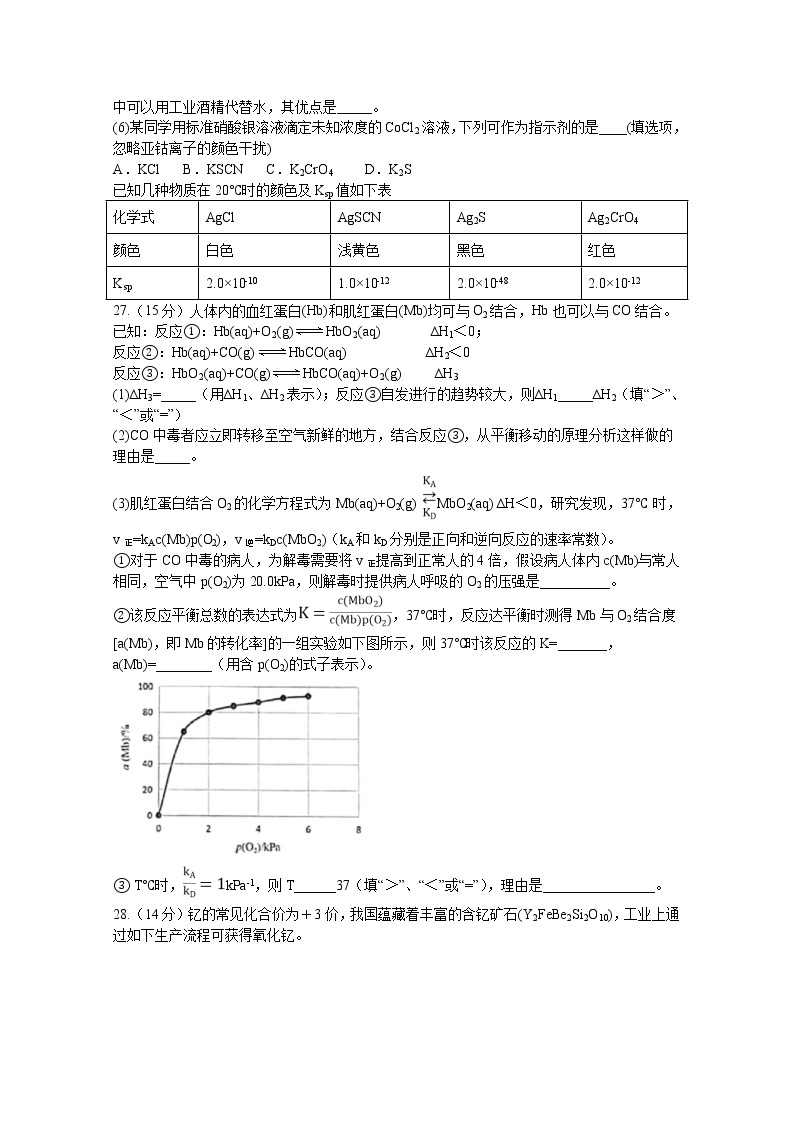
13.常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是
A. 当滴定至溶液呈中性时,c(A-)>c(HA) B. N点,c(Na+)·c(A-)=
C. Ka(HA)的数量级为10-5 D. P-Q过程中,水的电离程度逐渐增大
26.(14分)钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
27.(15分)人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)HbO2(aq) ∆H1<0;
反应②:Hb(aq)+CO(g)HbCO(aq) ∆H2<0
反应③:HbO2(aq)+CO(g)HbCO(aq)+O2(g) ∆H3
(1)∆H3=_____(用∆H1、∆H2表示);反应③自发进行的趋势较大,则∆H1_____∆H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) MbO2(aq) ∆H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
②该反应平衡总数的表达式为,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
③ T℃时,kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
28.(14分)钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
35.(15分)化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OHCr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Se3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Se3+、Zn2+的水合离子为无色的原因为_______________________。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为_____________________。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
(5)锌的堆积方式为_________,配位数为__________________。
(6)若梓原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为______g/㎝3 (用含a的代数式表示)。
36(15分).[化学——选修5:有机化学基础]有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):
已知:①A分子的核磁共振氢谱中有3组峰;
②(NH2容易被氧化);
③已知(CH3CO)2O的结构为:④RCH2COOH
请回答下列问题:
(1)B的化学名称为__________________________。
(2)C→D的反应类型是_____________,I的结构简式为_________________________。
(3)F→G的化学方程式为__________________________________________。
(4)M不可能发生的反应为_____________(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有________________、________________。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以为原料(无机试剂任选),设计制备的合成路线:_______________________________________。
化学参考答案
7-13:AACCDCB
26.2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑、2Li + 2H2O=2 Li OH + H2↑ 会产生有毒气体氯气 2Al3+ + 3CO32- + 3H2O=2Al(OH)3↓ + 3CO2↑ 坩埚 泥三角 蒸发浓缩 冷却结晶 减少晶体的溶解损失 C
27.∆H2-∆H1 > 增大O2的浓度,减小CO的浓度,使平衡逆移 80.0kPa 2 kPa-1 2 kPa-1 > ,K(T℃)<K(37℃),该反应为放热反应,升温会使平衡常数减小
28.工业粘合剂、制备硅胶、木材防火剂等 B BeO22-+4H+===Be2++2H2O 10-4.3 3.1~6.0 Y3++3NH3·H2O=Y(OH)3↓+3NH4+ Y2(C2O4)3·nH2OY2O3+3CO↑+3CO2↑+nH2O
35. O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC 或 六方最密堆积 12 或
36.乙二醛 取代反应 +HOOCCHBrCOOH―→ +HB d 或、、、等








