

2019年初中化学中考复习 03 元素和构成物质的微粒 试卷
展开2019年初中化学中考复习 03 元素和构成物质的微粒
一、单选题(共12题;共24分)
1.下列关于分子、原子、离子的说法正确的是( )
A. 分子是保持物质性质的最小粒子 B. 物质都是由分子构成
C. 离子是带电的原子或原子团 D. 原子都含有质子、中子和电子
2.2014年,德国亥姆霍兹重离子研究中心再次成功合成117号元素,该元素原子的核内有117个质子,原子质量约是氢原子质量的291倍,则该原子的核外电子数为( )
A. 117 B. 174 C. 291 D. 408
3.下列粒子的结构示意图中,表示氯离子的是( )
A. B. C. D.
4.涂改液用量虽少,毒性却不小。我们在使用涂改液时会闻到特殊的气味,从分子的角度可以解释为( )
A. 分子在不断运动 B. 分子之间有间隔 C. 分子可以再分 D. 分子很小
5.已知R元素的相对原子质量A与其原子核内的质子数和中子数之和在数值上相等。若R2+核外有x个电子,则其原子核内的中子数为( )
A. A-x+2 B. A+x+2 C. A-x-2 D. A+x-2
6.A原子与B原子的质量之比为a∶b,而B原子与作为相对原子质量标准的碳原子的质量之比为m∶n,则A原子的相对原子质量为( )
A. B. C. D.
7.在我们的日常生活中出现了加碘食盐,增铁酱油,高钙牛奶等。这里的碘、铁、钙等应为( )
A. 单质 B. 分子 C. 元素 D. 原子
8.下列物质中,由原子构成的是( )
A. 氧气 B. 氯化钠 C. 蒸馏水 D. 金刚石
9.元素周期表中锌元素的某些信息如图所示,下列有关锌的说法错误的是( )
A. 锌原子核外有30个电子 B. 锌的相对原子质量为65.38 g
C. 锌是金属元素 D. 锌离子核内质子数为30
10.下列化学符号中,能表示一个原子,一种元素,还能表示一种物质的是 ( )
A. Cu B. O C. H D. Cl
11.元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分,根据它的结构和特点获取的信息错误的是( )
A. Z处的元素是非金属元素
B. X处元素的原子核外有3个电子层
C. 氧原子核外第二电子层上的电子数y的值是6
D. 最后一列原子的核外电子排布不同,化学性质也不同
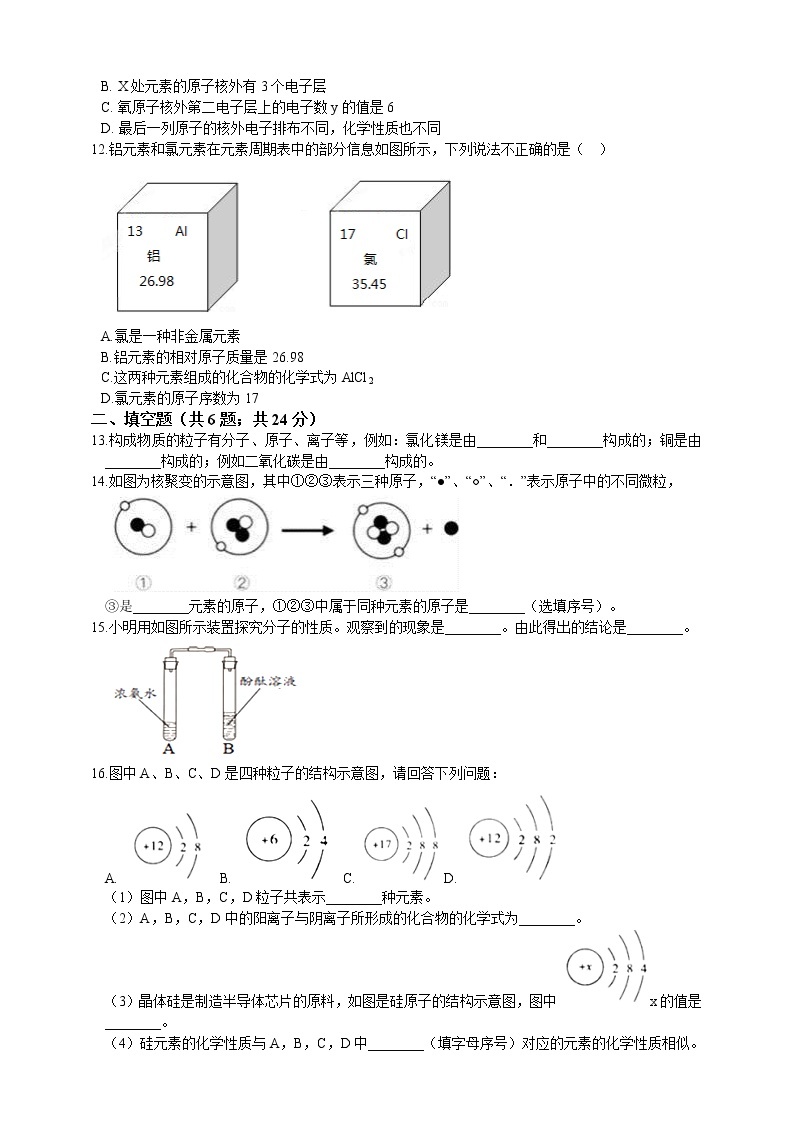
12.铝元素和氯元素在元素周期表中的部分信息如图所示,下列说法不正确的是( )
A.氯是一种非金属元素
B.铝元素的相对原子质量是26.98
C.这两种元素组成的化合物的化学式为AlCl2
D.氯元素的原子序数为17
二、填空题(共6题;共24分)
13.构成物质的粒子有分子、原子、离子等,例如:氯化镁是由________和________构成的;铜是由________构成的;例如二氧化碳是由________构成的。
14.如图为核聚变的示意图,其中①②③表示三种原子,“●”、“○”、“.”表示原子中的不同微粒,
③是________元素的原子,①②③中属于同种元素的原子是________(选填序号)。
15.小明用如图所示装置探究分子的性质。观察到的现象是________。由此得出的结论是________。
16.图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:
A. B. C. D.
(1)图中A,B,C,D粒子共表示________种元素。
(2)A,B,C,D中的阳离子与阴离子所形成的化合物的化学式为________。
(3)晶体硅是制造半导体芯片的原料,如图是硅原子的结构示意图,图中 x的值是________。
(4)硅元素的化学性质与A,B,C,D中________(填字母序号)对应的元素的化学性质相似。
17.化学是在分子、原子水平上研究物质的科学。
(1)构成物质的微粒有分子、原子和________。
(2)如图为三种元素的原子结构示意图。
①氧原子在化学反应中容易________电子 填“得到”或“失去” 。
②硒元素能增强人体免疫力,延缓衰老,山药等食物中常含硒元素。硒 在氧气中燃烧生成二氧化硒。回答下列问题:
A.硒原子的核电荷数为________;
B.硒元素与氧元素、硫元素的化学性质相似,原因是它们的原子________相同;
C.写出硒在氧气中燃烧的化学方程式________。
18.元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布:请回答下列问题:
①第17号元素属于________元素(填“金属”或“非金属”),其次外层电子数为 ________。
②元素的化学性质与原子结构中的 ________数关系密切;在同一族中,各元素的原子结构呈现的规律有 ________(任写一点)。
③地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物为 ________。第16号元素在化学反应中容易形成 ________(填离子符号),该元素的单质在氧气中燃烧的现象是________ 。
答案解析部分
一、单选题
1.C
解析:A、分子是保持物质化学性质的最小粒子,A不符合题意
B、构成物质的微粒有分子、原子和离子,B不符合题意
C、离子是指带电的原子或原子团,C符合题意;
D、氢原子核内没有中子,D不符合题意。
故答案为:C。
【分析】A根据分子的概念分析解答
B根据构成物质的离子由分子、原子和离子解答
C根据离子是指带电的原子或原子团解答
D根据氢原子中不含中子解答
2.A
解析:同一原子中,质子数=核外电子数=核电荷数=原子序数;相对原子质量=质子数+中子数,氢的相对原子质量为1,该原子的原子质量约是氢原子质量的291倍,所以相对原子质量为291,中子数为174.
故答案为:A
【分析】根据在原子中质子数等于核电荷数=原子序数=核外电子数,相对原子质量在数值上等于质子数+中子数,据此分析解答
3.C
解析:A.18号元素是氩元素,质子数=核外电子数,属于氩原子,A不符合题意
B.12号元素是镁元素,质子数>核外电子数,属于镁离子,B不符合题意
C.17号元素是氯元素,质子数<核外电子数,属于氯离子,C符合题意
D.8号元素是氧元素,质子数<核外电子数,属于氧离子,D不符合题意
故答案为:C
【分析】根据原子得失电子形成离子,质子数决定元素的种类解答
4.A
解析:大多数涂改液在使用时会闻到气味,是因为涂改液中含有的分子是不断运动的,向四周扩散使人闻到气味
故答案为:A
【分析】根据分子的特性分析解答:分子的质量和体积都很小,分子是不断运动的,分子之间有间隔,据此分析解答
5.C
解析:同一原子中,质子数=核外电子数=核电荷数=原子序数;在阳离子中:质子数>核外电子;在阴离子中:质子数<核外电子;相对原子质量=质子数+中子数。若r2+核外有x个电子,则其原子核内的质子数为x+2,中子数为A-(x+2),即A-x-2。
故答案为:C
【分析】根据原子和离子的核外电子排布分析。
6.A
解析:设A原子质量为x,B原子的质量为y,碳原子的质量是z,则 = ,x= , = ,z= ,碳原子质量的 为 ,则A原子的相对原子质量为: = ,
故答案为:A
【分析】先根据题意推断碳原子的质量,再根据相对原子质量的概念计算A原子的相对原子质量。
7.C
解析:据所学知识可知,加碘食盐,增铁酱油,高钙牛奶等。这里的碘、铁、钙等应为元素。
故答案为:C。
【分析】根据物质是由元素组成的分析解答
8.D
解析:氧气是由分子构成,A不符合题意;
B、氯化钠是由氯离子和钠离子构成,B不符合题意;
C、水是由水分子构成,C不符合题意;
D、金刚石是由碳一直直接构成的,D符合题意。
故答案为:D。
【分析】一般情况下,由金属、固态非金属和稀有气体形成的单质是由原子直接构成的,由非金属元素形成的化合物是由分子构成,由金属元素和非金属元素形成的化合物是由离子构成,据此分析解答。
9.B
解析:A、根据元素周期表中锌元素的相关信息:原子序数=核外电子数=质子数=30,选项不符合题意;
B、根据相对原子质量是有单位的,其单位为“1”,只不过常省略而已,相对原子质量为65.38,选项符合题意;
C、根据化学元素汉字名称的偏旁可辨别元素的种类,可知锌元素是金属元素,选项不符合题意;
D、原子通过得失电子转化为离子,原子核内质子数不变,选项不符合题意,
故答案为:B。
【分析】根据元素周期表小格中信息分析,元素周期表小格中左上角为原子序数,在原子中,原子序数=质子数=核电荷数=电子数,右上角为元素符号,中间为元素名称,最下面为相对原子质量。
10.A
解析:A.Cu表示铜元素和一个铜原子,还能表示铜这种物质,符合题意;
B.O不能表示物质,不符合题意;
C.H不能表示物质,不符合题意;
D.Cl不能表示物质,不符合题意;
故答案为:A。
【分析】根据元素符号的含义及化学式的书写分析。
11.D
解析:A. Z处的元素为氩元素,属于非金属元素,不符合题意;
B. X处元素 为第三周期,核外有3个电子层,不符合题意;
C. 原子中质子数=电子数,氧原子核外第二电子层上的电子数y的值是6 ,不符合题意;
D. 化学性质由最外层电子数决定,最外层电子数相同则化学性质相似,符合题意;
故答案为:D。
【分析】根据元素周期表中的信息及规律分析。
12.C
解析:A. 氯是一种非金属元素 ,不符合题意;
B.由铝的元素周期表小格信息可知,相对原子质量为26.98,不符合题意;
C.铝和氯元素组成的化合物化学式为AlCl3 , 符合题意;
D. 元素周期表小格中左上角数字为原子序数,氯元素的原子序数为17,不符合题意;
故答案为:C
【分析】根据元素周期表小格中信息分析,元素周期表小格中左上角为原子序数,在原子中,原子序数=质子数=核电荷数=电子数,右上角为元素符号,中间为元素名称,最下面为相对原子质量;根据化合物化学式书写方法分析。
二、填空题
13.镁离子;氯离子(颠倒顺序可给分);铜原子;二氧化碳分子
解析:(1)氯化镁是由镁离子和氯离子构成的化合物,故填镁离子和氯离子(颠倒顺序可给分);(2)铜是由铜原子直接构成的金属单质,故填铜原子;(3)二氧化碳是由二氧化碳分子构成的化合物,故填二氧化碳分子。
【分析】物质与其构成粒子之间的关系:
① 原子直接构成物质。如汞、金刚石直接由原子构成。
② 金属元素原子和非金属元素原子分别形成阳离子和阴离子。如氯化钠是由氯离子和钠离子构成的。
③ 非金属元素离子和非金属元素离子各提供电子形成共用电子对,结合成分子。如氧气是由氧分子构成的。
14.氦;①②
解析:在原子中,电子在原子核的外部,所以小圈表示的是电子,在原子中,质子数=电子数,所以白球表示质子,黑圈表示中子;再根据元素的种类是由质子数决定的可知,③这种元素的原子核内有2个质子,所以是氦元素的原子;质子数决定元素的种类,由微观结构示意图可知,①和②这两种粒子核内的质子数均为1,故属于同种元素。
【分析】根据元素种类由质子数决定,质子数相同则属于同种元素分析。
15.试管B中酚酞溶液变红;分子在不断运动
解析:浓氨水具有挥发性,挥发出氨气,氨气挥发到B试管中溶于水显碱性,能使酚酞试液变红,故填试管B中酚酞溶液变红;
所以一段时间后,观察到试管B中无色酚酞溶液变红,是因为氨分子分子运动到试管B中的缘故,故填分子在不断运动。
【分析】根据分子的性质及酚酞变色的情况分析。
16.(1)三
(2)MgCl2
(3)4
(4)B
解析:图中A、B、C、D四种粒子分别表示镁离子、碳原子、氯离子和镁原子。(1)我们把具有相同质子数的原子归为一类,每一类原子称之为一种元素,镁离子和镁原子具有相同的质子数,是同一类原子;(2)镁离子和氯离子所形成的化合物是氯化镁,氯化镁的化学式是 MgCl2;(3)在原子中,质子数=核外电子数,所以x=2+8+4=14;(4)硅原子的最外层电子数是4,与碳原子位于同一族,化学性质相似。
【分析】(1)根据元素种类由质子数决定分析;
(2)根据化合物化学式书写方法分析;
(3)根据原子中质子数=电子数分析;
(4)根据化学性质由最外层电子数决定分析。
17.(1)离子
(2)得到;34;最外层的电子数;
解:(1)构成物质的粒子有分子、原子和离子;(2)①氧原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的氧离子;②A、硒原子的核电荷数为34;
B、元素的化学性质跟它的原子的最外层电子数目关系非常密切,决定元素化学性质的是最外层电子数,硒元素与氧、硫元素的化学性质相似的原因是它们原子的最外层的电子数相同。
C、硒在氧气中燃烧反应的化学方程式为:
【分析】(1)根据构成物质的粒子种类分析;
(2)根据最外层电子数大于4易得电子小于4易失电子分析;根据元素种类的决定因素分析;根据方程式书写原则分析。
18.非金属;8;最外层电子数;电子层数依次递增(合理即可得分);Al2O3;S2-;发出蓝紫色火焰、产生具有刺激性气味的气体、放热
解析:①由元素周期表可知,17号元素是氯元素,其汉字名称的偏旁是“气”,属于非金属元素;由其原子结构示意图可知,其次外层电子数为8;
②元素的化学性质与原子结构中的最外层电子数关系密切;在同一族中,各元素的原子结构呈现的规律有:从上到下电子层数依次递增(或最外层电子数相等或从上到下核电荷数增大等);
③地壳中含量最多的金属元素是Al,含量最多的非金属元素是O,化合价分别是+3、-2,所以它们组成的化合物是Al2O3;第16号元素是硫元素,其原子结构中最外层电子数为6,大于4,在化学反应中容易得到2个电子,形成硫离子,符号为:S2-;硫在氧气中燃烧的现象是:发出蓝紫色火焰、产生具有刺激性气味的气体、放热。
故答案为: 非金属 ; 8 ; 最外层电子数 ; 电子层数依次递增(合理即可得分) ; Al2O3 ; S2- ; 发出蓝紫色火焰、产生具有刺激性气味的气体、放热
【分析】元素的化学性质与其最外层电子数联系最紧密;
地壳中含量最多的金属元素是铝元素,最多的非金属是氧元素,根据化学式的书写方法解答;
硫原子最外层6个电子,在化学反应中 得到2个电子形成阴离子,硫在氧气中燃烧发出明亮的蓝紫色火焰生成有刺激性气味的气体








