

【讲通练透】高考化学知识清单22 水溶液中的离子平衡(思维导图+知识解读+易混易错+典例分析)
展开2.精练高考真题,明确方向。经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药。要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力。复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
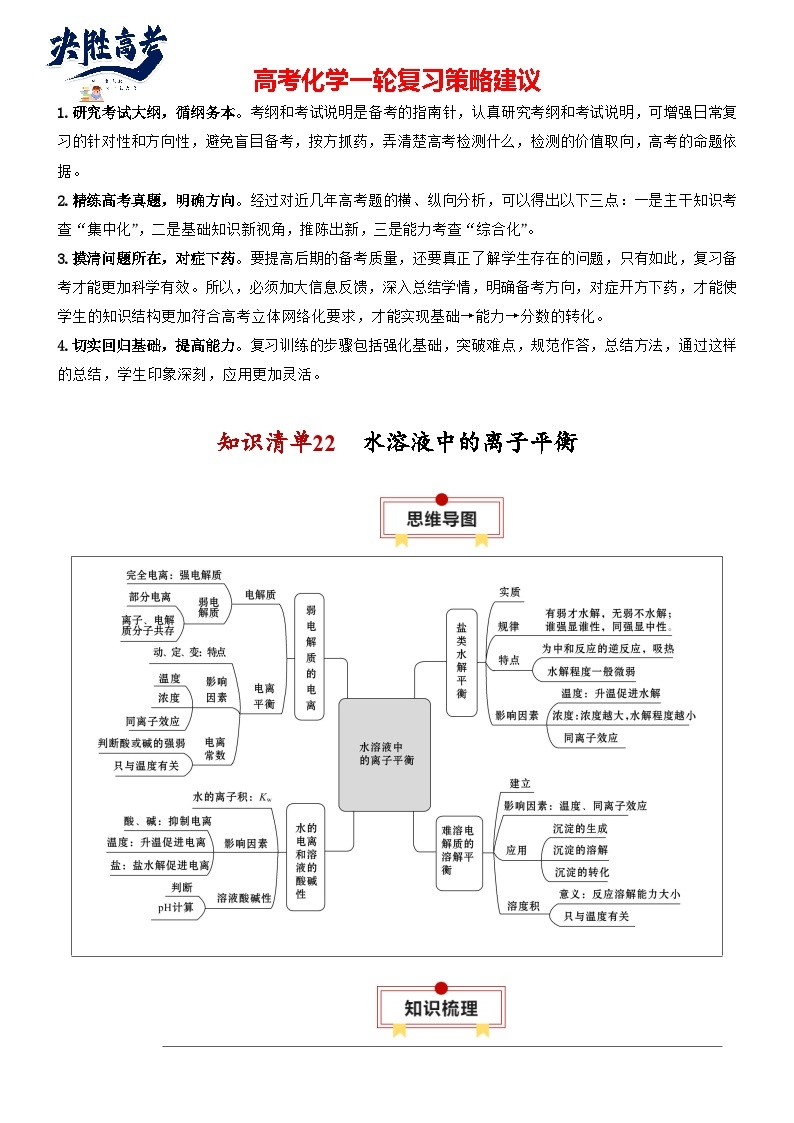
知识清单22 水溶液中的离子平衡
知识点01 强电解质和弱电解质
1.常见强电解质
(1)强酸
①无氧酸:HCl、HBr、HI
②含氧酸:H2SO4、HNO3、HClO4
(2)强碱
①一元碱:KOH、NaOH
②二元碱:Ca(OH)2、Ba(OH)2
③有机碱:[Ag(NH3)2]OH
(3)大多数盐:Fe(SCN)3除外
(4)金属氧化物:如Na2O、Al2O3等(熔融态电离)
2.常见弱电解质:弱酸、弱碱、少数盐和水
3.电解质溶液的特点
(1)强电解质:不含溶质分子,含溶剂分子
(2)弱电解质:溶质分子和溶质离子共存
4.弱电解质的判断(以弱酸HA为例)
(1)电离方面:不能完全电离,存在电离平衡
①10-nml/L的HA溶液pH≠n
②同浓度的HA和HCl溶液,导电性HCl的弱
③同浓度的HA和HCl溶液与B反应,HA速率慢
④同pH的HA和HCl溶液与B反应,HCl速率慢
⑤同体积同pH的HA和HCl溶液与足量B反应,HA消耗的B多,产生的产物多
⑥pH=1的HA与pH=13的强碱等体积混合,溶液呈酸性
⑦盐酸与锌反应,加入少量NaA固体反应速率减慢
⑧同pH的HA和HCl溶液加入相应钠盐,HA的pH增大
(2)水解方面:电解质越弱,对应离子的水解能力越强
①NaA溶液的pH>7
②NaA溶于水,加入酚酞试液,呈红色
③在NaA溶液中,c(Na+)>c(A-)
(3)稀释方面:加水稀释,平衡移动
①同倍数稀释同pH的HCl与HA,HA的pH小
②pH=a的HCl与HA稀释成pH=b,HA加水量多
(4)强制弱酸原理:比较酸(碱)性的相对强弱
①将HA加到碳酸钠溶液中,有气泡产生,只能说明酸性:HA>H2CO3,但不能说明HA是弱酸
②将盐酸加到NaA溶液中,有HA产生,说明酸性:HCl>HA,能说明HA是弱酸
知识点02 电解质溶液中的方程式
1.电离方程式的书写
(1)强酸的酸式盐:硫酸氢盐,如:NaHSO4
①水溶液:NaHSO4Na++H++SO42-
②熔融态:NaHSO4Na++HSO4-
(2)弱酸的酸式盐:除了硫酸氢盐外的其他酸式盐
①NaHCO3:NaHCO3Na++HCO3-
②KH2PO4:KH2PO4K++H2PO4-
(3)多元弱酸分步电离,以第一步为主
①H2CO3第一步电离:H2CO3H++HCO3-
②H2CO3第二步电离:HCO3-H++CO32-
(4)多元弱碱分步电离,一般一步到位
①Fe(OH)3的正常电离:Fe(OH)3Fe3++3OH-
②Fe(OH)3第一步电离:Fe(OH)3[Fe(OH)2]++OH-
(5)借水型电离
①NH3·H2O的电离:NH3·H2ONH4++OH-
②Al(OH)3酸式电离:Al(OH)3+H2O[Al(OH)4]-+H+
(6)自偶电离:一个分子失去H+,另一个分子得到H+
①H2O(l):2H2OH3O++OH-
②NH3(l):2NH3NH4++NH2-
③HNO3(l):2HNO3H2NO3++NO3-
2.水解方程式的书写
(1)水解的本质:复分解反应
①弱阴离子结合水中的H+,形成弱酸,溶液呈碱性
②弱阳离子结合水中的OH-,形成弱碱,溶液呈酸性
③NH4++D2ONH3•HDO+D+
(2)多元弱酸根离子分步水解,以第一步为主
①CO32-第一步水解:CO32-+H2OHCO3-+OH-
②CO32-第二步水解:HCO3-+H2OH2CO3+OH-
(3)多元弱碱根离子分步水解,一般一步到位
①Fe3+的正常水解:Fe3++3H2OFe(OH)3+3H+
②Fe3+第一步水解:Fe3++H2O[Fe(OH)]2++H+
(4)电离型水解
①[Al(OH)4]-:[Al(OH)4]-Al(OH)3+OH-
②AlO2-:AlO2-+2H2OAl(OH)3+OH-
(5)完全进行的双水解反应
①Al3++HCO3-:Al3++3HCO3-Al(OH)3↓+3CO2↑
②Fe3++ClO-:Fe3++3ClO-+3H2OFe(OH)3↓+3HClO
③NH4++[Al(OH)4]-:[Al(OH)4]-+NH4+Al(OH)3↓+ NH3·H2O
(6)广义的水解
①Mg3N2:Mg3N2+6H2O3Mg(OH)2↓+2NH3↑
②Al2S3:Al2S3+6H2O2Al(OH)3↓+3H2S↑
③SiCl4:SiCl4+4H2OH4SiO4↓+4HCl
④IBr:IBr+H2OHIO+HBr
3.沉淀溶解平衡方程式的书写
(1)Ag2SO4:Ag2SO4(s)2Ag+(aq)+SO42-(aq)
(2)Ca5(PO4)3OH:Ca5(PO4)3OH5Ca2++3PO43-+OH-
4.沉淀转化方程式的书写
(1)CaSO4→CaCO3:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
(2)ZnS→CuS:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
5.注意问题
(1)有水参与的反应不一定是水解反应,还可能是电离反应
①电离平衡:HS-+H2OS2-+H3O+
②水解平衡:HS-+H2OH2S+OH-
(2)注意电离方程式和沉淀溶解平衡方程式的区别
①完全电离:AgCl(s)Ag+(aq)+Cl-(aq)
②沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
(3)电离型水解和水解型电离
①电离平衡:Al(OH)3+H2O[Al(OH)4]-+H+
②电离平衡:NH3+H2ONH4++OH-
③水解平衡:[Al(OH)4]-Al(OH)3+OH-
【特别提醒】溶液中的两个相当处理
(1)H3O+H2O+H+
(2)[Al(OH)4]-或AlO2-Al(OH)3+OH-
知识点03 水的电离平衡
1.水的电离平衡:H2OH++OH-△H<0
(1)平衡移动
①温度:越热越电离;
②酸、碱抑制水的电离
③弱盐及能够和H+或OH-反应的微粒促进水的电离
(2)具体情况下水的电离平衡移动
①有水参与的电解反应:正向移动
②向水中加入氨水:逆向移动
③向水中通入氨气:正向移动
④向水中加入Na、Na2O和Na2O2:正向移动
⑤向饱和氯水中加入少量固体NaCl:逆向移动
⑥硼酸(H3BO3)溶于水生成[B(OH)4]-:正向移动
2.c(H+)水和c(OH-)水的关系:在任何情况下都相等
3.水的电离度:(H2O)=×100%=×100%=1.8c(H+)水%
(1)不同溶液中水的电离度之比等于c(H+)水之比
(2)酸和碱抑制水的电离,酸碱性越强,(H2O)越小
(3)弱盐促进水的电离,酸碱性越强,(H2O)越大
4.稀释过程中c(H+)水的变化
(1)酸碱溶液稀释过程中,c(H+)水变大
(2)弱盐溶液稀释过程中,c(H+)水变小
5.化学反应过程中c(H+)水的变化
(1)酸和碱反应过程中,恰好中和时,(H2O)最大
(2)强酸滴定弱酸盐过程中,c(H+)水变小
(3)强碱滴定弱碱盐过程中,c(H+)水变小
(4)水参与的电解反应,c(H+)水变大
6.水电离出的氢离子浓度和溶液pH的关系
(1)c(H+)水=10-aml·L-1,pH=a或14-a
①c(H+)水=10-5ml·L-1,pH=5或9
②c(H+)水=10-11ml·L-1,pH=11或3
(2)c(H+)水=10-7ml·L-1,该溶液对水的电离程度和抑制程度相同
①NH3·H2O和NH4Cl的混合物:溶液呈中性
②CH3COOH和CH3COONa的混合物:溶液呈中性
③NaOH和Na2CO3的混合液:溶液呈碱性
④NH4Cl和HCl的混合物:溶液呈碱性
(3)已知pH=a,则c(H+)水=10-aml·L-1或10a-14ml·L-1
①pH=2,c(H+)水=10-2ml·L-1(促进)或10-12ml·L-1(抑制)
②pH=11,c(H+)水=10-3ml·L-1(促进)或10-11ml·L-1(抑制)
知识点04 弱电解质的电离平衡
1.弱电解质的电离平衡
(1)弱酸H2A的电离:①H2AH++HA-△H<0;②HA-H++A2-△H<0
(2)弱碱氨水的电离:NH3·H2ONH4++OH-△H<0
(3)平衡移动:①温度:越稀越电离;②浓度:越热越电离
2.相同体积和浓度的盐酸和醋酸的比较
(1)c(H+):盐酸醋酸,溶液的pH醋酸的大,溶液的导电性盐酸的强,酸根离子的浓度盐酸的大
(2)与足量的其他物质反应:反应速率盐酸的快,消耗该物质的量一样多,反应结束所用的时间醋酸的长
3.相同体积和pH的盐酸和醋酸的比较
(1)溶液的浓度:盐酸醋酸,溶液的导电性一样的强,酸根离子的浓度一样的大
(2)与足量的其他物质反应
①反应速率:开始时一样快,过程中醋酸快
②消耗该物质的量醋酸多
③生成等量的某产物所用的时间盐酸的长
④反应结束所用的时间醋酸的长
知识点05 弱盐的水解平衡
1.弱盐的水解平衡
(1)弱盐Na2A的水解
①A2-+H2OHA-+OH-△H<0;②HA-+H2OH2A+OH-△H<0
(2)平衡移动:①温度:越稀越水解;②浓度:越热越水解
(3)配制易水解的盐溶液:加相应的稀酸或稀碱防水解
①Na2CO3溶液:加NaOH溶液
②(NH4)2SO4溶液:加稀硫酸或氨水
③Fe(NO3)3溶液:加稀硝酸
④Fe(NO3)2溶液:加不能加任何酸,以防亚铁离子被硝酸氧化
2.某些盐溶液蒸干后的产物
(1)挥发性酸的弱碱盐
①AlCl3Al(OH)3Al2O3
②Cu(NO3)2Cu(OH)2CuO
③AgNO3AgOHAg
(2)难挥发性酸的弱碱盐
①Fe2(SO4)3Fe2(SO4)3
②(NH4)2SO4(NH4)2SO4
(3)多元弱酸的强碱盐
①Na2CO3Na2CO3
②Na3PO4Na3PO4
(4)次氯酸盐
①NaClONaCl
②Ca(ClO)2CaCl2
(5)还原性的盐
①FeSO4Fe2(SO4)3
②Na2SO3Na2SO4
③Fe(NO3)2Fe(OH)2Fe(OH)3Fe2O3
(6)受热易分解的盐:直接考虑分解即可
①NaHCO3Na2CO3
②Ca(HCO3)2CaCO3CaO
③Mg(HCO3)2MgCO3Mg(OH)2MgO
④(NH4)2S无固体剩余
⑤NH4HCO3无固体剩余
⑥NH4Cl无固体剩余
3.促进盐类水解的应用
(1)热的纯碱液去油污效果好
①反应:CO32-+H2OHCO3-+OH-
②原因:加热,促进CO32-的水解,碱性增强,促进油脂的水解
(2)FeCl3、KAl(SO4)2·12H2O等可作净水剂
①反应:Fe3++3H2OFe(OH)3(胶体)+3H+
Al3++3H2OAl(OH)3(胶体)+3H+
②原因:胶体比表面积大,吸附性强,可起净水作用
(3)除去MgCl2溶液中的Fe3+
①方法:在加热搅拌条件下,加入足量除杂剂后过滤
②除杂剂:MgO、MgCO3或Mg(OH)2
(4)制备Fe(OH)3胶体
①方法:向沸水中滴加饱和FeCl3溶液,至液体呈透明的红褐色停止加热
②反应:Fe3++3H2OFe(OH)3(胶体)+3H+
(5)某些活泼金属与强酸弱碱盐溶液混合
①现象:有气泡产生
②原因:活泼金属与盐水解出的H+发生置换反应生成H2
③实例:Mg放入NH4Cl、CuCl2、FeCl3溶液中产生氢气
(6)泡沫灭火器原理
①药品:NaHCO3溶液和Al2(SO4)3溶液
②原理:酸碱性相反的盐溶液发生水解相互促进反应
③反应:3HCO3-+Al3+=Al(OH)3↓+3CO2↑
(7)普钙[Ca(H2PO4)2]、铵态氮肥不能与草木灰(K2CO3)混用
①原理:K2CO3水解显碱性:CO32-+H2OHCO3-+OH-
②肥效降低反应
3Ca(H2PO4)2+12OH-=Ca3(PO4)2↓+12H2O+4PO43-
NH4+ +OH-=NH3↑+H2O
(7)NH4Cl用于金属除锈
①水解反应:NH4++H2ONH3·H2O+H+,铁锈与H+反应
②除锈反应:Fe2O3+6H+2Fe3++3H2O
4.抑制盐类水解的应用
(1)配制易水解的盐溶液:加相应的酸或碱防水解
①配制FeCl3溶液时加入少量稀盐酸,防止铁离子水解
②配制CuSO4溶液时加入少量稀硫酸,防止铜离子水解
③配制醋酸钠溶液时加入少量氢氧化钠,防止醋酸根离子水解
(2)加热金属氯化物的结晶水合物制纯的无水物
①措施:在干燥的HCl气流中加热脱水
②反应:MClm·xH2OMClm+xH2O
③装置
5.盐类水解在药品保存中的应用
(1)盛放Na2CO3溶液不能用带玻璃塞的试剂瓶
①水解反应:CO32-+H2OHCO3-+OH-
②腐蚀反应:SiO2+2NaOHNa2SiO3+H2O
(2)盛放NaF溶液不能用玻璃试剂瓶
①水解反应:F-+H2OHF+OH-
②腐蚀反应:SiO2+4HFSiF4↑+2H2O
知识点06 沉淀溶解平衡
1.三种溶解平衡
(1)沉淀溶解平衡
①适用范围:难溶性固体溶质的饱和溶液
②平衡举例:AmBn(s)mAn+(aq)+nBm-(aq)
③平衡移动:浓度:越稀越溶解;温度:越热越溶解(一般)
(2)结晶溶解平衡
①适用范围:可溶性固体溶质的饱和溶液
②平衡举例:KNO3(s)K+(aq)+NO3-(aq)
③平衡移动:适用平衡移动原理
(3)气体溶解平衡
①适用范围:气体溶质的饱和溶液
②平衡举例:O2(g)O2(aq)△H>0
③平衡移动:温度越低越溶解,压强越大越溶解
2.沉淀的生成
(1)本质原因:Q>Ksp
(2)分步沉淀原理
①实验前提:被沉淀的离子浓度必须相同
②反应规律:混合液中滴加沉淀剂,优先生成溶解度小的沉淀
3.沉淀的转化
(1)实质:沉淀溶解平衡的正向移动
(2)基本规律
①一般来说,溶解度大→溶解度小
②沉淀的溶解度差别越大,越容易转化
(3)特殊规律:溶解度小的也可能转化为溶解度大的沉淀
①内在条件:Ksp相差不大,一般相差1~2个数量级
②外在条件:控制离子浓度(加浓溶液、可溶性固体),使Q>Ksp
(4)银盐转化:AgCl→AgBr→AgI→Ag2S
①现象:白色沉淀→浅黄色沉淀→黄色沉淀→黑色沉淀
②原因:这四种沉淀的溶解度越来越小
(6)实验设计:两种沉淀所含的共同离子的量要少
①少量AgNO3溶液AgClAgBr
②少量NaOH溶液Mg(OH)2Fe(OH)3
知识点07 溶液中的三大平衡移动
1.外加物质对溶液中离子平衡移动的影响
(1)本质依据:离子方程式
①FeCl3+3KSCNFe(SCN)3+3KCl(加少量KCl固体):不移动
②CuSO4+2H2OCu(OH)2+H2SO4(加少量BaCl2固体):不移动
(2)若和电离出的离子不反应,则还需要考虑所加物质是否能水解
①NH3·H2ONH4++OH-(加少量MgCl2固体):正向移动
②NH3·H2ONH4++OH-(加少量Na2CO3固体):逆向移动
(3)加入××溶液时,还需要考虑到稀释效应
①NH3·H2ONH4++OH-(加少量NaCl固体):不移动
②NH3·H2ONH4++OH-(加少量NaCl溶液):正向移动
(4)若所加离子的浓度与原溶液中的相同,则平衡不移动,平衡中其他微粒浓度减小
(5)反应顺序
①非氧化还原反应:一般优先和电离出的离子反应
②氧化还原反应:一般优先和浓度大的氧化性或还原性微粒反应
③H2SH++HS-(加少量NaOH溶液):正向移动
④H2SH++HS-(通少量Cl2):逆向移动
2.加水稀释溶液过程中各量的变化
(1)移动方向:加水平衡向可溶性物质系数和大的方向移动
①电离、水解、溶解平衡正向移动
②电离程度、水解程度、溶解程度增大,溶解的量增多,溶解度不变
(1)可溶性反应物微粒数目和浓度都增大
(2)生成物微粒数目增多,生成物微粒浓度:
①浓溶液或纯液体:先增大后减小
②稀溶液:减小
(3)溶液中c(H+)和c(OH-)的变化趋势相反
①酸性溶液:加水稀释,c(H+)减小,c(OH-)增大
②碱性溶液:加水稀释,c(H+)增大,c(OH-)减小
(4)相同pH的两种电解质溶液,加水稀释相同的倍数,存在平衡的物质(弱酸、弱碱、弱盐)的pH变化小
①强酸(碱),加水稀释10n倍,pH变化n个单位
②弱酸(碱),加水稀释10n倍,pH变化小于n个单位
③溶液无限稀释,pH无限接近于7
知识点08 溶液pH的计算及判断
1.计算公式
(1)pH=-lgc(H+),c(H+)=10-pH
(2)pOH=-lgc(OH-),c(OH-)=10-pOH
(3)pH+pOH=pKw=14(25℃)=12(100℃)
2.计算原则:酸算pH,碱算pOH
3.忽略原则:a≥100b,a±b≈a
4.中和的本质:n(H+)=n(OH-)
5.酸碱反应恰好呈中性的含义
(1)中性的本质
①c(H+)=c(OH-);②c(H+)=;③pH=pOH
(2)氨水和盐酸反应:NH4Cl和少量NH3·H2O的混合物
(3)醋酸和烧碱反应:CH3COONa和少量CH3COOH的混合物
知识点09 溶液中各类平衡常数
1.水的电离平衡常数和水的离子积常数
(1)水的电离平衡常数:K电离=
(2)水的离子积常数
①表达式:Kw=c(H+)×c(OH-)
②Kw与K电离的关系:Kw=K电离×c(H2O)
(3)常用数据:25℃:Kw=1.0×10-14,100℃:Kw=1.0×10-12
2.弱电解质的电离常数
(1)弱酸H2A的电离常数:Ka1Ka2
①一级电离:H2AH++HA-,Ka1=
②二级电离:HA-H++A2-,Ka2=
③一步电离:H2A2H++A2-,Ka==Ka1×Ka2
(2)意义:在同温度同浓度时,Ka越大,酸的酸性越强
3.弱盐的水解常数
(1)弱盐Na2A的水解常数:Kh1Kh2
①一级水解:A2-+H2OHA-+OH-:Kh1=
②而级水解:HA-+H2OH2A+OH-:Kh2=
③一步水解:A2-+2H2OH2A+2OH-,Kh==Kh1×Kh2
(2)意义:在同温同浓度时,Kh越大,盐的水解程度越大
4.溶度积常数
(1)反应:AmBn(s)mAn+(aq)+nBm-(aq)
(2)表达式:Ksp(AmBn)=cm(An+)×cn(Bm-)
(3)溶度积常数和溶解度的关系x=ml/L
①阴阳离子个数比相同:Ksp小,溶解度小
②阴阳离子个数比不同:Ksp小,溶解度不一定小
③大小比较:将Ksp开离子个数次方,比较数量级即可
(4)沉淀转化的平衡常数
①方程式:MX(s)+Y-(aq)MY(s)+X-(aq)
②表达式:K==
5.电离常数K电离和水解常数K水解的关系
(1)总体关系:K电离·K水解=Kw
(2)二元弱酸:Ka1·Kh2=Kw,Ka2·Kh1=Kw
(3)三元弱酸:Ka1·Kh3=Kw,Ka2·Kh2=Kw,Ka3·Kh1=Kw
6.根据电离常数判断溶液的酸碱性
(1)弱酸(碱)与其相应盐(1∶1)混合:比较Ka或Kb与Kh的相对大小
①HA+NaA(Ka=10-3),Kh=10-11,溶液呈酸性
②HB+NaB(Ka=10-10),Kh=10-4,溶液呈碱性
③ROH+RCl(Kb=10-8),Kh=10-6,溶液呈酸性
④MOH+MCl(Kb=10-5),Kh=10-9,溶液呈碱性
(2)弱酸的酸式盐:比较水解程度(Kh2)和电离程度(Ka2)的相对大小
①NaHA(Ka1=10-3,Ka2=10-8),Kh2=10-11,溶液呈酸性
②NaHB(Ka1=10-5,Ka2=10-10),Kh2=10-9,溶液呈碱性
(3)弱酸弱碱盐:比较Kh阳和Kh阴的相对大小
①MA(Ka=10-3,Kb=10-8),Kh阳=10-6,Kh阴=10-11,溶液呈酸性
②MB(Ka=10-9,Kb=10-4),Kh阳=10-10,Kh阴=10-5,溶液呈碱性
③MC((Ka=10-5,Kb=10-5),Kh阳=10-9,Kh阴=10-9,溶液呈中性
7.根据电离常数判断复分解反应的产物或方程式
(1)适用范围:复分解反应(经验规律)
①基本规律:强酸制弱酸,强碱制弱碱
②特殊情况:弱酸制强酸,弱碱制强碱
CuSO4+H2SCuS↓+H2SO4
NaI+H3PO4(浓)NaH2PO4+HI↑
2HClO2HCl+O2↑
(2)通式:弱酸盐+强酸→强酸盐+弱酸
(3)必须同时满足:强酸制弱酸,强碱制弱碱,产物不能反应
(4)判断反应的产物
①酸的酸性:CH3COOH>H2CO3>HClO>HCO3-
②盐的碱性:CH3COO-<HCO3-<ClO-<CO32-
③向NaClO溶液中通入少量CO2的反应:NaClO+CO2+H2O→HClO+NaHCO3
(5)判断反应的产物
①向NaX溶液中通入少量CO2:NaX+CO2+H2O=HX+NaHCO3
②向NaY溶液中通入少量CO2:2NaY+CO2+H2O=2HY+Na2CO3
③HX、HY、H2CO3的酸性强弱:H2CO3>HX>HY
8.根据电离常数判断微粒能否反应
(1)酸的酸性:H3PO4>H2CO3>H2PO4->HCO3->HPO42-
(2)盐的碱性:H2PO4-<HCO3-<HPO42-<CO32-<PO43-
①PO43-与H3PO4、H2CO3、H2PO4-、HCO3-能反应
②CO32-与H3PO4、H2CO3、H2PO4-能反应
③HPO42-与H3PO4、H2CO3能反应
④HCO3-与H3PO4能反应
⑤H3PO4与HCO3-、HPO42-、CO32-、PO43-能反应
⑥H2CO3与HPO42-、CO32-、PO43-能反应
⑦H2PO4-与CO32-、PO43-能反应
⑧HCO3-与PO43-能反应
知识点10 溶液中各类平衡常数的相关计算
1.水解常数和电离常数的计算
(1)基本方法:三段式,注意溶液体积的变化
①根据电离或水解方程式,写出电离或水解平衡常数表达式
②根据条件找出相关数据代入求解
(2)混合液中电离或水解常数的计算步骤
①根据溶液的pH计算c(H+)或c(OH-)
②根据电荷守恒求离子浓度
③根据物料守恒求分子浓度
④将所得数据代入平衡常数表达式计算
(3)忽略原则
①a≥100b,a±b≈a
②一般用弱电解质的起始浓度代替平衡浓度计算
(4)图像类计算:注意起点、终点、交点、最高点、最低点等特殊点
①起点:根据起点的浓度和pH计算
②无限加料点:根据所加物质的浓度和pH计算
③交点:某些微粒浓度相等,能够简化计算
④极限点:恰好中和点,根据混合后盐的浓度和pH计算水解常数
2.沉淀溶解平衡的计算
(1)将有关数据代入Ksp表达式计算
①注意溶液体积是否变化,浓度为混合后离子的浓度
②开始沉淀:一般认为该离子浓度不变
③完全沉淀:一般认为该离子浓度≤10-5ml·L—1
(2)计算金属阳离子开始沉淀和完全沉淀的pH
①计算依据:Ksp[M(OH)n]=c(Mn+)·c(OH-)n
②计算方法:先求pOH,再求pH
(3)计算完全沉淀的离子的平衡浓度
①根据方程式计算过量物质中剩余离子的浓度
②根据Ksp表达式计算完全反应的离子的浓度
③将0.018ml·L-1的AgNO3和0.020ml·L-1盐酸等体积混合
(4)An+和Bm-两种离子恰好完全沉淀(AmBn)
①溶液中的离子浓度满足化学式中的计量关系:=
②设沉淀的溶解度为x ml/L,则c(An+)=mx ml/L,c(Bm-)=nx ml/L
③根据Ksp=(mx)m·(nx)n计算x
易错点01: 判断HA为一元弱酸的两种常用方法
易错点02 水的电离常见易错点
(1)在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)一定相等
(2)酸、碱能抑制水的电离,故室温下,酸、碱溶液中水电离产生的c(H+)<1×10-7 ml·L-1,而能水解的盐溶液中水电离产生的c(H+)[或c(OH-)]>1×10-7 ml·L-1
(3)室温下,由水电离出的c水(H+)或c水(OH-)<10-7 ml·L-1时,可能是加酸或加碱抑制了水的电离
(4)给水加热,水的电离程度增大,c(H+)>10-7 ml·L-1,pH<7,但水仍显中性
易错点03 盐类水解常见易错点
(1)“越弱越水解”指的是盐对应的酸(或碱)越弱,水解程度越大,溶液的碱性(或酸性)越强,若酸性HA>HB,那么相同浓度的NaA和NaB溶液,后者的碱性强
如:CH3COOH的酸性比HClO的酸性强,则相同浓度时,CH3COO-的水解程度比ClO-小,后者的碱性强
(2)盐类发生水解反应后,其水溶液往往呈酸性或碱性, 但也有特殊情况,如CH3COONH4溶液呈中性
(3)能发生相互促进的水解反应的盐溶液的酸碱性,取决于弱酸、弱碱的相对强弱,如NH4F溶液呈酸性,是因HF的电离常数大于NH3·H2O的电离常数
【典例01】(2023·北京卷)下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和溶液制备胶体
【答案】B
【解析】A.热的纯碱溶液因碳酸根离子水解显碱性,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A不符合题意;B.重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B符合题意;C.蛋白质在酶的作用下可以发生水解反应生成氨基酸,C不符合题意;D. Fe3+能发生水解反应生成 Fe(OH)3,加热能增大Fe3+ 的水解程度,D不符合题意;故选B。
【典例02】(2023·辽宁卷)某小组进行实验,向蒸馏水中加入,充分振荡,溶液呈浅棕色,再加入锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知为棕色,下列关于颜色变化的解释错误的是
【答案】D
【解析】A.向10mL蒸馏水中加入0.4gI2,充分振荡,溶液呈浅棕色,说明I2的浓度较小,因为I2在水中溶解度较小,A项正确;B.已知(aq)为棕色,加入0.2g锌粒后,Zn与I2反应生成ZnI2,生成的I-与I2发生反应I-+I2⇌,生成使溶液颜色加深,B项正确;C.I2在水中存在溶解平衡I2(s)⇌I2(aq),Zn与I2反应生成的I-与I2(aq)反应生成,I2(aq)浓度减小,上述溶解平衡向右移动,紫黑色晶体消失,C项正确;D.最终溶液褪色是Zn与有色物质发生了化合反应,不是置换反应,D项错误;答案选D。
【典例03】2(2023·全国甲卷)下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
A.由点可求得
B.时的溶解度为
C.浓度均为的和可通过分步沉淀进行分离
D.混合溶液中时二者不会同时沉淀
【答案】C
【解析】A.由点a(2,2.5)可知,此时pH=2,pOH=12,则===,故A错误;B.由点(5,6)可知,此时pH=5,pOH=9,则===,时的溶解度为=10-3,故B错误;C.由图可知,当铁离子完全沉淀时,铝离子尚未开始沉淀,可通过调节溶液pH的方法分步沉淀和,故C正确;D.由图可知,沉淀完全时,,pM5,此时pH约为4.7,在此pH下刚开始沉淀的浓度为,而题中>,则会同时沉淀,故D错误;答案选C。
【典例04】常温下,浓度均为0.10 ml·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lgeq \f(V,V0)的变化如图所示。下列叙述正确的是( )
A.MOH的电离程度:c点大于d点
B.ROH溶液由a点到b点时,eq \f(c(R+),c(ROH)·c(H+))变大
C.pH=10时,MOH和ROH溶液中,c(M+)>c(R+)
D.lgeq \f(V,V0)=2时,MOH和ROH两种溶液中,水电离的c(OH-)的比值是1∶10
【答案】D。
【解析】由图示可以看出MOH为强碱,强电解质不存在电离平衡,所以c点与d点电离程度相同,A错误;ROH溶液由a点到b点时,eq \f(c(R+),c(ROH)·c(H+))可变式为eq \f(c(R+)·c(OH-),c(ROH)·c(H+)·c(OH-))=eq \f(Kb,KW),而这个数值仅与温度有关,B错误;C.MOH和ROH溶液中,电荷守恒为c(OH-)=c(H+)+c(M+),c(OH-)=c(H+)+c(R+),因为两溶液中氢离子浓度相同,所以c(R+)=c(M+),故C错误;根据A知,碱性MOH>ROH,当lgeq \f(V,V0)=2时,MOH和ROH两种溶液中对应的pH分别为11、10,而这里的氢离子浓度均是水电离产生的,故水电离的c(OH-)的比值是1∶10,D正确。
知识点01 强电解质和弱电解质
知识点03 水的电离平衡
知识点05 弱盐的水解平衡
知识点07 溶液中的三大平衡移动
知识点09溶液中各类平衡常数
知识点02 电解质溶液中的方程式
知识点04 弱电解质的电离平衡
知识点06 沉淀溶解平衡
知识点08溶液pH的计算及判断
知识点10 溶液中各类平衡常数的相关计算
弱酸
CH3COOH
HClO
H2CO3
电离常数
1.8×l0-5
3.0×l0-8
K1=4.3×l0-7
K2=5.6×l0-11
酸
电离常数
H2CO3
Ka1=4.3×10-7,Ka2=5.6×10-11
H3PO4
Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13
已知
Ksp(AgCl)=1.8×10-10
计算
混合后溶液中c(Ag+)=_____ml·L-1
实验方法
结论
= 1 \* GB3 ①测0.01 ml·L-1 HA溶液的pH
pH=2,HA为强酸;pH>2,HA为弱酸
= 2 \* GB3 ②室温下测NaA溶液的pH
pH=7,HA为强酸;pH>7,HA为弱酸
= 3 \* GB3 ③相同条件下,测相同浓度的HA溶液和盐酸(强酸)的导电性
若导电性相同,则HA为强酸;
若导电性较盐酸弱,则HA为弱酸
= 4 \* GB3 ④测定同pH的HA与HCl溶液稀释相同倍数后的pH变化
若ΔpH(HA)=ΔpH(HCl),HA是强酸;
若ΔpH(HA)<ΔpH(HCl),HA是弱酸
= 5 \* GB3 ⑤测定等体积、等pH的HA溶液和盐酸分别中和NaOH的量
若消耗NaOH的量相同,则HA为强酸;
若HA溶液消耗NaOH的量较盐酸多,则HA为弱酸
= 6 \* GB3 \* MERGEFORMAT ⑥往同浓度的HA和HCl中投入相同的Zn粒
开始反应速率快的为强酸;开始反应速率慢的为弱酸
= 7 \* GB3 \* MERGEFORMAT ⑦从升高温度后pH的变化判断
若升高温度,溶液的pH明显减小,则是弱酸;
若升高温度,溶液的pH变化幅度小,则是强酸
选项
颜色变化
解释
A
溶液呈浅棕色
在水中溶解度较小
B
溶液颜色加深
发生了反应:
C
紫黑色晶体消失
()的消耗使溶解平衡右移
D
溶液褪色
与有色物质发生了置换反应
【讲通练透】高考化学知识清单17 晶体结构与性质(思维导图+知识解读+易混易错+典例分析): 这是一份【讲通练透】高考化学知识清单17 晶体结构与性质(思维导图+知识解读+易混易错+典例分析),共19页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。
【讲通练透】高考化学知识清单16 分子结构与性质(思维导图+知识解读+易混易错+典例分析): 这是一份【讲通练透】高考化学知识清单16 分子结构与性质(思维导图+知识解读+易混易错+典例分析),共22页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。
【讲通练透】高考化学知识清单15 原子结构与性质(思维导图+知识解读+易混易错+典例分析): 这是一份【讲通练透】高考化学知识清单15 原子结构与性质(思维导图+知识解读+易混易错+典例分析),共15页。试卷主要包含了研究考试大纲,循纲务本,精练高考真题,明确方向,摸清问题所在,对症下药,切实回归基础,提高能力等内容,欢迎下载使用。