






第23讲 电解池 金属的腐蚀与防护(课件)-2024年高考化学一轮复习(新教材新高考)
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
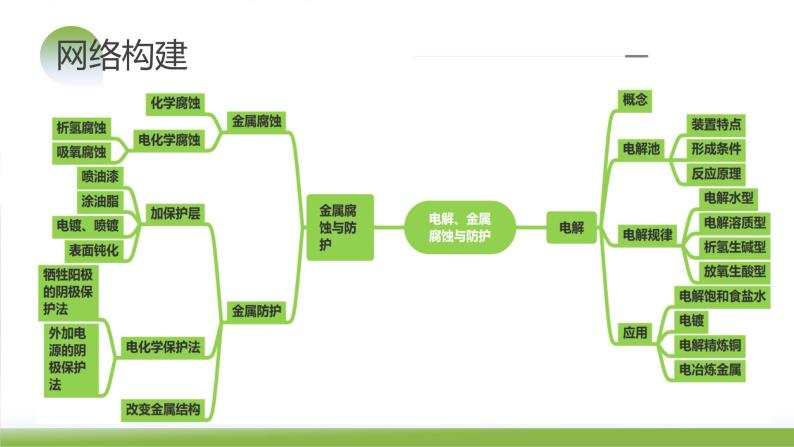
第23讲 电解池 金属的腐蚀与防护
知识梳理 题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
1.电解:在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
2.电解池:电能转化为化学能的装置。
知识点1 电解和电解池
①有与电源相连的两个电极。
②电解质溶液(或熔融电解质)。
1.电极名称及电极反应式(电解CuCl2溶液为例)
知识点2 电解池的工作原理
2.电解过程的三个流向
①电子流向:电源负极→电解池阴极;电解池的阳极→电源的正极;
②离子流向:阳离子→电解池的阴极,阴离子→电解池的阳极。
③电流方向:电源正极→电解池阳极→电解质溶液→阴极→负极。
②惰性电极(Pt、Au、石墨),要依据阴离子的放电顺序加以判断。
阴离子的放电顺序:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子>F-。
S2-、I-、Br-、Cl-放电,产物分别是S、I2、Br2、Cl2;若OH-放电,则得到H2O和O2。
①活性电极(除Au、Pt以外的金属材料作电极),电极材料失电子,生成金属阳离子。
阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+。
①若金属阳离子(Fe3+除外)放电,则得到相应金属单质;若H+放电,则得到H2。
②放电顺序本质遵循氧化还原反应的优先规律,即得(失)电子能力强的离子先放电。
直接根据阳离子放电顺序进行判断。
4.电极反应式、电解方程式的书写
(3)然后排出阴、阳两极的放电顺序。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴离子、阳离子两组(不要忘记水溶液中的H+和OH-)。
(5)最后写出电解反应的总化学方程式或离子方程式,并注明“电解”条件。
②阳极材料不同,电极产物、电极反应式可能不同,最常用、最重要的放电顺序为阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。
③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电,注意离子导体(电解质)是水溶液还是非水状态。
④书写电解池中的电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
⑤电解质溶液中未参与放电的离子是否与放电后生成的离子发生反应(离子共存)。
⑥要确保两极电子转移数目相同,且注明条件“电解”。
5.阴、阳极的判断方法
(2)根据电流方向:从阴极流出,从阳极流入。
(3)根据电子流向:从阳极流出,从阴极流入。
(1)根据外接电源:正极接阳极,负极接阴极。
(4)根据离子移向:阴离子移向阳极,阳离子移向阴极。
(5)根据电极产物:阳极——电极溶解、逸出O2(或阳极区酸性增强)或Cl2;阴极——析出金属、逸出H2(或阴极区碱性增强)。
(6)根据反应类型:阳极发生氧化反应,阴极发生还原反应。
知识点3 惰性电极电解规律
3.电解溶质和溶剂水型,生成H2和碱(析氢生碱型):
4.电解溶质和溶剂水型,生成O2和酸(放氧生酸型)
1.计算依据——三个相等
知识点4 电化学有关计算
(2)同一电解池的阴极、阳极电极反应中得、失电子数相等。
(3)串联电路中的各个电极反应得、失电子数相等。
(1)同一原电池的正、负极的电极反应得、失电子数相等。
上述三种情况下,在写电极反应式时,得、失电子数要相等,在计算电解产物的量时,应按得、失电子数相等计算。
2.计算方法——三种常用方法
(2)根据电子守恒计算
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
(1)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
②用于混合溶液中分阶段电解的计算。
根据得失电子守恒定律建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
如以通过4mle-为桥梁可构建如下关系式:
该关系式具有总揽电化学计算的作用和价值,熟记电极反应,灵活运用关系式便能快速解答常见的电化学计算问题。
提示:在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19C来计算电路中通过的电量。
考向1 考查电解的原理
考向2 考查电解的相关计算
2.氯碱工业制烧碱、氢气和氯气图解
【易错提醒】粗食盐水中的Ca2+、Mg2+、SO42-在电解时会生成沉淀堵塞离子交换膜而达不到电解的目的。精制时可通过依次加入BaCl2、NaOH、Na2CO3溶液过滤,最后再加适量盐酸的方法除去粗盐中的杂质离子。
知识点2 电镀铜与电解精炼铜
【易错提醒】(1)电镀过程中,溶液中离子浓度不变;
(2)电解精炼铜时,阳极质量减小,阴极质量增加,溶液中的Cu2+浓度减小。粗铜中不活泼的杂质(金属活动性顺序中位于铜之后的银、金等),在阳极难以失去电子,当阳极上的铜失去电子变成离子之后,它们以金属单质的形式沉积于电解槽的底部,成为阳极泥。
知识点3 电冶金
【易错提醒】(1)电解熔融MgCl2冶炼镁,而不能电解MgO冶炼镁,是因为MgO的熔点很高;
(2)电解熔融Al2O3冶炼铝,而不能电解AlCl3冶炼铝,是因为AlCl3是共价化合物,其熔融态不导电;为降低熔点,加入了助熔剂冰晶石(Na3AlF6);电解过程中,阳极生成的氧气与石墨电极反应,所以石墨电极需不断补充。
考向1 考查电解原理应用
考向2 考查电解法制备物质
1.金属腐蚀的概念:金属腐蚀是金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的本质:金属原子失去电子变为金属阳离子,金属发生氧化反应。
知识点1 金属腐蚀
(1)化学腐蚀与电化学腐蚀
(2)析氢腐蚀与吸氧腐蚀(以钢铁的腐蚀为例):
【特别提醒】钢铁暴露在潮湿空气中主要发生的是吸氧腐蚀,铁锈的形成过程中主要发生的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O(铁锈)+(3-x)H2O。
4.金属腐蚀快慢的一般规律
(1)在同一电解质溶液中,金属腐蚀的速率快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)在原电池中,电解质溶液相同时,两极的活泼性差别越大,负极金属越易被腐蚀,如Zn—Cu(H2SO4)中的Zn比Zn—Fe(H2SO4)中的Zn腐蚀快。
(3)对由相同正、负极构成的原电池(如Fe—Cu原电池)
①电解质的氧化能力越强,负极金属越易被腐蚀。如:Fe在不同电解质溶液中的腐蚀速率是CuSO4溶液>稀H2SO4>NaCl溶液。
②电解质中起氧化作用的离子相同时,该离子浓度越大,负极金属腐蚀速率越快。如腐蚀速率:1 ml·L-1盐酸>0.1 ml·L-1盐酸>0.1 ml·L-1醋酸>海水(起氧化作用的H+浓度逐渐减小)。
③溶液的导电能力越强,负极金属越易被腐蚀。如腐蚀速率:海水>淡水>酒精。
(4)一般情况下不纯的金属或合金在潮湿的空气中腐蚀的速率远快于在干燥、隔绝空气条件下的腐蚀速率。
1.金属的防护考虑的因素
金属的防护主要是从金属、与金属接触的物质及两者反应的条件等方面来考虑的。
知识点2 金属的防护
①牺牲阳极的阴极保护法——原电池原理,通常是在被保护的钢铁设备上安装锌块。
a.负极:比被保护金属活泼的金属;
b.正极:被保护的金属设备。
锌比铁活泼,发生腐蚀时作为原电池的负极,不断遭受腐蚀,而作为正极的钢铁设备被保护起来。
②外加电流的阴极保护法——电解原理,把被保护的钢铁设备(如钢闸门)作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液(如海水)里,外接直流电源,通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀速率降至零或接近零,钢铁设备被迫成为阴极而受到保护。
a.阴极:被保护的金属设备;
b.阳极:惰性金属或石墨。
(2)改变金属的内部结构,在金属中添加其他金属或非金属可以制成性能优异的合金,如制成合金、不锈钢等。
(3)在金属表面覆盖保护层,在金属表面覆盖致密的保护层,将金属制品与周围物质隔开是一种普遍采用的防护方法,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
(2)金属腐蚀时,电化学腐蚀与化学腐蚀往往同时存在,但前者更普遍,危害也更严重。
(1)钢铁发生电化学腐蚀时,负极铁去电子生成Fe2+,而不是生成Fe3+。
(3)铜暴露在潮湿的空气中发生的是化学腐蚀,而不是电化学腐蚀,生成铜绿的化学成分是Cu2(OH)2CO3。
(4)两种保护方法的比较:外加电流的阴极保护法比牺牲阳极的阴极保护法保护效果好。
(5)金属越活泼,就越容易失去电子而被腐蚀,金属活动顺序表中位于氢前面和氢后面的金属都能发生吸氧腐蚀,但只有在金属活动顺序表中氢前面的金属才可能发生析氢腐蚀。
考向1 考查金属腐蚀的原理与探究
考向2 考查金属的防护
例2.(2023·湖南衡阳·校联考三模)鎏金兽面纹鼎是湖南省博物馆收藏的珍贵文物。该文物为青铜器,其形制和纹饰与商代铜鼎相同。鎏金又称火法镀金,其工艺是将黄金溶于汞中形成的金汞齐均匀地涂到干净的金属器物表面,加热使汞挥发,黄金与金属表面固结,形成光亮的金黄色镀层。下列说法正确的是A.青铜比纯铜硬度小B.常温下的金汞齐是金属晶体C.鎏金兽面纹鼎应保存在干燥的环境中D.铜腐蚀后生成的铜绿为CuO
1.离子交换膜含义:离子交换膜又叫隔膜,由高分子特殊材料制成。使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。
知识点1 电化学中的隔膜
(1)能将两极区隔离,阻止两极区产生的物质接触,防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素。如在电解饱和食盐水中,利用阳离子交换膜,防止阳极产生的氯气进入阴极室与氢氧化钠反应,导致所制产品不纯;防止氯气与阴极产生的氢气混合发生爆炸。
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
(3)双极膜:由一张阳膜和一张阴膜复合制成的阴、阳复合膜。该膜的特点是在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-并分别通过阳膜和阴膜,作为H+和OH-的离子源。
(4)用于物质的制备、分离、提纯等。
(1)阳离子交换膜 (只允许阳离子和水分子通过,阻止阴离子和气体通过)
(2)阴离子交换膜 (只允许阴离子和水分子通过,阻止阳离子和气体通过)
(3)质子交换膜 (只允许H+和水分子通过)
4.离子交换膜选择的依据:离子的定向移动。
5.离子交换膜类型的判断(根据电解质溶液呈中性的原则,判断交换膜的类型)
(1)首先写出阴、阳两极上的电极反应,依据电极反应确定该电极附近哪种离子剩余。
(2)根据溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型。
如电解饱和食盐水时,阴极反应为2H++2e-=H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,与OH-形成NaOH溶液,故电解食盐水时的离子交换膜是阳离子交换膜。
6.“离子交换膜”电解池的解题思路
(1)分清隔膜类型:即交换膜属于阳膜、阴膜或质子膜中的哪一种,判断允许哪种离子通过隔膜;
(2)写出电极反应式:判断交换膜两侧离子变化,推断电荷变化,据电荷平衡判断离子迁移方向;
(3)分析隔膜作用:在产品制备中,隔膜作用主要是提高产品纯度,避免产物之间发生反应,或避免产物因发生反应而造成危险;
(4)利用定量关系进行计算:外电路电子转移数=通过隔膜的阴、阳离子带的负或正电荷数。
知识点2 隔膜在多室电解池中的应用
多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
①制备原理:如工业上利用如图两室电解装置制备烧碱
阳极室中电极反应:2Cl--2e-=Cl2↑,阴极室中的电极反应:2H2O+2e-=H2↑+2OH-,阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本没有杂质。
②阳离子交换膜的作用:它只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过。这样既防止了两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
利用三室电解装置制备NH4NO3,其工作原理如图所示。
利用“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示。
电解稀硫酸的阳极反应:2H2O-4e-=O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO2-穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应:4H2O+4e-=2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室。
考向1 考查离子交换膜在原电池中的应用
考向2 考查离子交换膜在电解池中的应用
4.(2022·广东·高考真题)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化3%NaCl的溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是A.加入AgNO3溶液产生沉淀B.加入淀粉碘化钾溶液无蓝色出现C.加入KSCN溶液无红色出现D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
第42讲 电解池 金属的腐蚀与防护-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第42讲 电解池 金属的腐蚀与防护-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。
新高考化学一轮复习精品课件 第7章 第42讲 电解池 金属的腐蚀与防护 (含解析): 这是一份新高考化学一轮复习精品课件 第7章 第42讲 电解池 金属的腐蚀与防护 (含解析),共60页。PPT课件主要包含了电解池及工作原理,必备知识,关键能力,电解原理的应用,金属的腐蚀与防护,应用举例,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第6章 第38讲 电解池 金属的腐蚀与防护: 这是一份2024年高考化学一轮复习课件(鲁科版)第6章 第38讲 电解池 金属的腐蚀与防护,文件包含第6章第38讲电解池金属的腐蚀与防护pptx、第6章第38练电解池金属的腐蚀与防护docx、第6章第38讲电解池金属的腐蚀与防护docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












