



新高考化学复习讲义+练习 第01讲 物质的量 气体摩尔体积(讲义+练习)(原卷版+解析)
展开考情分析
网络构建
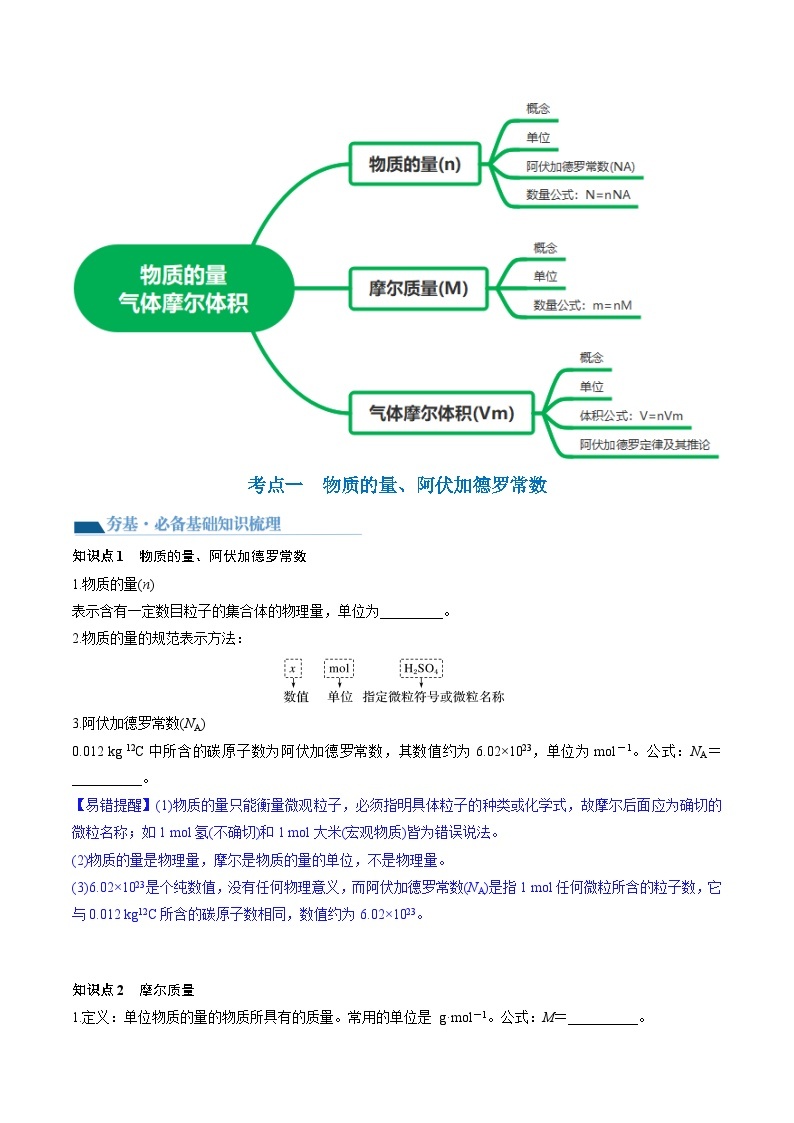
考点一 物质的量 摩尔质量
【夯基·必备基础知识梳理】
知识点1 物质的量、阿伏加德罗常数
知识点2 摩尔质量
【提升·必考题型归纳】
考向1 考查有关“物质的量”概念理解与辨析
考向2 物质的量、质量、微粒数之间的关系
考点二 气体摩尔体积 阿伏加德罗定律
【夯基·必备基础知识梳理】
知识点1 影响物质体积的因素
知识点2 气体摩尔体积
知识点3 阿伏加德罗定律及其推论
【提升·必考题型归纳】
考向1 考查气体摩尔体积
考向2 考查阿伏加德罗定律及应用
考向3 考查气体摩尔质量计算的常用方法
真题感悟
考点一 物质的量、阿伏加德罗常数
知识点1 物质的量、阿伏加德罗常数
1.物质的量(n)
表示含有一定数目粒子的集合体的物理量,单位为_________。
2.物质的量的规范表示方法:
3.阿伏加德罗常数(NA)
0.012 kg 12C中所含的碳原子数为阿伏加德罗常数,其数值约为6.02×1023,单位为ml-1。公式:NA=__________。
【易错提醒】(1)物质的量只能衡量微观粒子,必须指明具体粒子的种类或化学式,故摩尔后面应为确切的微粒名称;如1 ml氢(不确切)和1 ml大米(宏观物质)皆为错误说法。
(2)物质的量是物理量,摩尔是物质的量的单位,不是物理量。
(3)6.02×1023是个纯数值,没有任何物理意义,而阿伏加德罗常数(NA)是指1 ml任何微粒所含的粒子数,它与0.012 kg12C所含的碳原子数相同,数值约为6.02×1023。
知识点2 摩尔质量
1.定义:单位物质的量的物质所具有的质量。常用的单位是 g·ml-1。公式:M=__________。
2.数值:以 g·ml-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。
【易错提醒】(1)摩尔质量、相对原子(或分子)质量的含义不同,不是同一个物理量。二者单位也不同,摩尔质量的单位是g·ml-1或kg·ml-1,相对原子(或分子)质量的单位为1,当摩尔质量以g·ml-1为单位时,二者在数值上相等。
(2)对具体的物质,其摩尔质量是确定的,不随物质的量的多少而变化,也不随物质的聚集状态而变化。
考向1 考查有关“物质的量”概念理解与辨析
例1.(2022·上海青浦·一模)下列对摩尔(ml)的有关说法中错误的是
A.摩尔是一个单位而非物理量
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1ml任何气体所含气体的分子数目都相等
D.0.5ml氦约含有1.204×1024个电子
【变式训练】下列有关叙述正确的是()
A.1 ml任何物质都含有6.02×1023个分子
B.硫酸的摩尔质量为98 g
C.2 ml H2O是1 ml H2O摩尔质量的2倍
D.摩尔是物质的量的单位
考向2 物质的量、质量、微粒数之间的关系
例2.下列叙述正确的是( )
A.24 g镁与27 g铝含有相同的质子数
B.等质量的氧气和臭氧,电子数相同
C.1 ml重水与1 ml水中,中子数比为2∶1
D.1 ml乙烷和1 ml乙烯,化学键数目相同
【变式训练】(1)某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值。
①该氯原子的相对原子质量为________;
②该氯原子的摩尔质量是________;
③m g该氯原子的物质的量为________;
④n g该氯原子所含的电子数为________。
(2)12.4 g Na2R含Na+ 0.4 ml,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
【思维建模】由已知物理量求物质所含的粒子数目的思维模型
(记住特殊物质中1 ml物质所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、—OH、OH-等)
考点二 气体摩尔体积 阿伏加德罗定律
知识点1 影响物质体积大小的因素
①粒子的大小(物质的本性);②粒子间距的大小(由温度与压强共同决定);③粒子的数目(物质的量的大小)。
知识点2 气体摩尔体积
(1)含义:单位物质的量的气体所占的体积,符号为Vm,标准状况下,Vm约为__________。
(2)常用单位:L/ml(或L·ml-1)。
(3)数值:在__________下(指温度为0℃,压强为101 kPa)约为22.4 L·ml-1。
(4)基本关系式:n=eq \f(V,Vm)=eq \f(m,M)=eq \f(N,NA)
(5)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的__________和__________强。
(6)适用对象:单一气体或互不反应的混合气体
【特别提醒】气体摩尔体积(22.4 L·ml-1)应用的“五大误区”
(1)使用“条件”是标准状况,即0 ℃、101 kPa,而不是常温、常压。
(2)使用对象必须是气体物质,可以是单一气体,也可以是混合气体。标准状况下不是气体而又常在题中出现的物质有:水、苯、SO3、HF、CCl4、己烷、CS2、CHCl3、Br2、乙醇等。
(3)标准状况下的气体摩尔体积约为22.4 L·ml-1,其他条件下Vm一般不是22.4 L·ml-1。
(4)22.4 L气体,在标准状况下的物质的量是1 ml,在非标准状况下,可能是1 ml,也可能不是1 ml。
(5)物质的质量、物质的量一定时,所含微粒数与物质处于何种条件无关。如常温常压下32 g O2所含的原子数目是2NA。注意不要形成定势思维,看到“常温常压”就排除选项。
知识点3 阿伏加德罗定律及其推论
(1)阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体,含有相同数目的粒子(或气体的物质的量相同)。
【名师提醒】可总结为:“三同”定“一同”,即__________、__________,__________的任何气体具有相同的分子数。
(2)阿伏加德罗定律的推论(以下用到的符号:ρ为密度,p为压强,n为物质的量,M为摩尔质量,m为质量,V为体积,T为热力学温度)
【方法技巧】
1、记忆方法:三正比、二反比、一连比。
2、应用阿伏加德罗定律推论时可通过pV=nRT及n=eq \f(m,M)、ρ=eq \f(m,V)导出。
考向1 气体摩尔体积
例1.CH4 与Cl2光照条件下充分反应生成一系列卤代烃,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4 L CHCl3含有的氯原子数为3NA
B.标准状况下,22.4 L Cl2完全反应后得到的HCl分子数为2NA
C.16 g CH4与足量Cl2充分反应后得到的卤代烃分子总数为NA
D.1 ml CH4和1 ml Cl2充分反应可以得到CH3Cl的分子数为NA
【变式训练】已知:①6.72 L NH3(标准状况下)②1.204×1023个H2S分子 ③5.6 g CH4④0.5 ml HCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.原子数目:③>①>②>④
C.密度大小:④>②>③>①
D.质量大小:④>②>③>①
考向2 阿伏加德罗定律及应用
例2.如图Ⅰ,将质量均为m g的O2和SO2气体分别充入两个相同体积的密闭容器甲、乙中,下列说法正确的是( )
图Ⅰ 图Ⅱ
A.甲、乙中所含的氧原子物质的量之比为1∶2
B.两者压强(p)与温度(T)的关系如图Ⅱ所示
C.甲、乙中气体质子数之比为1∶2
D.甲、乙中气体密度比为1∶2
【变式训练】三种气体X、Y、Z的相对分子质量关系为Mr(X)
B.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 ml
C.同温同压下,同质量的三种气体,气体密度最小的是Y
D.同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则压强比为4∶1
考向3 气体摩尔质量计算的常用方法
例3.按要求解答问题
(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为_______,可能是_______气体。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_______。
(3)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则
①混合气体在标准状况下的密度是_______g·L-1。
②混合气体的平均摩尔质量是_______ g·ml-1。
【变式训练】(2022·上海·模拟预测)打火机里装有液态的丙烷和丁烷。下列说法错误的是
A.打开打火机开关,分子间距变大
B.摩擦打火石,达到气体着火点
C.丙烷完全燃烧需要空气约为
D.若n(丙烷):n(丁烷),该混合物的摩尔质量为
1.(2023·上海·统考高考真题)常温常压下,下列物质的物理量种前者是后者两倍的是
A.28 g和28g中所含的中子数
B.2.24 L和2.24 L原子数
C.1ml和2ml的密度
D.0.1ml·L和0.1 ml·L 的
2.(2021·山东·统考高考真题)X、Y均为短周期金属元素,同温同压下,0.1mlX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1mlY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由一定能确定产物中X、Y的化合价
3.(2023·全国·统考高考真题)为阿伏加德罗常数的值。下列叙述正确的是
A.异丁烷分子中共价键的数目为
B.标准状况下,中电子的数目为
C.的溶液中的数目为
D.的溶液中的数目为
4.(2022·全国·高考真题)为阿伏加德罗常数的值,下列说法正确的是
A.25℃,下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
5.(2022·浙江·统考高考真题)设NA为阿伏加德罗常数的值,下列说法正确的是
A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA
B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C—H键的数目为4NA
第01讲 物质的量 气体摩尔体积
目录
考点要求
考题统计
考情分析
阿伏加德罗常数
2022浙江卷第1次12题,3分
2022全国甲卷11题,6分
2021全国甲卷8题,6分
本讲为高考命题热点,题型以选择题为主,试题以物质的组成和结构、弱电解质电离、可逆反应、氧化还原反应为载体,综合考查基本概念、基本理论、化学计算。可能会从考查气体摩尔体积的使用条件、物质结构、弱电解质电离、可逆反应、氧化还原反应中电子转移等相关内容命题,解题时注意题设中的陷阱,构建好解题模型。
阿伏加德罗定律
2021年山东卷6题,3分
2020年北京卷5题,3分
条件
推论公式
语言叙述
T、p相同
eq \f(n1,n2)=eq \f(V1,V2)
同温、同压下,气体的体积与其物质的量成正比
T、V相同
eq \f(p1,p2)=eq \f(n1,n2)
温度、体积相同的气体,其压强与其物质的量成正比
T、p相同
eq \f(ρ1,ρ2)=eq \f(M1,M2)
同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成正比
T、p、m相同
eq \f(V1,V2)=eq \f(M2,M1)
同温同压下,相同质量的任何气体的体积与它们的摩尔质量成反比
T、V、m相同
eq \f(p1,p2)=eq \f(M2,M1)
同温同体积时,相同质量的任何气体的压强与它们的摩尔质量成反比
T、p、V相同
eq \f(m1,m2)=eq \f(M1,M2)=eq \f(ρ1,ρ2)
同温同压下,同体积的任何气体的质量比等于它们的摩尔质量之比,也等于它们的密度之比
考情分析
网络构建
考点一 物质的量 摩尔质量
【夯基·必备基础知识梳理】
知识点1 物质的量、阿伏加德罗常数
知识点2 摩尔质量
【提升·必考题型归纳】
考向1 考查有关“物质的量”概念理解与辨析
考向2 物质的量、质量、微粒数之间的关系
考点二 气体摩尔体积 阿伏加德罗定律
【夯基·必备基础知识梳理】
知识点1 影响物质体积的因素
知识点2 气体摩尔体积
知识点3 阿伏加德罗定律及其推论
【提升·必考题型归纳】
考向1 考查气体摩尔体积
考向2 考查阿伏加德罗定律及应用
考向3 考查气体摩尔质量计算的常用方法
真题感悟
考点一 物质的量、阿伏加德罗常数
知识点1 物质的量、阿伏加德罗常数
1.物质的量(n)
表示含有一定数目粒子的集合体的物理量,单位为摩尔(ml)。
2.物质的量的规范表示方法:
3.阿伏加德罗常数(NA)
0.012 kg 12C中所含的碳原子数为阿伏加德罗常数,其数值约为6.02×1023,单位为ml-1。公式:NA=eq \f(N,n)。
【易错提醒】(1)物质的量只能衡量微观粒子,必须指明具体粒子的种类或化学式,故摩尔后面应为确切的微粒名称;如1 ml氢(不确切)和1 ml大米(宏观物质)皆为错误说法。
(2)物质的量是物理量,摩尔是物质的量的单位,不是物理量。
(3)6.02×1023是个纯数值,没有任何物理意义,而阿伏加德罗常数(NA)是指1 ml任何微粒所含的粒子数,它与0.012 kg12C所含的碳原子数相同,数值约为6.02×1023。
知识点2 摩尔质量
1.定义:单位物质的量的物质所具有的质量。常用的单位是 g·ml-1。公式:M=eq \f(m,n)。
2.数值:以 g·ml-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。
【易错提醒】(1)摩尔质量、相对原子(或分子)质量的含义不同,不是同一个物理量。二者单位也不同,摩尔质量的单位是g·ml-1或kg·ml-1,相对原子(或分子)质量的单位为1,当摩尔质量以g·ml-1为单位时,二者在数值上相等。
(2)对具体的物质,其摩尔质量是确定的,不随物质的量的多少而变化,也不随物质的聚集状态而变化。
考向1 考查有关“物质的量”概念理解与辨析
例1.(2022·上海青浦·一模)下列对摩尔(ml)的有关说法中错误的是
A.摩尔是一个单位而非物理量
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1ml任何气体所含气体的分子数目都相等
D.0.5ml氦约含有1.204×1024个电子
【解析】A.摩尔是物质的量的单位,正确;B.摩尔用来计量微粒的量,可以是纯净物的微粒,也可以是混合物的微粒,正确;C.气体物质的量相等,则气体的分子数目相等,正确;D.氦为单原子分子,0.5ml氦含有0.5mlHe原子,1个He原子含有2个电子,所以0.5ml氦约含有6.02×1023个电子,错误;故选D。
【答案】D
【名师点睛】本题考查的是物质中含有的各种粒子或微观结构的问题,一般来说先计算物质基本微粒中含有多少个需要计算的粒子或微观结构,再乘以该物质的物质的量,就可以计算出相应结果,稀有气体分子都是单原子分子。
【变式训练】下列有关叙述正确的是()
A.1 ml任何物质都含有6.02×1023个分子
B.硫酸的摩尔质量为98 g
C.2 ml H2O是1 ml H2O摩尔质量的2倍
D.摩尔是物质的量的单位
【解析】A.物质的构成粒子有分子、原子或离子,如水由 分子构成,1ml H2O含有6.02×1023个分子,而NaCl由离 子构成,不存在分子,1ml NaCl含有1ml Na+和1ml Cl-,故A不正确;B.摩尔质量的单位为g/ml,故B不正确;C.对具体的物质,其摩尔质量是确定的,不随物质的量的多少而变化,也不随物质的聚集状态而变化,故C不正确;D.摩尔是物质的量的单位,故D正确,本题选D。
【答案】D
考向2 物质的量、质量、微粒数之间的关系
例2.下列叙述正确的是( )
A.24 g镁与27 g铝含有相同的质子数
B.等质量的氧气和臭氧,电子数相同
C.1 ml重水与1 ml水中,中子数比为2∶1
D.1 ml乙烷和1 ml乙烯,化学键数目相同
【解析】A项:24 g Mg与27 g Al所含质子的物质的量分别为eq \f(24 g,24 g·ml-1)×12=12 ml、eq \f(27 g,27 g·ml-1)×13=13 ml,二者所含质子的物质的量不相等,A项错误;B项:同质量的O2和O3中的O原子数相同,则电子数也相同,B项正确;C项:1 ml D2O中的中子数为10NA,1 ml H2O中的中子数为8NA,比为5∶4,C项错误;D项:1 ml C2H6中含有7 ml化学键,1 ml CH2===CH2中含有5 ml化学键(4 ml C—H键,1 ml键),D项错误。
【答案】B
【变式训练】(1)某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值。
①该氯原子的相对原子质量为________;
②该氯原子的摩尔质量是________;
③m g该氯原子的物质的量为________;
④n g该氯原子所含的电子数为________。
(2)12.4 g Na2R含Na+ 0.4 ml,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
【解析】(2)据电离方程式Na2R===2Na++R2-,得1 ml Na2R电离生成2 ml Na+,题目中有Na+ 0.4 ml,则有0.2 ml Na2R。M(Na2R)=eq \f(m(Na2R),n(Na2R))=eq \f(12.4 g,0.2 ml)=62 g/ml。由Mr(Na2R)=62,求得Mr(R)=62-2×23=16,已知m(R)=1.6 g,根据n=eq \f(m,M),得n(R)=0.1 ml,则n(Na2R)=0.1 ml。
【答案】(1)①eq \f(12a,b) ②aNA g·ml-1
③eq \f(m,aNA) ml ④eq \f(17n,a)
(2)62 g/ml 16 0.1 ml
【思维建模】由已知物理量求物质所含的粒子数目的思维模型
(记住特殊物质中1 ml物质所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、—OH、OH-等)
考点二 气体摩尔体积 阿伏加德罗定律
知识点1 影响物质体积大小的因素
①粒子的大小(物质的本性);②粒子间距的大小(由温度与压强共同决定);③粒子的数目(物质的量的大小)。
知识点2 气体摩尔体积
(1)含义:单位物质的量的气体所占的体积,符号为Vm,标准状况下,Vm约为 22.4_L·ml-1。
(2)常用单位:L/ml(或L·ml-1)。
(3)数值:在标准状况下(指温度为0℃,压强为101 kPa)约为22.4 L·ml-1。
(4)基本关系式:n=eq \f(V,Vm)=eq \f(m,M)=eq \f(N,NA)
(5)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。
(6)适用对象:单一气体或互不反应的混合气体
【特别提醒】气体摩尔体积(22.4 L·ml-1)应用的“五大误区”
(1)使用“条件”是标准状况,即0 ℃、101 kPa,而不是常温、常压。
(2)使用对象必须是气体物质,可以是单一气体,也可以是混合气体。标准状况下不是气体而又常在题中出现的物质有:水、苯、SO3、HF、CCl4、己烷、CS2、CHCl3、Br2、乙醇等。
(3)标准状况下的气体摩尔体积约为22.4 L·ml-1,其他条件下Vm一般不是22.4 L·ml-1。
(4)22.4 L气体,在标准状况下的物质的量是1 ml,在非标准状况下,可能是1 ml,也可能不是1 ml。
(5)物质的质量、物质的量一定时,所含微粒数与物质处于何种条件无关。如常温常压下32 g O2所含的原子数目是2NA。注意不要形成定势思维,看到“常温常压”就排除选项。
知识点3 阿伏加德罗定律及其推论
(1)阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体,含有相同数目的粒子(或气体的物质的量相同)。
【名师提醒】可总结为:“三同”定“一同”,即同温、同压下,同体积的任何气体具有相同的分子数。
(2)阿伏加德罗定律的推论(以下用到的符号:ρ为密度,p为压强,n为物质的量,M为摩尔质量,m为质量,V为体积,T为热力学温度)
【方法技巧】
1、记忆方法:三正比、二反比、一连比。
2、应用阿伏加德罗定律推论时可通过pV=nRT及n=eq \f(m,M)、ρ=eq \f(m,V)导出。
考向1 气体摩尔体积
例1.CH4 与Cl2光照条件下充分反应生成一系列卤代烃,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4 L CHCl3含有的氯原子数为3NA
B.标准状况下,22.4 L Cl2完全反应后得到的HCl分子数为2NA
C.16 g CH4与足量Cl2充分反应后得到的卤代烃分子总数为NA
D.1 ml CH4和1 ml Cl2充分反应可以得到CH3Cl的分子数为NA
【解析】A项,标准状况下,三氯甲烷不是气态,无法使用22.4 L/ml计算物质的量,选项A错误;B项,标准状况下,22.4 L Cl2与CH4完全反应,无论生成哪种卤代烃,每消耗1 ml Cl2生成1 ml HCl,所以得到HCl分子数为NA,选项B错误;C项,根据碳原子守恒,16 g CH4为1 ml,与足量Cl2充分反应后得到的卤代烃分子总数为NA,选项C正确;D项,甲烷和氯气发生多步反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和HCl,无法计算得到的CH3Cl的分子数,选项D错误;故选C。
【答案】C
【变式训练】已知:①6.72 L NH3(标准状况下)②1.204×1023个H2S分子 ③5.6 g CH4④0.5 ml HCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.原子数目:③>①>②>④
C.密度大小:④>②>③>①
D.质量大小:④>②>③>①
【解析】①标准状况下,6.72 L NH3的物质的量为eq \f(6.72 L,22.4 L·ml-1)=0.3 ml;②1.204×1023个H2S分子的物质的量为eq \f(1.204×1023,6.02×1023 ml-1)=0.2 ml;③5.6 g CH4的物质的量为eq \f(5.6 g,16 g·ml-1)=0.35 ml;④HCl物质的量为0.5 ml。由上述计算可知,物质的量④>③>①>②,相同条件下,体积大小为④>③>①>②,A项错误;①标准状况下6.72 L NH3所含原子的物质的量为0.3 ml×4=1.2 ml,②1.204×1023个H2S分子所含原子的物质的量为0.2 ml×3=0.6 ml,③5.6 g CH4所含原子的物质的量为0.35 ml×5=1.75 ml,④0.5 ml HCl所含原子的物质的量为0.5 ml×2=1 ml,所以原子数目③>①>④>②,B项错误;同温同压下,气体密度之比等于其相对分子质量之比,故密度大小④>②>①>③,C项错误;①NH3的质量为17 g·ml-1×0.3 ml=5.1 g,②H2S的质量为34 g·ml-1×0.2 ml=6.8 g,③CH4质量为5.6 g,④HCl质量为36.5 g·ml-1×0.5 ml=18.25 g,故质量大小④>②>③>①,D项正确。
【答案】D
考向2 阿伏加德罗定律及应用
例2.如图Ⅰ,将质量均为m g的O2和SO2气体分别充入两个相同体积的密闭容器甲、乙中,下列说法正确的是( )
图Ⅰ 图Ⅱ
A.甲、乙中所含的氧原子物质的量之比为1∶2
B.两者压强(p)与温度(T)的关系如图Ⅱ所示
C.甲、乙中气体质子数之比为1∶2
D.甲、乙中气体密度比为1∶2
【解析】A.根据n=eq \f(m,M),质量均为m g的O2和SO2物质的量之比与摩尔质量成反比,即n(O2)∶n(SO2)=64∶32=2∶1,甲、乙中所含的氧原子物质的量之比为2∶1,故A错误;B.由pV=nRT,体积相等的甲和乙,压强与温度成正比,且n(O2)∶n(SO2)=2∶1即代表氧气的曲线较高,故B正确;C.n(O2)∶n(SO2)=2∶1,质子数之比为2×16∶1×32=1∶1,故C错误;D.根据ρ=eq \f(m,V),甲、乙容器体积相等,两个气体的质量相等,则密度也相等,即甲、乙中气体密度比为1∶1,故D错误;故选B。
【答案】B
【变式训练】三种气体X、Y、Z的相对分子质量关系为Mr(X)
B.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 ml
C.同温同压下,同质量的三种气体,气体密度最小的是Y
D.同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则压强比为4∶1
【解析】因为不确定X、Y、Z三种气体分子中原子个数和组成,所以原子数相等的三种气体就不能确定三种气体的分子数,故A错误;三种气体体积均为2.24 L,Vm不一定等于22.4 L/ml,所以它们的物质的量不一定均为0.1 ml,故B错误;同温同压下,同质量的三种气体,密度和相对分子质量成正比,三种气体密度最小的是X,故C错误;同温同体积气体物质的量之比等于压强之比,Y、Z气体的压强比为
eq \f(p(Y),p(Z))=eq \f(n(Y),n(Z))=eq \f(\f(m(Y),Mr(Y)),\f(m(Z),Mr(Z)))=eq \f(m(Y)·Mr(Z),m(Z)·Mr(Y))=eq \f(2×2,1)=4∶1,故D正确。
【答案】D
【思维建模】熟练应用的2组公式
(1)n=eq \f(m,M)=eq \f(V,Vm)=eq \f(N,NA);
(2)eq \f(V1,V2)=eq \f(n1,n2)=eq \f(N1,N2)(同温、同压)。
考向3 气体摩尔质量计算的常用方法
例3.按要求解答问题
(1)已知标准状况下,气体A的密度为2.857 g·L-1,则气体A的相对分子质量为_______,可能是_______气体。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_______。
(3)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则
①混合气体在标准状况下的密度是_______g·L-1。
②混合气体的平均摩尔质量是_______ g·ml-1。
【解析】(1)M=ρ×22.4 L·ml-1≈64 g·ml-1;根据相对分子质量,推测可能是二氧化硫气体。
(2) 。
(3)CO燃烧发生反应:2CO+O22CO2,CO的体积与生成CO2的体积相等,燃烧后CO2的总体积为11.2 L,故18 g CO和CO2的混合气体的总体积为11.2 L,在标准状况下,18 g CO和CO2的混合气体的物质的量为0.5 ml,设CO的物质的量为x ml,CO2的物质的量为y ml,
则,解得x=0.25,y=0.25。
①原混合气体的密度==≈1.61 g·L-1。
②=ρ·V=ρ·22.4 L·ml-1=1.61 g·L-1×22.4 L·ml-1≈36 g·ml-1。
【答案】(1)64 (2) SO2 64 (3)①1.61 ②36
【变式训练】(2022·上海·模拟预测)打火机里装有液态的丙烷和丁烷。下列说法错误的是
A.打开打火机开关,分子间距变大
B.摩擦打火石,达到气体着火点
C.丙烷完全燃烧需要空气约为
D.若n(丙烷):n(丁烷),该混合物的摩尔质量为
【答案】C
【解析】A.打开打火机开关,压强减小,燃料气化,分子间距变大,A正确;B.摩擦打火石,使温度达到气体着火点,引燃燃料,B正确;C.没有说明具体的温度、压强,不能判断丙烷完全燃烧需要空气的体积,C错误;D.若n(丙烷):n(丁烷),该混合物的摩尔质量为,D正确。故选C。
【思维建模】求气体摩尔质量M及相对分子质量的常用方法:
(1)根据物质的质量(m)和物质的量(n):M=m/n。
(2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·m/N。
(3)根据标准状况下气体的密度ρ:M=ρ×22.4 L·ml-1。
(4)根据气体的相对密度(D=ρ1/ρ2):M1/M2=D。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%……指混合物中各成分的物质的量分数(或体积分数)。
1.(2023·上海·统考高考真题)常温常压下,下列物质的物理量种前者是后者两倍的是
A.28 g和28g中所含的中子数
B.2.24 L和2.24 L原子数
C.1ml和2ml的密度
D.0.1ml·L和0.1 ml·L 的
【答案】C
【解析】A.28 g28Si是1ml28Si,质子数为14NA,中子数14NA,28g14N是2ml14N,质子数为2×7NA=14NA,中子数为2×7NA=14NA,A不符合;B.常温常压下2.24 LSO2和2.24 LN2分子数为1:1,原子数之比为3:2,B不符合;C.1mlSO2和2mlO2的密度之比等于分子的摩尔质量之比,与物质的量无关,密度之比等于64:32=2:1,C符合;D.硫酸为强电解质,能完全电离,醋酸为弱电解质,不能完全电离,故0.1ml·L−1H2SO4和0.1 ml·L−1 CH3COOH的c(H+)之比大于2:1,D不符合;故答案为:C。
2.(2021·山东·统考高考真题)X、Y均为短周期金属元素,同温同压下,0.1mlX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1mlY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由一定能确定产物中X、Y的化合价
【答案】D
【分析】设与1ml X反应消耗HCl的物质的量为aml,与1ml Y反应消耗H2SO4的物质的量为bml,根据转移电子守恒以及H原子守恒可知、。
【解析】A.同温同压下,气体体积之比等于其物质的量之比,因此X、Y生成H2的物质的量之比一定为,故A正确;B. X、Y反应过程中消耗酸的物质的量之比为,因,因此,故B正确;C.产物中X、Y化合价之比为,由B项可知,故C正确;D.因短周期金属单质与盐酸或稀硫酸反应时,生成的盐中金属元素化合价有+1、+2、+3三种情况,因此存在a=1,2,3,b=0.5,1的多种情况,由可知,当a=1,b=0.5时,=1,当a=2,b=1时,=1,两种情况下X、Y的化合价不同,因此根据可能无法确定X、Y的化合价,故D错误;综上所述,错误的D项,故答案为D。
3.(2023·全国·统考高考真题)为阿伏加德罗常数的值。下列叙述正确的是
A.异丁烷分子中共价键的数目为
B.标准状况下,中电子的数目为
C.的溶液中的数目为
D.的溶液中的数目为
【答案】A
【解析】A.异丁烷的结构式为,1ml异丁烷分子含有13NA共价键,所以0.50ml异丁烷分子中共价键的数目为6.5NA,A正确;B.在标准状况下,SO3状态为固态,不能计算出2.24L SO3物质的量,故无法求出其电子数目,B错误;C.pH=2的硫酸溶液中氢离子浓度为c(H+)=0.01ml/L,则1.0L pH=2的硫酸溶液中氢离子数目为0.01NA,C错误;D.属于强碱弱酸盐,在水溶液中CO会发生水解,所以1.0L 1.0 ml/L的Na2CO3溶液中CO的数目小于1.0NA,D错误;故选A。
4.(2022·全国·高考真题)为阿伏加德罗常数的值,下列说法正确的是
A.25℃,下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
【答案】C
【解析】A.25℃、101kPa不是标准状况,不能用标况下的气体摩尔体积计算氢气的物质的量,故A错误;B.Al3+在溶液中会发生水解生成Al(OH)3,因此2.0L 1.0 ml/L的AlCl3溶液中Al3+数目小于2.0NA,故B错误;C.苯甲酸燃烧的化学方程式为,1ml苯甲酸燃烧生成7mlCO2,则0.2ml苯甲酸完全燃烧生成1.4mlCO2,数目为1.4NA,故C正确;D.电解熔融CuCl2时,阳极反应为,阴极反应为,阴极增加的重量为Cu的质量,6.4gCu的物质的量为0.1ml,根据阴极反应可知,外电路中通过电子的物质的量为0.2ml,数目为0.2NA,故D错误;答案选C。
5.(2022·浙江·统考高考真题)设NA为阿伏加德罗常数的值,下列说法正确的是
A.在25℃时,1LpH为12的Ba(OH)2溶液中含有OH-数目为0.01NA
B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C—H键的数目为4NA
【答案】A
【解析】A.1LpH为12的Ba(OH)2溶液中含有OH-的浓度为0.01ml/L,物质的量0.01ml/L 1L=0.01ml,OH-的数目为0.01NA,A正确;B.1.8g重水(D2O)的物质的量为:0.09ml,所含质子数为0.9NA,B错误;C.足量的浓盐酸与8.7gMnO2(0.1ml)反应,+4价Mn转化生成Mn2+,转移电子的数目为0.2NA,C错误;D.甲醇的结构简式为:CH3OH,32g (1ml)的分子中含有C—H键的数目为3NA,D错误;答案选A。
考点要求
考题统计
考情分析
阿伏加德罗常数
2022浙江卷第1次12题,3分
2022全国甲卷11题,6分
2021全国甲卷8题,6分
本讲为高考命题热点,题型以选择题为主,试题以物质的组成和结构、弱电解质电离、可逆反应、氧化还原反应为载体,综合考查基本概念、基本理论、化学计算。可能会从考查气体摩尔体积的使用条件、物质结构、弱电解质电离、可逆反应、氧化还原反应中电子转移等相关内容命题,解题时注意题设中的陷阱,构建好解题模型。
阿伏加德罗定律
2021年山东卷6题,3分
2020年北京卷5题,3分
条件
推论公式
语言叙述
T、p相同
eq \f(n1,n2)=eq \f(V1,V2)
同温、同压下,气体的体积与其物质的量成正比
T、V相同
eq \f(p1,p2)=eq \f(n1,n2)
温度、体积相同的气体,其压强与其物质的量成正比
T、p相同
eq \f(ρ1,ρ2)=eq \f(M1,M2)
同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成正比
T、p、m相同
eq \f(V1,V2)=eq \f(M2,M1)
同温同压下,相同质量的任何气体的体积与它们的摩尔质量成反比
T、V、m相同
eq \f(p1,p2)=eq \f(M2,M1)
同温同体积时,相同质量的任何气体的压强与它们的摩尔质量成反比
T、p、V相同
eq \f(m1,m2)=eq \f(M1,M2)=eq \f(ρ1,ρ2)
同温同压下,同体积的任何气体的质量比等于它们的摩尔质量之比,也等于它们的密度之比
专题复习 高考化学 考点05 物质的量 气体摩尔体积 讲义: 这是一份专题复习 高考化学 考点05 物质的量 气体摩尔体积 讲义,共24页。试卷主要包含了物质的量与阿伏加德罗常数,气体摩尔体积,阿伏加德罗定律及其推论等内容,欢迎下载使用。
新高考化学复习讲义+练习 第03讲 化学计算的常用方法(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第03讲 化学计算的常用方法(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第03讲化学计算的常用方法讲义原卷版+解析docx、新高考化学复习讲义+练习第03讲化学计算的常用方法练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。
新高考化学复习讲义+练习 第02讲 物质的量浓度与溶液的配制(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第02讲 物质的量浓度与溶液的配制(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第02讲物质的量浓度与溶液的配制讲义原卷版+解析docx、新高考化学复习讲义+练习第02讲物质的量浓度与溶液的配制练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。












