备课素材知识点:线粒体自噬的机理- 高中生物人教版必修1
展开细胞内受损后的线粒体释放的信号蛋白,会引发细胞非正常死亡.如图表示细胞通过“自噬作用”及时清除受损线粒体及其释放的信号蛋白的过程,请据图回答:
(1)吞噬泡的吞噬过程体现了生物膜在结构上具有 的特点.图中自噬体由 层磷脂分子构成(不考虑自噬体内的线粒体).
(2)受损线粒体的功能逐渐退化,会直接影响有氧呼吸的第 阶段.细胞及时清除受损的线粒体及信号蛋白的意义是 .
(3)(3)研究发现人体细胞溶酶体内的pH在5.0左右,由此可知细胞质基质中的H+进入溶酶体的运输方式是 .
(4)图中水解酶的合成场所是 .自噬体内的物质被水解后,其产物的去向是 .由此推测,当细胞养分不足时,细胞“自噬作用”会 (增强/减弱/不变).
解析:阅读题干和题图可知,本题以线粒体的“自噬作用”为材料考查溶酶体在维持细胞内稳态的过程中所起的作用,先分析题图了解线粒体“自噬作用”的过程和涉及的相关知识,然后结合问题的具体要求综合解答.
由题图可知,吞噬泡的吞噬过程存在膜的变化,体现了生物膜在结构上具有一定的流动性;图中自噬体是两层膜包裹着线粒体,若不考虑自噬体内的线粒体,自噬体由4层磷脂分子组成.
(2)线粒体是有氧呼吸的主要场所,在线粒体中进行有氧呼吸的第二、三阶段,所以受损线粒体的功能逐渐退化,会直接影响有氧呼吸的第二、三阶段;由题意可知,细胞内受损后的线粒体释放的信号蛋白,会引发细胞非正常死亡,细胞及时清除受损的线粒体及信号蛋白的意义是维持细胞内部环境的相对稳定,避免细胞非正常死亡.
(3)由题意可知,H+从细胞质基质进入溶酶体是逆浓度梯度运输,因此属于主动运输.
(4)水解酶的 本质是蛋白质,蛋白质合成的场所是核糖体,自噬体内的物质被水解后,形成产物的对细胞有用的物质又被细胞利用,对细胞无用甚至有害的物质被排出细胞外;当细胞养分不足时,细胞“自噬作用”会增强,以为细胞提供更多的营养物质.
答案:(1)流动性 4(2)二、三 避免细胞非正常死亡(维持细胞内部环境的相对稳定)(3)主动运输
(4)核糖体 排出细胞外或细胞内利用 增强
这道试题以线粒体与细胞“自噬作用”为素材考查细胞结构和功能。
那么,线粒体与细胞“自噬作用”的机理是怎样的?
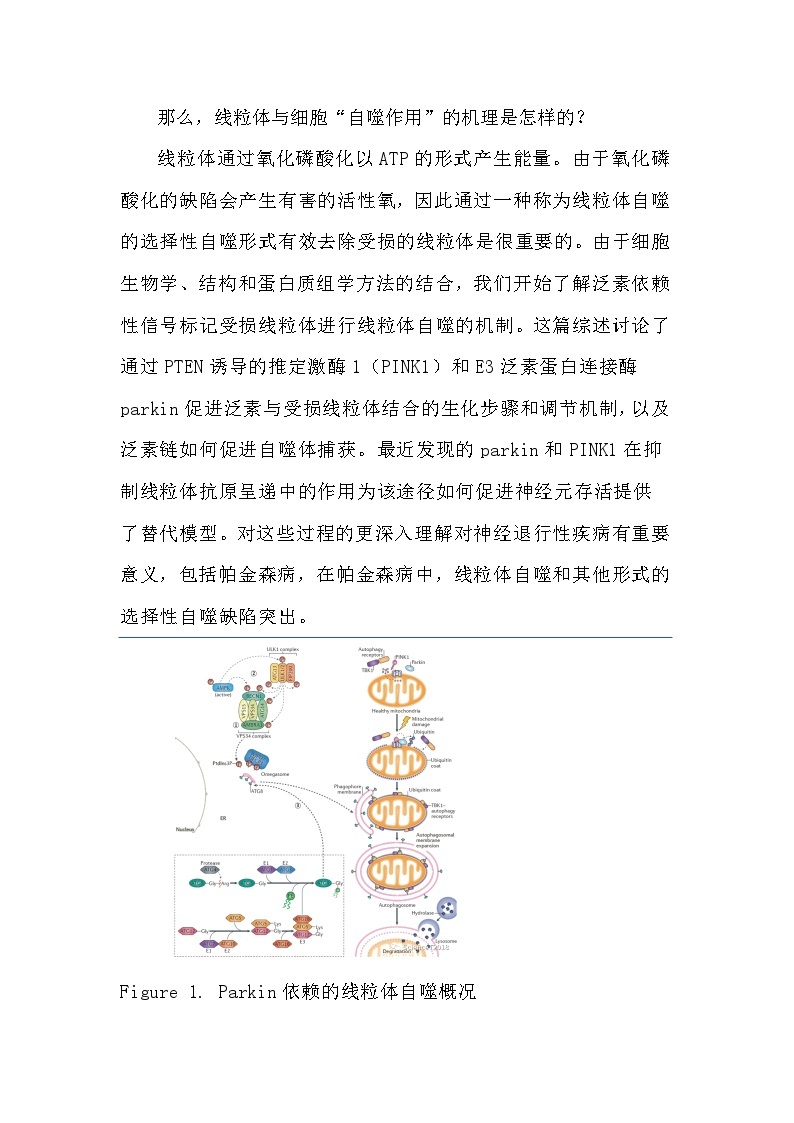
线粒体通过氧化磷酸化以ATP的形式产生能量。由于氧化磷酸化的缺陷会产生有害的活性氧,因此通过一种称为线粒体自噬的选择性自噬形式有效去除受损的线粒体是很重要的。由于细胞生物学、结构和蛋白质组学方法的结合,我们开始了解泛素依赖性信号标记受损线粒体进行线粒体自噬的机制。这篇综述讨论了通过PTEN诱导的推定激酶1(PINK1)和E3泛素蛋白连接酶parkin促进泛素与受损线粒体结合的生化步骤和调节机制,以及泛素链如何促进自噬体捕获。最近发现的parkin和PINK1在抑制线粒体抗原呈递中的作用为该途径如何促进神经元存活提供了替代模型。对这些过程的更深入理解对神经退行性疾病有重要意义,包括帕金森病,在帕金森病中,线粒体自噬和其他形式的选择性自噬缺陷突出。
Figure 1. Parkin依赖的线粒体自噬概况
线粒体在细胞和生物体的生活中发挥着核心作用,通过氧化磷酸化以ATP的形式作为能量产生中心,并通过组织代谢机制,如柠檬酸循环,驱动许多细胞功能。线粒体的空间组织是其功能的关键,其中氧化磷酸化通过线粒体内膜中的呼吸链发生,其他代谢反应在线粒体基质中组织。
线粒体蛋白质由细胞核和线粒体基因组编码,需要通过线粒体外膜和内膜精确协调蛋白质输入,折叠和组装成蛋白质复合物,最终形成功能性的空间组织细胞器。这些过程中的错误会导致线粒体受损,对细胞生理学有害。例如,呼吸链功能的缺陷会促进破坏性活性氧的产生和对线粒体功能至关重要的膜电位的丧失。此外,基质中蛋白质折叠的缺陷促进线粒体未折叠蛋白反应(mitchndrial unflded prtein respnse,mtUPR),后者控制线粒体基质中的蛋白质合成和线粒体伴侣蛋白的产生。尽管当损伤比较短暂时,mtUPR等稳态机制可能足以修复线粒体,但长期或不可修复的损伤可以通过线粒体自噬过程导致线粒体的消除。线粒体自噬是一种选择性自噬形式,在此过程中,线粒体被聚泛素链修饰,被自噬体吞噬,并在溶酶体融合后降解(Figure 1)。
线粒体自噬最初是在培养细胞的电子显微照片中观察到的,过去二十年的工作揭示了线粒体通过泛素依赖和泛素非依赖途径靶向自噬系统的基本生化步骤。作者对泛素依赖性线粒体自噬的理解主要是通过分析两个在家族性帕金森病中被发现突变的基因来推动的——E3泛素蛋白连接酶parkin(PRKN)及其活化激酶PTEN诱导的推定激酶1(PTEN-induced putative kinase 1,PINK1),该激酶存在于受损的线粒体上。对黑腹果蝇的早期研究揭示了PINK1在parkin上游发挥作用的遗传学途径,parkin的过度表达可以绕过PINK1的缺陷。现在知道,这些蛋白质以一种共同的途径运作,催化线粒体外膜(mitchndrial uter membrane,MOM)蛋白上泛素链的组装。这些泛素链结合自噬货物受体,如视神经磷酸酶(ptineurin,OPTN)和螯合体1(sequestsme 1,SQSTM1,也称为p62),它们与一般的自噬机制协同作用,捕获自噬体双膜中受损的线粒体(Figure 1)。与溶酶体融合并通过溶酶体水解酶促进线粒体的降解。
最近发现,OPTN和SQSTM1,以及它们相关的丝氨酸/苏氨酸蛋白激酶TBK1,在基因上与肌萎缩侧索硬化症(amytrphic lateral sclersis,ALS)的散发和家族形式有关。这种遗传联系有两个主要含义:第一,它表明选择性形式的自噬是特定形式ALS的基础,第二,它表明了解标记自噬货物(包括线粒体)连同泛素及其被货物受体捕获的生化机制,可能为神经退行性疾病的治疗干预开辟新的途径。除了这些对疾病的影响外,最近的研究表明,某些形式的parkin介导的线粒体自噬清除了明显健康的线粒体,这对几个生理过程很重要,例如血管生成素1受体(TIE2)阳性造血干细胞的自我更新,以及受精过程中父亲的线粒体清除(BOX 1)。此外,parkin与结核分枝杆菌的异种吞噬清除有关,这可能与线粒体自噬相似,但其潜在机制尚不清楚。
在这篇综述中,作者重点关注驱动泛素链在受损线粒体上组装的生化机制,以及泛素化是如何被自噬机制解码以捕获受损细胞器的。鉴于线粒体不断参与融合-分裂循环,可能会混合健康和受损的细胞器,线粒体自噬途径在选择性标记和降解受损细胞器的能力方面快速而稳健是很重要的。这种选择性是通过使用两个不同的、顺序的前馈环来实现的,这两个前馈环由线粒体表面的激酶PINK1和泛素ubiquitin驱动,预计它们会产生开关样行为,仅用于检测和捕获受损的细胞器。作者描述了泛素依赖形式的线粒体自噬的可推广框架,并讨论了对这些关键途径的理解中存在的实质性差距。
发育过程中的线粒体自噬和通过parkin非依赖机制
人们越来越认识到,除了去除有缺陷的线粒体外,在发育和正常生理过程中发生的特定细胞转变过程中,线粒体丰度的大幅改变也是必要的(见下图)。
在秀丽隐杆线虫、黑腹果蝇和脊椎动物的受精过程中,父系线粒体DNA的丢失是通过线粒体自噬过程发生的。在小鼠中,E3泛素蛋白连接酶parkin和线粒体泛素连接酶激活因子NFKB 1(mitchndrial ubiquitin ligase activatr f NFKB 1,MUL1)与螯合体1(sequestsme 1,SQSTM1)和PTEN诱导的推定激酶1(PTEN-induced putative kinase 1,PINK1)联合发挥冗余功能,表明在这种情况下使用了已建立的PINK1-parkin途径的一些元素。相比之下,黑腹果蝇的类似过程需要自噬机制和SQSTM1,但不需要parkin直系同源物。
为了在网织红细胞成熟过程中去除线粒体,捕获线粒体的自噬体组装由位于线粒体外膜(MOM)上的一种名为BCL2/腺病毒E1B 19kDa蛋白相互作用蛋白3样(BCL2/adenvirus E1B 19 kDa prtein-interacting prtein 3like,NIX;也称为BNIP3L)的自噬受体协调,含有用于与ATG8蛋白相关的LC3相互作用区(LC3interacting regin,LIR)基序,是线粒体有效清除所必需的。最近的数据表明,LIR基序附近NIX的磷酸化增加了与ATG8的结合,并增加了线粒体的自噬体募集。其他含有LIR基序的MOM蛋白,包括肽基脯氨酰顺反异构酶FKBP8和含有FUN14结构域的蛋白1(FUN14 dmain-cntaining prtein 1,FUNDC1),与ATG8蛋白的直接相互作用有关,以促进线粒体自噬。在缺乏parkin的情况下,FKBP8和ATG8蛋白LC3A的过表达可以促进线粒体自噬,尽管这种形式的线粒体自噬的生理环境尚不清楚。类似地,FUNDC1的过表达可以通过E3泛素蛋白连接酶MARCH5调节的方式促进对缺氧的线粒体自噬。了解ATG8募集用于促进直接线粒体自噬的生理环境仍然是未来研究的目标。
PINK1-parkin通路综述
普遍认为,线粒体上泛素链的组装对于这种自噬机制的补充和线粒体自噬清除受损的线粒体是必要的。在最简单的形式中,泛素链组装途径可以描述为包含三个积极作用的元件:线粒体损伤传感器(PINK1)、信号放大器(parkin)和信号效应器(泛素链),其决定哪些线粒体应该被自噬机制捕获(Figure 1)。
PINK1包含一个N末端线粒体靶向序列,并与外膜转位酶(translcase f the uter membrane,TOM)复合物结合。当PINK1的线粒体靶向序列和跨膜片段到达内膜转位酶(translcase f the inner membrane,TIM)复合物并横向转移到内膜时,跨膜片段被内膜定位蛋白酶PARL(早老素相关菱形样蛋白,presenilins-assciated rhmbid-like prtein,线粒体)蛋白水解切割。切割产生含有激酶结构域的52kDa蛋白质片段,该激酶结构域可能仍与TOM复合物相关联。
当线粒体健康时,这一52 kDa的PINK1片段被释放到胞质溶胶中,并被N端规则泛素连接酶(Nend rule ubiquitin ligase)快速泛素化,该连接酶将其靶向蛋白酶体降解。因此,在具有健康线粒体的细胞中PINK1水平较低。然而,当线粒体受损时,PINK1易位和加工被阻断,导致活性PINK1在MOM上积累,它可以通过多步前馈机制激活parkin的E3泛素连接酶活性,详见后面所述。组装在MOM上的parkin依赖性泛素链随即促进泛素结合线粒体自噬受体的募集,以促进自噬体的捕获(Figure 1)。
与大多数信号转导途径一样,负调节因子有助于确保损伤信号足够强,从而使健康的线粒体不会被不适当地降解。在这种线粒体自噬途径中,去泛素化酶(deubiquitinating enzymes,DUBs),包括线粒体定位的泛素羧基末端水解酶30(ubiquitin carbxyl-terminal hydrlase 30,USP30),似乎通过从线粒体中去除泛素链来拮抗该途径,直到parkin激活足以超过USP30对泛素链的去除。阐明决定parkin激活状态的生化机制一直是该研究领域的主要焦点。
PINK1激活parkin的机制
在线粒体健康的细胞中,parkin以自身抑制的形式广泛定位在细胞质中。然而,在线粒体损伤和PINK1在MOM上稳定后,parkin可以经历PINK1引发的一系列修饰(包括磷酸化、多种构象变化以及与Ser65磷酸化泛素(Ser65phsphrylated ubiquitin,pSer65Ub)的结合),促进其与MOM的稳定结合及其E3泛素连接酶活性的激活。为了简单起见,分别描述了parkin激活的两个主要步骤——通过parkin-泛素样(parkin ubiquitinlike,UBL)结构域磷酸化的直接激活和通过与pSer65-Ub结合的激活——然后描述了这些事件如何在MOM上协同作用,以产生促进线粒体自噬的前馈泛素化过程。应该注意的是,在下文描述的许多研究中,实验方法是在模型细胞系统中过表达parkin或PINK1,考虑到反馈回路的参与,这可能具有未知的影响,并且结果可能更难解释。
Figure 2. parkin和pSer65Ub的结构解剖
通过PINK1依赖性UBL磷酸化激活内在的parkin。
泛素系统采用了一系列泛素装载和转移事件,最终导致泛素的C端Gly76残基转移到底物上的赖氨酸残基(初级泛素化),或泛素本身的赖氨酸残基以延伸泛素链。泛素在ATP存在下被E1泛素激活酶激活,并转移到几种E2泛素缀合酶之一的活性位点的半胱氨酸残基上以形成硫酯键。这种E2酶与E3泛素连接酶中的RING finger或HECT结构域相互作用,以促进泛素向底物的转移。Parkin是RING-between-RING(RBR)E3泛素连接酶;它包含N末端UBL结构域、结合E2酶的中心RING1结构域、一个inbetween RING (IBR)结构域和含有催化半胱氨酸残基的C末端RING2结构域(Figure 2a)。RBR E3s类似于含有HECT结构域的蛋白质,利用其RING1结构域催化泛素从带电的E2酶转移到RING2中的催化半胱氨酸残基。与HECT E3s一样,这种泛素硫酯随后被释放到底物赖氨酸残基上(Figure 2a,左图)。三种机制涉及parkin自动抑制,必须克服它们才能将parkin转化为活性酶(Figure 2a,右图)。首先,parkin的UBL结构域靠在RING1内的两个核心α螺旋元件之一上,阻断E2的进入(Figure 2b)。第二,抑制性(repressive,REP)元件与UBL域和RING1二者对接,进一步阻止E2接入(Figure 2b)。第三,RING2中的催化Cys431残基被位于UBL结构域和RING1之间的独特的parkin结构域(unique parkin dmain,UPD;也称为RING0)屏蔽,从而阻断泛素从带电荷的E2转移到parkin的催化半胱氨酸残基(Figure 2b)。因此,多重构象变化是必要的,以消除这些自动抑制的限制。
自从发现PINK1在parkin上游发挥作用以来,人们一直致力于了解PINK1如何直接调节parkin活性。一项早期研究发现,PINK1磷酸化了人SHSY5Y细胞中的parkin,并且PINK1依赖性磷酸化促进了parkin形成Lys63连接的泛素链的能力。然而,parkin的磷酸化位点及其激活机制尚未报道。对parkin激活的关键见解来自于PINK1磷酸化parkin的UBL结构域中的Ser65,并且在Ser65处的parkin磷酸化(pSer65-parkin)促进体外parkin的泛素链组装。随后的研究使用Ser65化学计量磷酸化的parkin,结合质谱法对泛素链形成的定量测量,表明pSer65-parkin在体外将链组装活性提高了约2400倍。因此,parkin在其UBL结构域上的磷酸化显著激活了其内在的泛素连接酶活性。Ser65处的UBL结构域磷酸化破坏了UBL–RING1相互作用,并被认为允许UBL结构域通过其系链移动到UPD (Figure 2b–d)。有趣的是,UBL结构域的释放是由parkin (Trp403Ala)的突变模拟的,该突变被认为从RING1部分释放REP元件以促进E2的结合(Figure 2b–d)。该模型与分子动力学模拟一致,分子动力学模拟表明,UBL磷酸化从其与RING1的紧密相互作用中释放出UBL结构域,并导致REP元件构象的微小变化,为带电的E2进入RING1提供了途径。从parkin核心释放UBL结构域提供了已知对PINK1磷酸化重要的UBL结构域的疏水性Ile44残基的通路,这在一定程度上解释了在磷酸化之前释放UBL域的需要。随后的结构改变传播到RING2结构域,如催化Cys431残基的反应性增加所示(BOX 2)。
PINK1磷酸化泛素可促进parkin活化和线粒体保留。
当发现泛素和泛素链是PINK1底物,并且pSer65-Ub链与线粒体上的parkin激活和保留有关时,确定了PINK1对受损线粒体的第二种作用模式。parkin的UBL结构域在氨基酸序列上与泛素约有30%相同(约50%相似),包括含有Ile44的表面的基本保守性,其接近Ser65(Figure 2e,f)。重要的是,发现parkin UBL结构域中的Ser65在泛素中是保守的,这导致PINK1可以直接磷酸化Ser65上的泛素。线粒体自噬诱导过程中的定量磷酸蛋白质组学、候选PINK1底物的无偏鉴定以及泛素存在下PINK1对parkin的生物化学激活研究也都分别将泛素鉴定为PINK1靶标。初步的生化研究表明,单体pSer65-Ub不仅与parkin物理结合,而且可以部分激活其泛素链组装活性,而不依赖于parkin上的Ser65磷酸化。尽管体内parkin似乎以线粒体上泛素链的形式与pSer65-Ub结合(如下所述),但单体pSer65-Ub已成为理解parkin在MOM上激活和保留的生化和结构基础的有用工具。pSer65-Ub可以在体外与未磷酸化的parkin和pSer65-parkin结合,但与pSer65-parkin的结合强度增强约为20倍。此外,虽然pSer65Ub与未磷酸化的parkin的化学计量结合激活链合成约1000倍,但pSer65‐parkin和pSer65−Ub的复合物显示出比未磷酸化parkin高约4400倍的链合成活性。
最近,对通过纳米体稳定的PINK1-泛素复合物的结构进行分析,深入了解了PINK1如何特异性识别泛素。PINK1在蛋白激酶中是独特的,因为它的N端叶包含三段氨基酸序列,称为插入,这是其他蛋白激酶所没有的。该结构表明,这些插入物通过PINK1中Ser202和Ser204的自动磷酸化而稳定,从而产生嵌合体物3的独特构象,从而能够识别泛素作为底物。此外,泛素在与PINK1结合时处于独特的C末端收缩构象(泛素-CR),这将其Ser65残基置于PINK1催化中心附近的延伸环中。泛素-CR构象被认为是pSer65-Ub54所特有的,但最近有报道称,在未修饰的泛素中发现了低丰度的泛素-CR,并与泛素的传统构象快速交换。缺乏嵌合体3的PINK1的结构最近也被描述。这些研究解释了PINK1的关键特征,包括为什么PINK1对泛素和parkin-UBL结构域作为底物具有高度选择性,以及在帕金森病患者中发现的PINK1突变中有多少破坏了催化活性或底物识别。
结构和功能研究表明,通过在parkin内实现重要接触,pSer65-Ub促进连接RING1和IBR结构域的中心α螺旋(H3)的形成(Figure 2a,d),从而从parkin核心释放UBL结构域(Figure 2d)。parkin–pSer65-Ub共复合物中的关键是parkin中的一簇带正电荷的残基(Lys151和His302),它们与pSer65-Ub中的磷酸盐结合,其突变消除了与pSer65-Ub的结合以及pSer65-Ub在体外激活parkin。pSer65-Ub与UBL结构域连接子缺失59个残基的parkin形式结合的晶体学分析(Figure 2a)导致了涉及parkin二聚体的活化的替代模型,其中pSer65-Ub结合打开IBR结构域上的表面,然后与带电荷的泛素~E2硫酯的供体泛素相互作用(其中~表示硫酯键),E2本身与相邻的parkin分子的RING1结合。这一模型得到了以下发现的支持,即IBR残基中被预测与供体泛素直接相互作用的突变在体外减少了parkin的链合成,尽管这些突变体没有在体内进行测试。对活性全长pSer65-parkin与pSer65-Ub复合物的生物物理分析揭示了单体1:1复合物。虽然可以想象,在催化过程中,pSer65-parkin二聚体会短暂组装,但pSer65-parkin中的UBL结构域似乎无法促进二聚体的形成,至少在不存在用于生物物理测量的带电UBCH7的情况下是如此。生物物理和分子动力学测量也表明,缺乏UBL结构域的parkin与泛素~E2的结合触发了RING2结构域向RING1的大规模扩散运动,从而促进泛素转移到位于RING2中的Cys431。需要分析处于转移前状态和含有泛素荷电的RING2状态的全长pSer65-parkin–pSer65-Ub–泛素~E2–底物复合物,以确认这些模型中哪一个是正确的。同样值得注意的是,涉及变构UBL结构域的激活机制已被描述用于其他RBR E3,暗示了RBR E3的激活机制的保守元件。
线粒体表面泛素化
在线粒体损伤的几分钟内,parkin在MOM上被募集和激活,并启动局部底物的泛素化。许多工作都集中在识别响应线粒体损伤的parkin底物上。早期研究确定了几种不同功能的靶标,包括线粒体融合蛋白1(mitfusin 1,MFN1)、MFN2、电压依赖性阴离子选择通道(vltage-dependent anin-selective channel,VDAC)蛋白、线粒体分裂1蛋白(fissin 1 prtein,FIS1)、线粒体导入受体亚基TOM20同源物(mitchndrial imprt receptr subunit TOM20 hmlgue,TOMM20)和CDGSH铁硫结构域含蛋白1(CDGSH irn-sulfur dmain-cntaining prtein 1,CISD1),它们都位于MOM上。为了鉴定parkin靶点和初级泛素化位点,进行了线粒体去极化后的定量diGLY捕获蛋白质组学。在许多MOM蛋白的细胞质结构域上以及在响应parkin激活而被募集到线粒体的几种细胞质蛋白上发现了泛素化位点(见下文)。
在过表达parkin的HeLa细胞中,线粒体的泛素化分为两个阶段:初始阶段(前两小时),在此期间主要底物是MOM蛋白的胞质结构域,然后是第二阶段,在此期间,定位在线粒体内的一组蛋白成为泛素化的靶点。在存在过表达的parkin的情况下,线粒体去极化可导致MOM断裂,从而可能使内膜蛋白暴露于parkin或其他E3的作用下。然而,目前尚不清楚MOM断裂是否发生在神经元的内源性parkin水平,以及它是否在线粒体自噬中发挥特定作用。
MOM上parkin底物的多样性和parkin内缺乏明显的底物识别元件表明parkin缺乏固有的底物特异性。因此,MOM上底物的身份可能不如组装在指定线粒体自噬底物上的泛素链的密度重要。事实上,如下所述,线粒体自噬受体具有与线粒体上特定类型的泛素链结合的能力。泛素链可以通过泛素上七个赖氨酸残基(Lys6、Lys11、Lys27、Lys29、Lys33、Lys48和Lys63)中每一个的ε-氨基以及其N末端甲硫氨酸残基的α-氨基组装,并且链可以是直链、支链或混合的。不同类型的链连接可以通过特定的泛素结合域(ubiquitin binding dmains,UBDs)来区分,例如在线粒体自噬受体中发现的那些。我们现在知道,在内源性泛素背景下过表达parkin的细胞中,线粒体去极化导致MOM上形成Lys6、Lys11、Lys48和Lys63链连接,并且parkin可以在体外催化这些相同连接的形成,但尚不清楚这些链是如何分布在不同的线粒体底物上的,在每种类型的底物上构建的链有多长,或者可能存在具有混合或支链拓扑结构的链的程度。虽然与单泛素化相反,多泛素化被认为对线粒体自噬受体的募集至关重要,但单泛素化也可能通过作为PINK1磷酸化的靶标而发挥重要作用。
Figure 3. 线粒体去极化反应中parkin活化的前馈机制
线粒体上parkin活化的模型
上述泛素和parkin磷酸化的机制导致了一种模型,其中线粒体损伤促进了快速的泛素链聚合,这是两种平行作用的机制的结果,这两种机制共同产生了正反馈回路(Figure 3)。
一方面,由于PINK1磷酸化预先存在的泛素分子或由parkin构建的链,pSer65-Ub在线粒体上的积累通过与pSer65-Ub的直接相互作用促进了胞浆未磷酸化的parkin的募集(Figure 3Ba)。HeLa细胞中受损线粒体上多达20%的泛素分子在存在催化活性parkin的情况下,在线粒体去极化时以PINK1依赖的方式被磷酸化。parkin–pSer65-Ub相互作用有两个主要后果:它部分激活parkin的泛素连接酶活性约达1000倍,从而促进MOM上的泛素链组装;并且它大大增加了PINK1磷酸化parkin-UBL结构域的速率。使用荧光泛素探针获得了类似的结果,这也表明添加线粒体Rh-GTPase(mitchndrial Rh GTPase,MIRO)作为parkin底物可以进一步提高泛素转移和链聚合的速率。pSer65-Ub与pSer65-parkin的结合比未磷酸化的parkin强约20倍,因此有利于在受损MOM上保留完全活性的pSer65-Parkin。此外,由于与pSer65-Ub结合的pSer65-parkin具有最佳活性(约4400倍活化),其在MOM上的保留促进了泛素链的进一步组装,并为PINK1的磷酸化提供了额外的泛素分子,从而产生了前馈机制(Figure 3)。
另一方面,parkin可以被MOM上的PINK1直接磷酸化和激活(独立于其与pSer65-Ub的初始相遇),以局部产生泛素链(Figure 3Bb),泛素链成为PINK1将更多pSer65-parkin募集到MOM的底物,从而用作初始扩增步骤。泛素链磷酸化在前馈过程中的重要性通过观察到表达不能磷酸化的泛素突变形式(泛素Ser65Ala)的细胞在MOM蛋白上表现出泛素链合成减少、parkin向MOM的募集显著减少、线粒体自噬率降低而得到强调。当parkin在其PINK1磷酸化位点(parkinSer65Ala)发生突变时,泛素结合进一步减少,这与parkin最活跃的形式在其UBL结构域上被磷酸化并与pSer65-Ub结合的发现一致。泛素磷酸化对parkin募集的重要性也通过过表达的Ser65类磷酸化线性四聚泛素链在缺乏PINK1的情况下促进parkin招募的能力得以证明。
对前馈回路有贡献的两种机制的相对重要性尚不清楚。不能结合pSer65-Ub的Parkin突变体未能被募集到线粒体并促进泛素链组装,尽管在被UBL结构域磷酸化激活时仍保持催化活性。这一发现表明,募集和完全的parkin激活需要PINK1磷酸化线粒体上预先存在的泛素(Figure 3)。然而,催化缺陷的parkinCys431Ser突变体不能被检测到募集到去极化的线粒体中,这表明parkin的泛素链合成对于足够的pSer65-Ub在线粒体上积累并将parkin募集到可检测的水平是必要的,至少在所使用的HeLa细胞模型系统中是如此。虽然很明显,parkin与pSer65-Ub的结合加速了其UBL结构域的PINK1依赖性磷酸化,但在线粒体去极化后,与pSer65Ub结合弱了约270倍的parkinHis302Ala突变体仍可以在细胞中的UBL结构区被磷酸化。此外,从帕金森病患者中分离出的几种没有稳定募集到去极化线粒体的parkin突变体,仍然可以被PINK1磷酸化到与野生型parkin相同的程度,这表明PINK1依赖性磷酸化可以在没有与线粒体稳定结合的情况下发生。考虑到所有这些数据,最简单的模型是,极少量的pSer65-Ub——由损伤前已经存在于线粒体上的泛素产生,或由pSer65-parkin局部合成的泛素链产生——对于启动前馈机制是必要的,但不足以完全激活parkin。鉴于前馈过程的机制基础,parkin或PINK1过表达可能有助于该途径的人工激活。在使用parkinSer65Ala的实验中似乎是这样,因为独立研究报告了不同水平的线粒体募集,可能反映了表达水平的差异。由于parkin-Ser65Ala可以在体外与pSer65-Ub结合并被其激活,高水平的parkin-sel65Ala表达和低水平的pSer65-Ub可以人工促进前馈反应。鉴于线粒体泛素链在促进PINK1依赖性parkin激活中的基本作用,通过DUBs进行的泛素链分解可以减少启动前馈过程的可用线粒体泛素,这并不奇怪(Bx 3)。最近的研究已经确定了E3泛素蛋白连接酶HUWE1在线粒体上形成Lys6泛素链中的作用,并且TOMM20上的这些类型的链被线粒体DUB USP30去除(Bx 3)。因此,HUWE1可以控制线粒体上的基础泛素水平,该基础泛素可以参与parkin激活(Figure 3Ba)。未来的一个关键问题是如何在空间上控制线粒体自噬。对这个问题的见解来自最近的一项研究,该研究揭示了携带错误折叠基质蛋白的线粒体的“亚结构域”通过PINK1激活和parkin募集到受损亚结构域来启动零碎的线粒体自噬。有趣的是,在这种情况下阻断线粒体分裂增加了线粒体自噬,同时降低了对受损“结构域”的选择性,这表明了一种新的模型,即分裂可保护健康的线粒体区域免受未经检查的PINK1–parkin活性的影响。
帕金森病患者的基因突变
通过对患者基因组进行测序,在PRKN基因中发现了许多突变,这些突变跨越了蛋白质的所有结构域。这一parkin突变蛋白的功能分析为这种形式的帕金森病背后的缺陷细胞机制提供了重要的见解,结果与多种结构元素有助于parkin活性的假设一致。
也许parkin突变体最显著的特征是,大多数突变体在线粒体的募集方面存在缺陷。鉴于parkin依赖性泛素链组装对于parkin向线粒体的稳定募集是必要的,单个parkin突变体无法被募集可能是由于缺乏催化活性或无法保留在MOM上,例如通过与pSer65-Ub结合的缺陷。例如,parkin-Lys161Asn和parkin-Lys211Asn突变体在Ser65磷酸化、pSer65-Ub依赖性激活和募集到受损线粒体的内在激活方面存在严重缺陷,尽管它们能够在体外与Lys63连接的pSer65-Ub链结合。因此,在患者中鉴定的这些和其他parkin突变体可能主要在支持前馈机制的步骤中存在缺陷。这一医学研究领域的一个主要问题是,是否有可能设计出针对突变parkin蛋白的小分子,并通过将其锁定在活性构象中来恢复其催化活性。parkin在活化过程中经历多种构象变化的发现(Figure 2)为鉴定结合并稳定一种或多种活性形式的小分子提供了几个机会。稳定PINK1下游野生型parkin活性形式的小分子也有可能促进帕金森病中受损线粒体的去除,这些线粒体在遗传上与parkin和PINK1无关。
Figure 4. 线粒体自噬受体募集和激活的原理
解码有丝分裂的泛素链
parkin在受损线粒体上组装泛素链启动了泛素链结合自噬受体的解码过程(Figure 4)。这些受体包括SQSTM1、BRCA1基因1蛋白(BRCA1 gene 1 prtein,NBR1)、OPTN、钙结合和含有卷曲螺旋结构域的蛋白2(calcium-binding and ciled-cil dmain-cntaining prtein 2,CALOCO2;也称为NDP52)和Tax1结合蛋白1(Tax1binding prtein 1,TAX1BP1),含有C末端UBD和短疏水序列(称为LC3相互作用区(LC3interacting regin,LIR))(Figure 4a),其可以与ATG8蛋白结合,从而通过典型的自噬机制潜在地促进自噬体膜的募集(Figure 1,4b)。
SQSTM1以parkin依赖的方式被募集到去极化的线粒体,但在迄今为止检测的大多数细胞系中,它不是线粒体自噬所必需的。相反,线粒体聚类需要SQSTM1。缺乏OPTN、CALCOO2和TAX1BP1但仍表达SQSTM1和NBR1的HeLa细胞在线粒体自噬中存在缺陷,其中最显著的缺陷表现在缺乏OPTN的细胞中。这些数据表明受体之间存在一定程度的功能冗余,个体在个体细胞类型中的相对贡献,而不是本质上不同的活性。事实上,几种受体的表达是组织特异性的,这对疾病有影响,因为它们可能只在特定的细胞谱系中发挥作用并影响特定的细胞。例如,有明确证据表明,SQSTM1在体内小鼠巨噬细胞和由于高水平的氧化磷酸化而进行线粒体自噬的小鼠胚胎成纤维细胞中的parkin依赖性线粒体自噬中发挥重要作用。
研究的主要焦点是了解哪些类型的泛素链被自噬受体识别。用精氨酸取代泛素中的Lys6或Lys63,精氨酸不能与泛素结合,与仅导致轻微减少的Lys11取代相比,降低了线粒体自噬率。Lys6Arg或Lys48Arg和Lys63Arg泛素突变体的过表达也抑制线粒体自噬。此外,在测试的突变体中,泛素-Lys11Arg的过表达最大程度地减少了线粒体自噬(减少约50%)。这种差异的原因尚不清楚,但可能反映了泛素-Lys11Arg对parkin合成泛素链的间接影响,这一假设尚未得到验证。在体外,SQSTM1、OPTN和CALOCO2与Lys63链的结合比与Lys48链的结合更有效,这与Lys43链在线粒体自噬中的作用一致,尽管其他链类型尚未进行系统测试。
在过表达parkin的HeLa细胞中,线粒体上约20%的泛素分子在去极化时被磷酸化,这一发现引发了这种修饰是否在线粒体自噬受体的募集中发挥直接作用的问题。事实上,人工靶向线粒体的PINK1过表达在没有parkin的情况下促进了OPTN的募集和线粒体自噬,尽管与存在parkin活性时相比具有广泛的延迟和较低的效率。尽管这些观察结果得出结论,pSer65-Ub是OPTN和其他自噬受体的受体,但其他数据表明,线粒体上未磷酸化形式的泛素偶联物具有募集自噬受体功能(Figure 4c,d)。特别是,体外实验表明,OPTN、CALOCO2和SQSTM1与未磷酸化的Lys63(而不是Lys48)泛素链有效结合,并且这些链在Ser65上的磷酸化(化学计量约为0.7)在很大程度上消除了自噬受体和泛素链之间的直接相互作用。
这些发现与pSer65-Ub直接参与泛素偶联物的解码以促进线粒体自噬不一致。此外,定量蛋白质组学实验表明,在野生型PINK1和parkin存在的情况下,内源性OPTN、SQSTM1、TAX1BP1和CALOCO2募集到受损的线粒体中,但在PINK1−/−HeLa细胞或表达parkinSer65Ala的细胞中没有募集(其未能在线粒体上构建泛素链,但表达活性PINK1)。鉴于PINK1应磷酸化存在于线粒体表面的泛素分子以促进OPTN募集,这些数据表明,在缺乏泛素链组装的情况下,内源性PINK1水平不足以进行受体募集。此外,成像研究表明,pSer65-Ub信号均匀地覆盖受损的线粒体,而线粒体自噬受体被募集到仅覆盖线粒体表面积一小部分的高度局灶性点状,表明与线粒体结合的pSer65-Ub不足以直接募集自噬受体,而需要额外的信号将受体引导到这些焦点。
需要进一步的研究来确定使线粒体自噬受体能够解码泛素链的信号。根据结构数据,Lys63链中至少有两个泛素分子是与OPTN中发现的ABIN和NEMO模块的泛素结合结构域(ubiquitin binding dmain in ABINs and NEMO,UBAN)结合所必需的。如何优化泛素链长度,为parkin募集到pSer65-Ub提供足够的位点,以及两个或多个泛素分子的足够偶联物,以支持自噬受体募集,目前尚不清楚。
TBK1促进线粒体自噬
自噬受体的一个共同特征是它们与激酶TBK1相互作用的能力。通过异种吞噬检测肠道沙门氏菌转化的早期研究表明,TBK1可以磷酸化OPTN中LIR基序附近的丝氨酸残基,并且这种磷酸化促进OPTN与ATG8蛋白的结合以增加异种吞噬。目前已知,TBK1是依赖泛素结合自噬受体的多种类型的选择性自噬所必需的,当过表达时,它可以磷酸化OPTN、TAX1BP1、CALCOO2和SQSTM1。
TBK1最清楚的作用是在线粒体自噬和异种自噬过程中调节OPTN。TBK1磷酸化OPTN中UBAN基序内部和附近的残基,以增加其对未磷酸化的Met1、Lys48和Lys63链的亲和力(Figure 4c-e)。有趣的是,正反馈机制控制OPTN的TBK1依赖性磷酸化(Figure 4e)。TBK1响应线粒体去极化磷酸化OPTN的能力取决于OPTN与泛素链的结合(Figure 4c,e)。小分子抑制剂对TBK1活性的抑制或TBK1的缺失减少了OPTN向受损线粒体的募集,表明TBK1活性是OPTN与泛素链结合所必需的。重要的是,被TBK1磷酸化的OPTN中丝氨酸残基的突变减少了其与受损线粒体和TBK1依赖性激活的关联,从而延迟了线粒体自噬。反过来,OPTN与泛素链的结合是TBK1在Ser172上磷酸化所必需的,从而激活其激酶活性。这些发现揭示了通过线粒体自噬有效清除缺陷线粒体所需的另一个关键前馈回路(Figure 4e)。
要充分理解这一途径,还有几个问题需要解决。首先,响应OPTN与线粒体泛素链的结合,TBK1是通过什么机制激活的?阻止反式自身激活的TBK1小分子抑制剂未能通过Ser172上的磷酸化阻断其激活,这表明可能涉及一种或多种额外的激酶。其次,目前尚不清楚TBK1对自噬受体CALCOO2或TAX1BP1的磷酸化是否也增加了它们对泛素链的亲和力。OPTN和SQSTM1的UBDs上的磷酸化增加了它们对泛素链的亲和力,这表明类似的机制调节其他受体。第三,目前尚不清楚TBK1除了受体磷酸化之外是否还有其他功能。在这方面,研究表明,缺乏C端自噬受体结合结构域的TBK1与来自OPTN的UBD和其他蛋白质的融合可以挽救TBK1缺失细胞中肠道沙门氏菌的清除。然而,TBK1激酶活性在沙门氏菌感染细胞中的作用仍然未知,可能涉及泛素结合货物受体以外的蛋白质的磷酸化。
最后,在ALS和额颞叶痴呆患者中,TBK1和OPTN(而不是parkin或PINK1)可能发生突变,这些突变会影响TBK1-OPTN的相互作用。这表明,TBK1–OPTN驱动的选择性自噬形式,可能涉及受损线粒体以外的货物,可能对运动神经元和可能的其他神经元细胞类型的健康很重要。
ATG8蛋白在线粒体自噬中的进化作用
线粒体自噬的典型模型假设,自噬受体向泛素化线粒体的募集导致自噬体膜前体向线粒体表面的募集,并随后被自噬体吞噬受损的线粒体(Figure 1,4b)。这种募集预计通过OPTN或CALCOO2中的LIR元件与生长中的自噬体内的ATG8蛋白的结合而发生。然而,ATG8受体识别的经典模型并不能解释最近的研究报告,即缺乏所有六种ATG8蛋白的人类细胞仍然能够在受损的线粒体周围构建自噬体。因此,这种形式的选择性自噬似乎不需要自噬受体中LIR序列与ATG8蛋白的典型结合(Figure 4b)。此外,缺乏ATG8结合系统的细胞仍然支持饥饿诱导的大量自噬的显著(约30%)通量,自噬体闭合频率降低,与溶酶体融合后自噬体内膜破裂率降低。因此,某些类型的自噬货物的捕获可能独立于ATG8–LIR相互作用。这种ATG8偶联无关形式的选择性自噬可能涉及自噬受体或相关TBK1中不同序列与自噬体机制的相互作用(Figure 4b)。然而,ATG8蛋白和ATG8脂质化机制是线粒体自噬流所必需的,它们的缺失与溶酶体与自噬体融合的缺陷有关。
最近的研究提出了抑制蛋白2(prhibitin 2)的作用,它是一种鲜为人知的线粒体内膜蛋白,是线粒体的自噬受体,通过与ATG8蛋白直接相互作用发挥作用。鉴于所提出的与ATG8的直接结合,目前尚不清楚prhibitin 2是否在诱导线粒体自噬中发挥独立于泛素结合途径的作用。此外,如果prhibitin 2是所提出的直接自噬受体,那么缺乏OPTN、CALOCO2和TAX1BP1的细胞为什么不能进行自噬尚不清楚。需要进一步的研究来了解何时需要LIR–ATG8相互作用,并了解泛素结合线粒体自噬受体和prhibitin 2之间的任何相互作用。在这方面,多个prhibitin 2泛素化位点以parkin依赖性和PINK1依赖性的方式检测到,并且相对于大多数主要的parkin靶标以动力学延迟的方式检测,这与MOM断裂后发生的泛素化一致。
parkin功能与抗原递呈的耦合
虽然了解parkin和PINK1在疾病中的作用的大部分努力都集中在通过线粒体自噬去除线粒体上,但parkin也可以抑制线粒体衍生抗原的呈递,这表明parkin和PINK1突变患者的帕金森病有一种新的自身免疫机制。
在巨噬细胞、树突状细胞以及成纤维细胞中,parkin通过泛素依赖性分选nexin 9(SNX9)的周转抑制热应激和脂多糖(lipplysaccharide,LPS)依赖性线粒体抗原的产生,该蛋白是parkin非依赖性产生线粒体衍生囊泡(mitchndrial-derived vesicles,MDVs)所需的蛋白质。在缺乏parkin的情况下,MDVs将线粒体内容物转移到内体中,肽最终出现在主要的组织相容性复合体I类分子上。这导致T细胞靶向抗原呈递细胞。这些数据表明,一种可能导致帕金森病的非细胞自主机制,即细胞毒性T细胞活性促进多巴胺能神经元的丧失。有趣的是,LPS在Prkn−/−小鼠中诱导多巴胺能神经元的选择性损失,增加了年龄依赖性神经炎症可能是人类神经元损失的基础的可能性。对该系统以及parkin选择性降解SNX9以促进其蛋白酶体周转以阻断MDVs产生的途径的进一步探索可能为parkin功能提供一种新的范式。
结论和未来问题
Parkin依赖性线粒体自噬为理解泛素链合成与自噬受体募集的分子机制提供了一种范式,自噬受体是诱导线粒体自噬和可能的其他类型的细胞器自噬所必需的。
Parkin的独特之处在于,它是已知唯一一种通过与pSer65-Ub结合而被激活的泛素连接酶。有趣的是,parkin可能已经进化到只有在pSer65-Ub存在的情况下才能发挥作用。PINK1是唯一已知的Ser65泛素激酶,尽管pSer65Ub也存在于芽酵母中,该酵母缺乏明显的PINK1同源物。因此,线粒体自噬是唯一被发现的parkin激活的信号系统。在发现parkin被PINK1和pSer65-Ub激活之前,已经报道了大量的候选parkin底物,但实际上这些研究都没有检测到现在所理解的parkin的活性形式。因此,在parkin参与的其他信号通路中,是否存在可以磷酸化parkin和/或泛素的替代蛋白激酶尚不清楚。有趣的是,在PINK1无效细胞中可以在非常低的水平检测到pSer65-Ub,这表明存在额外的Ser65-泛素激酶。此外,parkin是从哺乳动物细胞中异种吞噬去除结核分枝杆菌所必需的,但这种功能显然独立于PINK1,这表明parkin对这种形式的异种吞噬的激活可能涉及不同的激酶信号通路。探索其他促进pSer65-Ub的信号可能会对帕金调节的信号通路产生新的见解。
目前对pSer65-Ub在动物身上的理解是有限的。在缺乏parkin的小鼠的脑组织中,pSer65-Ub在POLG突变后增加,POLG编码线粒体DNA聚合酶γ催化亚基,由于呼吸链组装缺陷导致线粒体应激。此外,使用特异性抗体可以在人脑中检测到pSer65-Ub,并且在有限的患者样本中,该信号随着年龄和疾病的增加而增加,但当PINK1突变时,该信号不存在。因此,要了解正常和致病条件下的pSer65-Ub通路,仍需做大量工作。激活PINK1以促进胚胎和造血干细胞中parkin功能的信号仍有待鉴定(Bx 1)。
自2014年发现pSer65Ub以来,对parkin激活机制和pSer65‐Ub作用的理解迅速发展,但仍有几个问题尚未解决。对pSer65Ub和parkin磷酸化如何修饰parkin结构以完全激活其链组装功能没有明确的了解。目前具有pSer65-Ub的结构仍然具有一些自身抑制成分,这些成分可能在完全激活后被去除。另外一个问题是parkin最初是如何遇到PINK1的。在从去极化细胞分离的TOM复合物上,Parkin似乎没有与激活的PINK1形成稳定的复合物,这表明如果Parkin的初始激活发生在PINK1-TOM复合物的背景下,这种相互作用是短暂的。PINK1–parkin复合物的结构分析可能会阐明这个问题。此外,尚不清楚特异性蛋白磷酸酶是否作用于pSer65-parkin或pSer65-Ub,从而可能提供除DUBs外的第二个需要克服的阈值(Bx 3)。
由于该途径中的大多数研究都使用了parkin或PINK1过表达的细胞,这可能会影响前馈系统的振幅和持久性,因此我们不完全了解该途径中各个步骤的时间顺序,以及线粒体上存在的泛素在损伤前的PINK1依赖性磷酸化与直接激活parkin的相对重要性,例如在有丝分裂后神经元中。MOM上预先存在的泛素水平可能是细胞类型依赖性的,或由与线粒体动力学相关的不同线粒体E3调节,如NFKB 1的线粒体泛素连接酶激活剂(MUL1)或E3泛素蛋白连接酶MARCH5,从而直接促进前馈启动机制。或者,USP30或其他DUB可以用于控制MOM上预先存在的泛素的丰度(Bx 3)。了解parkin激活所需的生化步骤可能有助于在parkin本身或PINK1中的疾病等位基因的背景下识别能够促进parkin激活的分子。
最后,直到最近才发现parkin与线粒体抗原呈递之间的联系。这种联系为parkin提供了一种全新的调节功能,可能通过潜在的自身免疫机制为PINK1或parkin突变的帕金森病患者的神经元命运提供关键见解。根据目前的模型,当处于应激状态时,携带parkin突变的抗原呈递细胞会产生MDVs,使线粒体衍生的抗原能够呈递到细胞表面并随后激活T细胞。在其表面呈递线粒体衍生抗原的神经元随后可以被线粒体抗原特异性T细胞识别,从而触发细胞毒性反应,最终通过自身免疫型机制导致神经元死亡。主要问题涉及与线粒体抗原呈递相关的应激源下游信号如何与parkin和PINK1激活偶联,抗原呈递细胞中的parkin激活在多大程度上与典型的线粒体自噬系统解耦,以及parkin如何选择性地识别SNX9进行泛素化以抑制线粒体抗原呈递。此外,了解体内细胞类型是至关重要的,其中该途径是活性的,从而可能被细胞毒性T细胞靶向。表达线粒体自噬流报告子的小鼠的可用性将极大地促进对线粒体自噬的空间和时间控制以及PINK1-parkin系统在广泛组织中的遗传要求的生理学理解。
备课素材知识点:线粒体来源及线粒体置换技术 高中生物学选择性必修三: 这是一份备课素材知识点:线粒体来源及线粒体置换技术 高中生物学选择性必修三,共4页。
备课素材知识点:钠尿肽的调节机理 高中生物人教版选择性必修1: 这是一份备课素材知识点:钠尿肽的调节机理 高中生物人教版选择性必修1,共4页。
备课素材知识点:核受体及作用机理 高中生物人教版选择性必修1: 这是一份备课素材知识点:核受体及作用机理 高中生物人教版选择性必修1,共4页。