新鲁科版2023-2024高一化学必修第一册知识清单
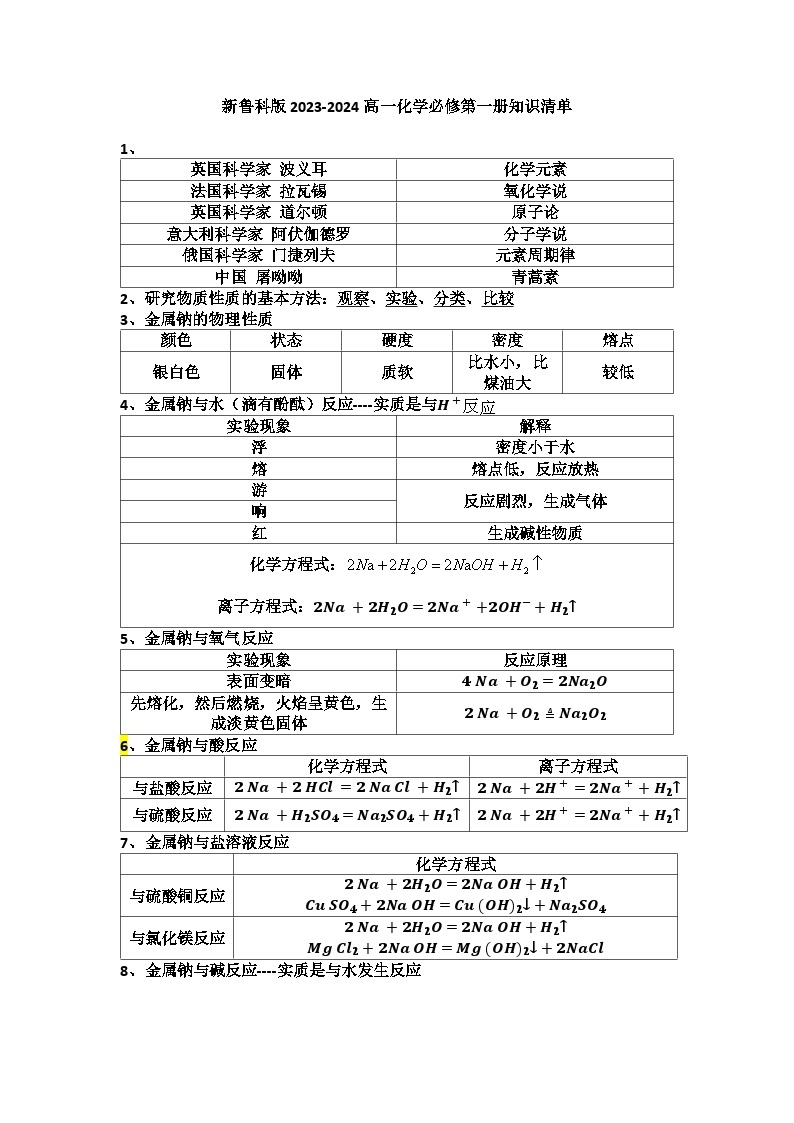
展开1、
英国科学家 波义耳
化学元素
法国科学家 拉瓦锡
氧化学说
英国科学家 道尔顿
原子论
意大利科学家 阿伏伽德罗
分子学说
俄国科学家 门捷列夫
元素周期律
中国 屠呦呦
青蒿素
2、 研究物质性质的基本方法:观察、实验、分类、比较
3、 金属钠的物理性质
颜色
状态
硬度
密度
熔点
银白色
固体
质软
比水小,比煤油大
较低
4、 金属钠与水(滴有酚酞)反应----实质是与H+反应
实验现象
解释
浮
密度小于水
熔
熔点低,反应放热
游
反应剧烈,生成气体
响
红
生成碱性物质
化学方程式:
离子方程式:2Na+2H2O=2Na++2OH−+H2↑
5、 金属钠与氧气反应
实验现象
反应原理
表面变暗
4Na+O2=2Na2O
先熔化,然后燃烧,火焰呈黄色,生成淡黄色固体
2Na+O2≜Na2O2
6、金属钠与酸反应
化学方程式
离子方程式
与盐酸反应
2Na+2HCl=2NaCl+H2↑
2Na+2H+=2Na++H2↑
与硫酸反应
2Na+H2SO4=Na2SO4+H2↑
2Na+2H+=2Na++H2↑
7、 金属钠与盐溶液反应
化学方程式
与硫酸铜反应
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
与氯化镁反应
2Na+2H2O=2NaOH+H2↑
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
8、 金属钠与碱反应----实质是与水发生反应
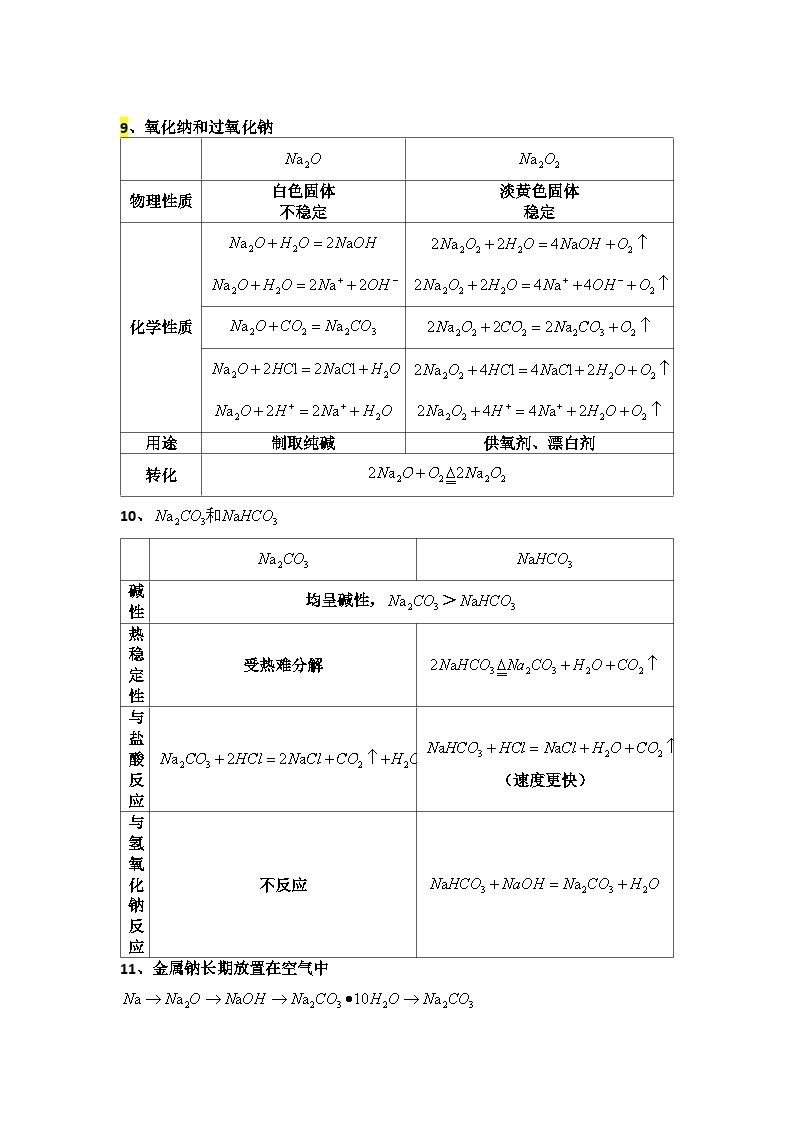
9、氧化纳和过氧化钠
物理性质
白色固体
不稳定
淡黄色固体
稳定
化学性质
用途
制取纯碱
供氧剂、漂白剂
转化
10、
碱性
均呈碱性,>
热稳定性
受热难分解
与盐酸反应
(速度更快)
与氢氧化钠反应
不反应
11、金属钠长期放置在空气中
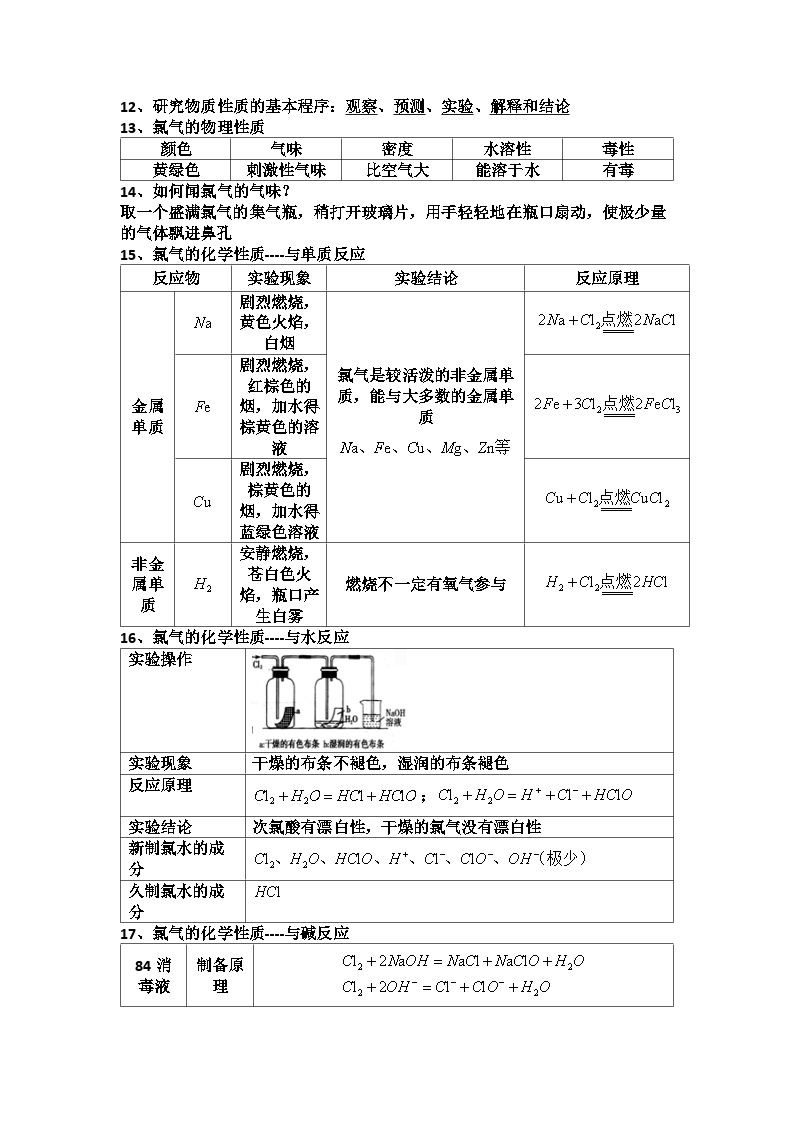
12、研究物质性质的基本程序:观察、预测、实验、解释和结论
13、氯气的物理性质
颜色
气味
密度
水溶性
毒性
黄绿色
刺激性气味
比空气大
能溶于水
有毒
14、如何闻氯气的气味?
取一个盛满氯气的集气瓶,稍打开玻璃片,用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔
15、氯气的化学性质----与单质反应
反应物
实验现象
实验结论
反应原理
金属单质
剧烈燃烧,黄色火焰,白烟
氯气是较活泼的非金属单质,能与大多数的金属单质
剧烈燃烧,红棕色的烟,加水得棕黄色的溶液
剧烈燃烧,棕黄色的烟,加水得蓝绿色溶液
非金属单质
安静燃烧,苍白色火焰,瓶口产生白雾
燃烧不一定有氧气参与
16、氯气的化学性质----与水反应
实验操作
实验现象
干燥的布条不褪色,湿润的布条褪色
反应原理
;
实验结论
次氯酸有漂白性,干燥的氯气没有漂白性
新制氯水的成分
久制氯水的成分
17、氯气的化学性质----与碱反应
84消毒液
制备原理
生效原理
84消毒液不能与洁厕灵混用原因
漂白粉
制备原理
漂白原理
失效原理
18、实验室制氯气
①反应原理:(化学方程式)
" ②反应中的氧化剂是,还原剂是浓,n(氧化剂):n(还原剂)=1:2
" 氧化产物是,还原产物是
" 反应中浓盐酸体现的性质有还原性和酸性
(离子方程式)
得到2
③双线桥和单线桥
失去2
2
④实验装置:
19、化学中常用的物理量
n
物质的量
mol
n=
N
微粒数目
-
阿伏伽德罗常数
m
质量
kg/g
n=
M
摩尔质量
气体体积
L/
n=
气体摩尔体积
标况下=22.4L·
溶液体积
L/
n=
物质的量浓度
20、阿伏伽德罗定律
21、各物质的物理量在化学方程式中的关系
系数比 a b c d
物质的量比 a b c d
22、配制一定物质的量浓度的溶液
(1) 固体--以配制98ml0.4mol·的溶液为例
实验仪器:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、胶头滴管、100ml容量瓶
配制过程:①计算m=cv·M=0.4mol·×0.1L×58.5g·=2.3g
②称量 ③溶解 ④转移/移液 ⑤洗涤
⑥定容 ⑦摇匀 ⑧装瓶贴标签
(2) 液体--用质量分数为98%,密度为1.84g·的浓硫酸配制480ml0.5mol·的稀硫酸
实验仪器:量筒(精确到0.1ml)、烧杯、玻璃棒、胶头滴管、500ml容量瓶
配制过程:①计算=18.4mol
②量取(量筒使用完后不需要洗涤) ③溶解、冷却 ④转移/移液 ⑤洗涤 ⑥定容 ⑦摇匀 ⑧装瓶贴标签
23、配制过程中的误差分析
不当操作
称量过程
称量时间过长
↓
左码右物
↓
NaOH放在滤纸上
↓
量筒量取时,俯视
↓
量筒量取时,仰视
↑
配制过程
移液前容量瓶内有少量水
不变
转移液体时有少量溅出
↓
未洗涤
↓
未冷却
↑
定容时,水加多用胶头滴管吸出
↓
定容摇匀后液面低于刻度线再加水
↓
定容时俯视
↑
定容时仰视
↓
24、物质分类
分散质微粒直径1~100nm(本质区别)
溶液
碱
盐
电解质
非电解质
能透过滤纸,不能透过半透膜(渗析法分离胶体和溶液)
混合物
丁达尔现象(鉴别胶体和溶液)
胶体
分散质微粒直径1~100nm
电泳(胶体不带电,胶粒带电)
性质
聚沉(加热、搅拌、加电解质、加带相反电荷的胶粒)
制备:用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,像烧杯中逐滴加入饱和溶液,至液体呈透明的红褐色
浊液
金属单质
强酸
单质
非金属单质
强碱
强电解质
盐
碱
酸
绝大多数的盐
氧化物
纯净物
弱酸⇌
电解质
化合物
弱碱⇌
弱电解质
是否导电
水
非金属氧化物
非电解质
大部分有机物
25、离子方程式的书写
①写出正确的化学方程式
②强酸、强碱、可溶性的盐拆成离子形式
③删掉等号左右两边相同的离子
④系数最简
⑤检查电荷守恒、原子守恒
26、离子共存
(1)生成难溶或微溶物质:Ca2+与CO32−、SO42−、SO32−不能大量共存
Ba2+与CO32−、SO42−、SO32−不能大量共存
Ag+与Cl−、CO32−、SO42−不能大量共存
OH−与Mg2+、Cu2+、Fe3+、Fe2+、Ca2+不能大量共存
(2)生成气体:H+与CO32−、HCO3−、SO32−、HSO3−、S2−、HS−不能大量共存
(3)生成难电离的物质:H+与OH−、CH3COO−; OH−与NH4+不能大量共存
27、离子检验
氯离子→硝酸酸化的硝酸银→白色沉淀产生
硫酸根离子→稀盐酸,无明显现象→氯化钡溶液,产生白色沉淀
碳酸根离子→氯化钡溶液/氯化钙溶液,白色沉淀产生→稀盐酸,产生无色无味使澄清石灰水变浑浊的气体
铵根离子→氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
28、食盐精制
除杂试剂:碳酸钠、氢氧化钠、氯化钡、稀盐酸
添加顺序:碳酸钠在氯化钡之后加;稀盐酸在碳酸钠和氢氧化钠之后加
29、氧化还原反应
(1)实质:电子转移
(2)特征:化合价的升降
(3)结论:化合价升高→失电子→氧化反应→还原剂→还原性→被氧化→得到氧化产物
化合价降低→得电子→还原反应→氧化剂→氧化性→被还原→得到还原产物
(4)表示方法:单线桥和双线桥
Eg:写出Cu与浓硫酸反应的化学方程式,分别用双线桥和单线桥表示电子转移的方向和数目
_____________________________________________________________________
_____________________________________________________________________
(5)置换反应一定是氧化还原反应
复分解反应一定不是氧化还原反应
分解反应、化合反应可能是氧化还原反应
30、常见的氧化剂和还原剂
氧化剂:O2、Cl2、Fe3+、H2O2、Na2O2、HNO3、KMnO4
还原剂:活泼金属、Fe2+、H2、CO、H2S、S2−、
31、氧化还原反应的规律
(1)氧化性①氧化剂>氧化产物
②不同的氧化剂与同一还原剂反应,反应越易进行则对应的氧化剂的氧化性越强
【二氧化锰与浓盐酸在加热的条件下反应,高锰酸钾与浓盐酸在常温下反应→高锰酸钾的氧化性大于二氧化锰】
③同一物质在相同条件下,被不同氧化剂氧化的程度越大,对应氧化剂的氧化性越强
【铁和硫反应生成+2价的硫化铁,铁和氯气反应生成+3价的氯化铁→氯气的氧化性大于硫】
还原性①还原剂>还原产物
②不同还原剂与同一氧化剂反应,反应越易进行则对应的还原剂的还原性越强
③同一物质在相同条件下,被不同还原剂还原的程度越大,对应还原剂的还原性越强
(2)元素化合价处于最低价时,只具有还原性
元素化合价处于最高价时,只具有氧化性
元素化合价处于中间价时,既具有氧化性又具有还原性
(3)根据得失电子守恒和元素守恒进行化学方程式的配平
(4)只有一种元素化合价升降遵循价态归中规律→“两头变中间,只靠拢不交叉”
【】
32、金属的冶炼
热还原法:大多数中等活泼金属(金属活动性顺序表出去前5后4)→eg CO还原Fe2O3
金属置换法
电解法:活泼金属(金属活动性顺序表表前5)→熔融氧化铝通电制金属铝
热分解法:不活泼金属(金属活动性顺序表后4)→加热分解氧化汞制金属汞
33、
----
34、
35、
加入碱溶液
白色沉淀→灰绿色沉淀→红褐色沉淀
红褐色沉淀
无明显现象
(再滴加氯水溶液变红)
溶液变红
酸性高锰酸钾
紫红色褪去
无明显现象
36、含铁物质的分离与提纯
过量铁粉后过滤
氯水或双氧水
过量铁粉后过滤
37.单质铁的物理性质:纯净的铁单质的银白色,生活中见到的铁是黑色,能被磁铁吸引(钴、镍也能被磁铁吸引)
38.铁的氧化物的物理性质
FeO
Fe2O3
Fe3O4
俗名
/
铁红/铁锈主要成分
磁性氧化铁
颜色状态
黑色粉末
红棕色粉末
黑色晶体
水溶性
难溶
化合价
+2
+3
+2、+3
分类
碱性氧化物
碱性氧化物
/
39.铁的氢氧化物的物理性质:Fe(OH)2是白色固体Fe(OH)3是红褐色固体
40.铁元素的价类二维图及重要反应
点燃
3Fe+2O2===Fe3O4
点燃
高温
3Fe+4H2O(g)===Fe3O4+4H2[先撤导管再移酒精灯]
2Fe+3Cl2====2FeCl3
Fe+2HCl=FeCl2+H2↑ FeO+2HCl=FeCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O Fe3O4+8H+=3Fe3++Fe2++4H2O
Fe(OH)3+3H+=Fe3++3H2O Fe(OH)2+2H+=Fe2++2H2O
Fe3++3OH-=Fe(OH)3↓ Fe2++2OH-=Fe(OH)2↓
2FeCl2+Cl2=2FeCl3[Fe3++Cl2=2Fe3++2Cl-]
2FeCl3+Fe=3FeCl2 [2Fe3++Fe=3Fe2+]
2FeCl3+Cu=2FeCl2+CuCl2 [2Fe3++Cu=2Fe2++2Cu2+]
2Fe(OH)3≜Fe2O3+3H2O
Fe(OH)2≜FeO+H2O 4Fe(OH)2+O2≜2Fe2O3+4H2O
高温
高温
4Fe(OH)2+O2+2H2O=4Fe(OH)3
高温
高温
Fe2O3+3CO===2Fe+3CO2 FeO+H2===Fe+H2O
3Fe3O4+8Al===9Fe+4Al2O3 2Al+ Fe2O3====2Fe+Al2O3
[铝热反应:Al+比Al不活泼的金属氧化物,放出大量的热,可用于野外焊接铁轨]
41.制备氢氧化亚铁:隔绝氧气
42.单质硫的物理性质
颜色
黄色或淡黄色
状态
固体
溶解性
不溶于水,微溶于酒精,易溶于CS2
同素异形体(转化是化学变化)
正交硫,单斜硫,斜方硫
【硫元素的价类二维图】
43.单质硫的化学性质
1)氧化性
S+Fe≜FeS 实验现象:剧烈燃烧,发光发热,生成黑色固体
S+2Cu≜Cu2S
【微点拨:硫与变价金属反应一般生成高价态氯化物,氯气与变价金属反应生成高价态氯化物】
点燃
2)还原性:S+O2===SO2 [该反应与氧气的量没有关系,产物只能是SO2]
实验现象:空气中,安静燃烧,淡蓝色火焰;纯氧中,剧烈燃烧,明亮的蓝紫色火焰
3)既表现氧化性也表现还原性:3S+6NaOH≜2Na2S+Na2SO3+3H2O
【清洗沾有硫黄的试管:热的NaOH溶液/二硫化碳】
44.二氧化硫的物理性质
颜色,状态,气味
无色有刺激性气味气体
密度
大于空气
水溶性
易溶于水(1:40)
毒性
有毒(尾气处理)
45.SO2的化学性质
催化剂
1)还原性【气体体系:SO2→SO3;溶液:SO2→SO42-】
∆
①2SO2+O2⇌2SO3
②SO2+Cl2+2H2O=H2SO4+2HCl 实验现象:褪色
③SO2+Br2+2H2O=H2SO4+2HBr 实验现象:褪色
④SO2+I2+2H2O=H2SO4+2HI 实验现象:褪色
⑤酸性高锰酸钾溶液褪色
2)氧化性:SO2+2H2S=3S↓+2H2O 实验现象:产生淡黄色沉淀
3)漂白性:品红溶液褪色,加热后溶液恢复红色
【氯气和二氧化硫同时通入品红溶液,不褪色】
4)酸性氧化物的性质
SO2+H2O⇌H2SO3 SO2+NaOH=Na2SO3+H2O SO2+CaO=CaSO3
4)实验室制二氧化硫:Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O(强酸制弱酸)
46.稀释浓硫酸:把浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中,不断用玻璃棒搅拌,以防飞溅
47.检验SO42-:向溶液中加入稀盐酸酸化,无明显现象,再加入氯化钡溶液,有白色沉淀生成
48.硫酸的物理性质:纯硫酸是一种无色,粘稠,油状液体,是一种难挥发性酸(沸点高),密度大,易溶于水
49.浓硫酸的化学性质
1)强氧化性【浓硫酸→SO2】
①Cu+2H2SO4(浓)≜CuSO4+SO2↑+2H2O
[浓硫酸表现氧化性和酸性,氧化剂:还原剂=1:1]
②Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
③常温下浓硫酸会使Fe,Al表面生成一层致密的氧化膜而钝化,所以可以用铁罐车或铝罐车运输冷的浓硫酸【钝化≠不反应】
④C+2H2SO4(浓)≜CO2↑+2SO2↑+2H2O
[浓硫酸表现氧化性,氧化剂:还原剂=2:1]
2)脱水性:将有机物中的H,O元素按原子个数比2:1的比例夺走,形成水
[蔗糖遇浓硫酸C12H22O11→11H20+12C C+2H2SO4(浓)≜CO2↑+2SO2↑+2H20]
3)吸水性:将物质本身的游离水或结合水吸收
催化剂
[做干燥剂:除碱性气体(NH3)和还原性气体(H2S,HBr,HI)] [使胆矾由蓝变白]
50.硫酸型酸雨的形成
∆
[2SO2+O2⇌2SO3 SO3+H2O=H2SO4] [SO2+H2O⇌H2SO3 2H2SO3+O2=2H2SO4]
51.pH<5.6的降水属于酸雨,收集到的酸雨样品一段时间后酸性会增强,原因是:2H2SO3+O2=2H2SO4
52.工业制硫酸
高温
点燃
催化剂
4FeS2+11O2===2Fe2O3+8SO2 或(S+O2===SO2)
∆
2SO2+O2⇌2SO3 SO3+H2O=H2SO4
53.氮气的物理性质
颜色
气味
状态
溶解性
密度
无色
无味
气体
难溶于水
略小于空气(不能用排空气法收集)
高温
放电
54.氮气的化学性质
N2+O2===2NO或N2+O2===2NO
点燃
催化剂
高温、压
N2+3H2⇌2NH3 【工业制氨气】 N2+Mg===Mg3N2
55.氮的固定:游离态的氮(N2)转化为含氮化合物
56.氮的氧化物的物理性质
颜色
气味
密度
溶解性
毒性
NO
无色
无味
略大于空气
不溶于水
有毒(处理尾气)
NO2
红棕色
刺激性
大于空气
与水反应
有毒(处理尾气)
57.氮的氧化物的化学性质
2NO+O2=2NO2【检验一种无色气体为一氧化氮】
4NO+3O+2H2O=4HNO3
3NO+H2O=2HNO+NO
3NO2+H2O=2HNO3+NO【工业制硝酸】
58.尾气处理NO,NO2
59.NH3的物理性质
颜色
气味
状态
密度
水溶性
无色
刺激性
气体
小于空气
极易溶于水【防倒吸】
60.NH3的喷泉实验
实验现象:圆底烧瓶内产生红色喷泉
⇌
实验结论:氨气极易溶于水,与水反应生成了碱性物质
∆
NH3·H2O⇌NH4++OH-
NH3·H2O=NH3↑+H2O
实验原理:烧瓶内外产生了压强差(气体反应或溶解)
61.NH3的化学性质
1)与酸反应【与挥发性的酸反应生成白烟】
NH3+HCl=NH4Cl [白烟生成] NH3+HNO3=NH4NO3 [白烟生成]
NH3+H2SO4=(NH4)2SO4
高温
2)氨的还原性:
催化剂
4NH3+5O2====4NO+6H2O
(氨气过量)
62.NH3的快速制法
63.NH3的实验室制法
反应原理:2NH4Cl+Ca(OH)2≜CaCl2+2NH3↑+2H2O
收集方法:向上排空气法
检验/验满:①湿润的红色石蕊试纸变蓝
②蘸有浓盐酸的玻璃棒产生白烟
注意事项:反应试管口朝下,导管伸到试管底部
棉花的作用:防止氨气沿试管壁冲出,收集到纯净的氨气
干燥装置:
【碱石灰→NaOH+CaO】
尾气处理装置【注意防倒吸】
漏斗式
64.铵盐:NH4+和酸根离子构成的盐,易溶于水的白色晶体
65.铵盐的化学性质
NH4++OH-(稀)=NH3∙H2O NH4++OH-(浓)=NH3↑+H2O
NH4++OH-≜NH3↑+H2O 【铵态氮肥不能与草木灰混用】
66.检验NH4+的方法:取少许待测液或晶体置于小试管中,加入浓氢氧化钠溶液,并加热,将湿润的红色石蕊试纸(或者蘸有浓盐酸的玻璃棒)放在试管口,试纸变蓝(或者冒白烟),说明是铵盐或待测液含有NH4+
67.硝酸的物理性质:纯硝酸是一种无色、有刺激性气味,易挥发的酸,质量分数在95%以上的浓硝酸在空气中挥发出硝酸蒸汽,称为发烟硝酸
68.硝酸的化学性质
1)酸性:HNO3=H++NO3-
2)强氧化性【浓HNO3→NO2 稀硝酸→NO】
常温下使Fe、Al钝化
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Ag+2HNO3(浓)=AgNO3+NO2+H2O
C+4HNO3(浓)≜4NO2↑+CO2↑+2H2O
漂白性:使紫色石蕊示剂先变红再变无色
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O Fe+2Fe(NO3)3=3Fe(NO3)2
3)不稳定性:4HNO3≜4NO2↑+O2↑+2H2O
【工业浓硝酸一般为黄色,保存浓硝酸避光棕色瓶】
69.氮氧化物的危害:光化学烟雾、酸雨、雾霾、NO2破坏臭氧层、NO结合血红蛋白、水体富营养化








