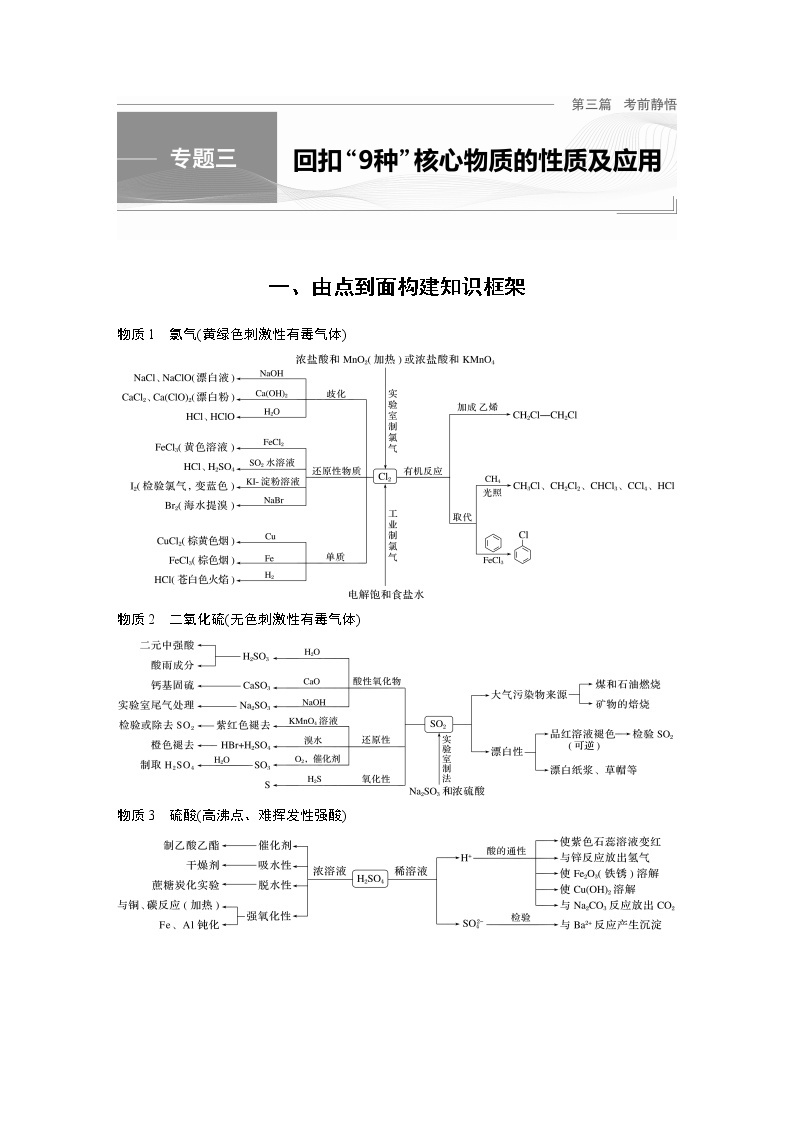
一、由点到面构建知识框架物质1 氯气(黄绿色刺激性有毒气体)物质2 二氧化硫(无色刺激性有毒气体)物质3 硫酸(高沸点、难挥发性强酸)�物质4 氨气(无色刺激性气体)物质5 硝酸(无色易挥发性强酸)物质6 二氧化硅(熔点高、硬度大、不溶于水的酸性氧化物)物质7 碳酸钠和碳酸氢钠物质8 铝的化合物物质9 铁盐与亚铁盐二、无机物性质必读1.常考无机物的溶解性(1)常见气体溶解性由大到小:NH3(1∶700)、HCl(1∶500)、SO2(1∶40)、H2S(1∶2.6)、Cl2(1∶2)、CO2(1∶1)。极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。极易溶于水的气体尾气吸收时要用防倒吸装置。(2)卤素单质在有机溶剂中比水中溶解度大。(3)硫与白磷皆易溶于二硫化碳。(4)硫酸盐三种不溶(钙、银、钡),氯化物一种不溶(银),碳酸盐只溶钾、钠、铵。(5)固体溶解度大多数随温度升高而增大,少数受温度影响不大(如NaCl),极少数随温度升高而变小[如Ca(OH)2]。气体溶解度随温度升高而变小,随压强增大而变大。2.常考无机物的特征性质(1)焰色试验显黄色的元素是Na,显紫色(透过钴玻璃)的元素是K。(2)有臭鸡蛋气味或能使湿润的Pb(Ac)2试纸变黑的气体是H2S。(3)在空气中由无色迅速变为红棕色的气体是NO。(4)使品红溶液褪色的往往是SO2。(5)能使淀粉溶液变蓝的是I2。(6)与碱溶液反应生成白色沉淀且放置空气中变灰绿色最终变红褐色的离子是Fe2+。(7)滴入含SCN-溶液显红色以及遇苯酚显紫色的离子是Fe3+。(8)投入水中生成气体和难溶物或微溶物的物质是CaC2、Al2S3、Mg3N2 。(9)既能跟强酸溶液反应又能跟强碱溶液反应的物质一般是①金属单质:Al。②两性物质:两性氧化物如Al2O3,两性氢氧化物如Al(OH)3,以及氨基酸等。③弱酸弱碱盐:(NH4)2CO3、CH3COONH4等。④弱酸的酸式盐:NaHCO3、Ca(HCO3)2、NaHSO3等。(10)能使湿润的红色石蕊试纸变蓝的气体是NH3。3.常考具有漂白性的物质(1)氧化型:HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等。利用物质的强氧化性,漂白彻底,不可逆。(2)加合型:SO2、亚硫酸、亚硫酸氢盐和亚硫酸盐与有机色素加成,生成不稳定的无色物质,可逆。(3)吸附型:活性炭,胶体。活性炭疏松、多孔、表面积大,其漂白原理为物理吸附。三、重要方程式再现1.常见金属及其化合物(1)过氧化钠吸收空气中的二氧化碳:________________________________________________________________________。(2)过氧化钠溶于水:________________________________________________________________________。(3)纯碱溶液中通入CO2气体:________________________________________________________________________。(4)电解饱和食盐水:________________________________________________________________________。(5)铝片溶于烧碱溶液:________________________________________________________________________。(6)用AlCl3溶液和氨水制备Al(OH)3:________________________________________________________________________。(7)NaAlO2溶液与NaHCO3溶液混合:________________________________________________________________________。(8)泡沫灭火器的反应原理:________________________________________________________________________。(9)FeCl2溶液中滴加氯水:________________________________________________________________________。(10)用FeCl3溶液腐蚀铜片:________________________________________________________________________。(11)铝热反应(金属氧化物Fe3O4):________________________________________________________________________。(12)镁在二氧化碳中燃烧:________________________________________________________________________。答案 (1)2Na2O2+2CO2===2Na2CO3+O2(2)2Na2O2+2H2O===4NaOH+O2↑(3)Na2CO3+CO2+H2O===2NaHCO3(或CO�eq \o\al(2-,3)��+CO2+H2O===2HCO�eq \o\al(-,3)��)(4)2NaCl+2H2O�eq \o(=====,\s\up7(电解))��Cl2↑+H2↑+2NaOH(或2Cl-+2H2O�eq \o(=====,\s\up7(电解))��Cl2↑+H2↑+2OH-)(5)2Al+2NaOH+2H2O===2NaAlO2+3H2↑(或2Al+2OH-+2H2O===2AlO�eq \o\al(-,2)��+3H2↑)(6)AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl[或Al3++3NH3·H2O===Al(OH)3↓+3NH�eq \o\al(+,4)��](7)NaAlO2+NaHCO3+H2O===Al(OH)3↓+Na2CO3[或AlO�eq \o\al(-,2)��+H2O+HCO�eq \o\al(-,3)��===Al(OH)3↓+CO�eq \o\al(2-,3)��](8)Al3++3HCO�eq \o\al(-,3)��===Al(OH)3↓+3CO2↑(9)2FeCl2+Cl2===2FeCl3(或2Fe2++Cl2===2Fe3++2Cl-)(10)2FeCl3+Cu===2FeCl2+CuCl2(或2Fe3++Cu===2Fe2++Cu2+)(11)3Fe3O4+8Al�eq \o(=====,\s\up7(高温))��9Fe+4Al2O3(12)2Mg+CO2�eq \o(=====,\s\up7(点燃))��2MgO+C2.常见非金属及其化合物(1)实验室用MnO2和浓盐酸制氯气:________________________________________________________________________。(2)用烧碱溶液吸收尾气中的Cl2:________________________________________________________________________。(3)氯水滴入KBr溶液,比较Cl2和Br2的氧化性:________________________________________________________________________。(4)铜片溶于浓硫酸:________________________________________________________________________。(5)SO2使溴水褪色:________________________________________________________________________。(6)将SO2通入H2S溶液中:________________________________________________________________________。(7)SO2型酸雨在空气中放置酸性增强:________________________________________________________________________。(8)CuSO4溶液吸收H2S气体:________________________________________________________________________。(9)实验室用NH4Cl制取氨气:________________________________________________________________________。(10)氨气的催化氧化反应:________________________________________________________________________。(11)铜溶于稀硝酸:________________________________________________________________________。(12)久置浓硝酸变黄:________________________________________________________________________。(13)工业上制取粗硅:________________________________________________________________________。(14)硅酸钠溶液中通入少量CO2:________________________________________________________________________。答案 (1)MnO2+4HCl(浓)�eq \o(=====,\s\up7(△))��MnCl2+Cl2↑+2H2O(或MnO2+4H++2Cl-�eq \o(=====,\s\up7(△))��Mn2++Cl2↑+2H2O)(2)Cl2+2NaOH===NaCl+NaClO+H2O(或Cl2+2OH-===Cl-+ClO-+H2O)(3)2KBr+Cl2===2KCl+Br2(或2Br-+Cl2===Br2+2Cl-)(4)Cu+2H2SO4(浓)�eq \o(=====,\s\up7(△))��CuSO4+SO2↑+2H2O(5)SO2+Br2+2H2O===H2SO4+2HBr(或SO2+Br2+2H2O===4H++SO�eq \o\al(2-,4)��+2Br-)(6)2H2S+SO2===3S↓+2H2O(7)2H2SO3+O2===2H2SO4(或2H2SO3+O2===4H++2SO�eq \o\al(2-,4)��)(8)CuSO4+H2S===CuS↓+H2SO4(或Cu2++H2S===CuS↓+2H+)(9)2NH4Cl+Ca(OH)2�eq \o(=====,\s\up7(△))��CaCl2+2NH3↑+2H2O(10)4NH3+5O2�eq \o(=====,\s\up7(催化剂),\s\do5(△))��4NO+6H2O(11)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(或3Cu+8H++2NO�eq \o\al(-,3)��===3Cu2++2NO↑+4H2O)(12)4HNO3�eq \o(=====,\s\up7(光照))��4NO2↑+O2↑+2H2O(13)SiO2+2C�eq \o(=====,\s\up7(高温))��Si(粗)+2CO↑(14)Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3(或SiO�eq \o\al(2-,3)��+CO2+H2O===H2SiO3↓+CO�eq \o\al(2-,3)��)判断下列说法是否正确,正确的打“√”,错误的打“×”(1)金属及其化合物①金属钠着火,可用泡沫灭火器灭火( )②钠与水和乙醇反应的实质相同( )③Na2O和Na2O2晶体中,阳离子和阴离子的个数比均为2∶1( )④Na2O2是碱性氧化物,因而与SO2反应生成Na2SO4( )⑤氧化铝与NaOH溶液反应可生成Al(OH)3( )⑥相同质量的铝分别溶于足量盐酸、NaOH溶液,转移的电子数相同( )⑦明矾可用于治疗胃酸过多( )⑧红热的铁与水蒸气反应生成Fe2O3和H2( )⑨将FeCl3滴入NaOH溶液,制取Fe(OH)3胶体( )⑩用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2( )⑪铜在干燥的空气中性质稳定,但是在潮湿的环境中则易被锈蚀,生成铜绿( )⑫铜与氯气、氧气、硫分别反应,得到的产物中铜的化合价均为+2价( )⑬无水硫酸铜常被用来检验水蒸气的存在( )⑭铝热反应专指Al与Fe2O3的反应( )答案 ①× ②√ ③√ ④× ⑤× ⑥√ ⑦× ⑧× ⑨× ⑩× ⑪√ ⑫× ⑬√ ⑭×(2)非金属及其化合物①利用高纯度单质硅可以制成太阳能光伏电池( )②制作宇宙飞船的玻璃纤维和玻璃的成分相同( )③ClO2可用作自来水消毒剂( )④燃煤脱硫后,经气化或液化可以转化成清洁能源( )⑤使用“84”消毒液时,滴几滴白醋,能提高漂白效率( )⑥SiO2既能与氢氟酸反应又能与NaOH反应,所以它是一种两性氧化物( )⑦用澄清的石灰水鉴别Na2CO3和NaHCO3( )⑧漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的( )⑨人体不能缺碘,需要正常补碘,“加碘食盐”中的“碘”是指碘单质( )⑩Br2、I2在有机溶剂中的溶解度大于其在水中的溶解度,利用此性质可以用四氯化碳将Br2、I2从其水溶液中萃取出来( )⑪SO2通入Ba(NO3)2溶液产生的白色沉淀是BaSO4( )⑫焊接金属、填充灯泡、贮存粮食、罐头、水果等,常用氮气作保护气以防止氧化或腐烂( )⑬铵盐可作氮肥,贮藏时要密封包装并放在阴凉处,施肥时应埋在土壤下并及时灌水以保证肥效( )⑭将镁条放入氯化铵溶液中有气体放出( )⑮SiO2可以制作电脑芯片( )⑯SO2通入BaCl2溶液有白色沉淀产生( )答案 ①√ ②× ③√ ④√ ⑤√ ⑥× ⑦× ⑧× ⑨× ⑩√ ⑪√ ⑫√ ⑬√ ⑭√ ⑮× ⑯×�