




化学必修 第二册第三节 无机非金属材料精品课时训练
展开第07讲 无机非金属材料
目标导航
课程标准
课标解读
1.了解无机非金属材料的主要性能和用途。
2.了解常见硅酸盐产品的组成。
3.掌握硅酸钠的性质和用途。
4.掌握硅和二氧化硅的性质,了解硅和二氧化硅的用途。
1.能列举、描述、辨识无机非金属材料。
2.能从材料组成的角度对无机非金属材料进行分类,并合理使用。
3.能说明无机非金属材料的应用对社会发展的价值。
知识精讲
知识点01 传统无机非金属材料——硅酸盐材料
1.无机非金属材料
(1)组成元素:多含有硅、氧等元素。
(2)分类:传统无机非金属材料、新型无机非金属材料。
(3)性能:具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。
(4)应用领域:日常生活应用、航空、航天、信息和新能源等领域。
2.传统无机非金属材料——硅酸盐材料
(1)硅酸盐及其结构
①概念:硅酸盐是由硅、氧和金属等元素组成的化合物的总称。
②结构:Si和O构成了硅氧四面体,许多这样的四面体通过顶角的O相互连接。
③特性:硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
(2)常见的硅酸盐材料
项目
陶瓷
玻璃
水泥
主要成分
成分复杂
Na2SiO3、CaSiO3和SiO2
硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
生产原料
黏土
(含水的铝硅酸盐)
纯碱、石灰石、石英砂
主要原料:石灰石、黏土
辅助原料:适量的石膏
主要设备
陶瓷窑
玻璃窑
水泥回转窑
用途
建筑材料、绝缘材料、日用器皿、卫生洁具等
建筑材料、光学仪器、各种器皿、制造玻璃纤维
大量用于建筑和水利工程
【即学即练1】下列物质中,不含硅酸盐的是( )。
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
【解析】选B。硅酸盐指的是硅、氧与其它化学元素结合而成的化合物的总称,陶瓷、玻璃、水泥等都是硅酸盐产品。水玻璃、粘土、普通水泥等含有硅酸盐,硅芯片含有单质硅,不含有硅酸盐。
知识点02 高纯度含硅元素的材料——硅和二氧化硅
1.硅的存在、结构
存在
原子结构
示意图
周期表中位置
含量
存在形态
地壳中居第二位
氧化物和硅酸盐
第三周期、第ⅣA族
2.高纯硅的制备
(1)流程
(2)反应
①SiO2+2CSi+2CO↑
②Si+3HClSiHCl3+H2
③SiHCl3+H2Si+3HCl
3.硅和二氧化硅的用途
(1)单质硅
①信息技术:单质硅是应用最为广泛的半导体材料,如硅晶片是生产芯片的基础材料。
②新能源技术:硅太阳能电池
(2)二氧化硅:用于生产光导纤维。
4.新型陶瓷
(1)组成:不再限于传统的硅酸盐体系。
(2)特性和功能:在光学、热学、电学、磁学等方面具有很多新的特性和功能。
(3)碳化硅(SiC)俗称金刚砂,具有类似金刚石的结构,可用作磨料,具有优异的高温抗氧化性能,可用作耐高温结构材料等。
(4)常见的类型:高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷。
5.碳纳米材料
(1)富勒烯:由碳原子构成的一系列笼形分子的总称,如C60,可以制碳纳米材料。
(2)碳纳米管:可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径,比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
(3)石墨烯:只有一个碳原子直径厚度的单层石墨,电阻率低、热导率高,具有很高的强度,在光电器件、超级电容器、电池和复合材料等方面的应用研究在不断深入。
【即学即练2】2021年,我国航空航天事业取得了辉煌成就。下列成就所涉及的材料为半导体材料的是( )。
A.“天问一号”探测器使用的复合材料——SiC增强铝基复合材料
B.“天舟三号”货运飞船使用的质量轻强度高的材料——铝合金
C.“长征五号”运载火箭使用的高效清洁的液体燃料——液氢
D.“神舟十三号”载人飞船使用的太阳能电池材料——砷化镓
【解析】选D。SiC增强铝基复合材料属于复合材料,A错误;铝合金是合金,属于金属材料,B错误;液氢是可燃性物质,燃烧会产生大量能量,属于高效清洁的液体燃料,不是材料,C错误;太阳能电池材料——砷化镓的导电性介于导体与绝缘体之间,是良好的半导体材料,D正确。
能力拓展
考法01 硅和二氧化硅的性质及应用
【典例1】(2022·陕西榆林高一上学期期末)工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图:
已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解。
(1)装置C中的试剂是________________:装置F的作用为_____________________。
(2)装置A中发生反应的离子方程式为:_______________________________;A装置中,有一处明显错误是_____________________。
(3)装置D的硬质玻璃管中发生反应的化学方程式是________________。
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-。
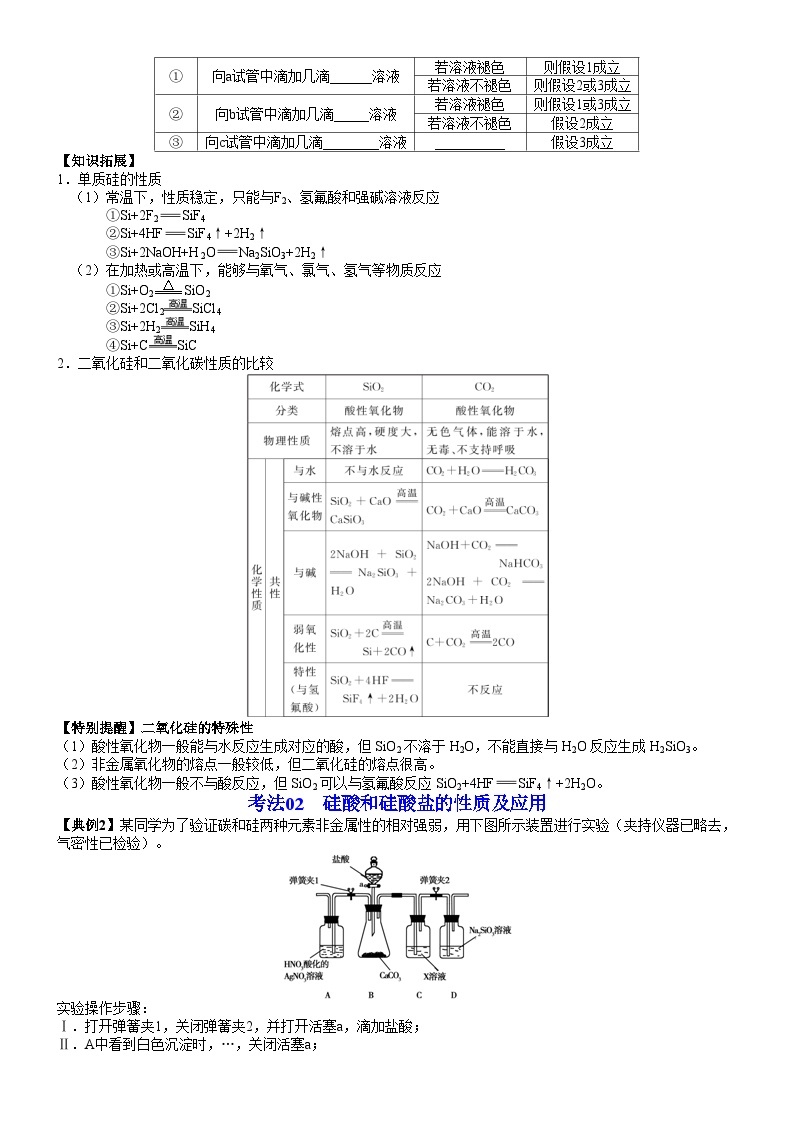
【设计方案,进行实验】可供选择的实验试剂有:3mol/LH2SO4溶液、1mol/LNaOH溶液、溴水、品红溶液、0.01mol/LKMnO4溶液、淀粉-KI溶液。各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验。请完成下表:
序号
操作
可能出现的现象
结论
①
向a试管中滴加几滴______溶液
若溶液褪色
则假设1成立
若溶液不褪色
则假设2或3成立
②
向b试管中滴加几滴_____溶液
若溶液褪色
则假设1或3成立
若溶液不褪色
假设2成立
③
向c试管中滴加几滴________溶液
__________
假设3成立
【解析】(1)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有氯化氢,为除去氯化氢,装置B中的试剂应该吸收氯化氢而不能吸收氯气,为饱和食盐水,装置C用浓硫酸吸水,四氯化硅遇水极易水解,F可防止右端的水蒸气进入E与四氯化硅反应,造成产物不纯;(2)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl-Mn2++2H2O+Cl2↑,圆底烧瓶底部表面积比较大,需用石棉网确保底部受热均匀,所以A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网;(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2SiCl4+2CO;(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3。
【答案】(1)浓硫酸;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯
(2)MnO2+4H++2Cl-Mn2++2H2O+Cl2↑;无石棉网
(3)SiO2+2C+2Cl2SiCl4+2CO
(4)①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色
【知识拓展】
1.单质硅的性质
(1)常温下,性质稳定,只能与F2、氢氟酸和强碱溶液反应
①Si+2F2SiF4
②Si+4HFSiF4↑+2H2↑
③Si+2NaOH+H2ONa2SiO3+2H2↑
(2)在加热或高温下,能够与氧气、氯气、氢气等物质反应
①Si+O2SiO2
②Si+2Cl2SiCl4
③Si+2H2SiH4
④Si+CSiC
2.二氧化硅和二氧化碳性质的比较
【特别提醒】二氧化硅的特殊性
(1)酸性氧化物一般能与水反应生成对应的酸,但SiO2不溶于H2O,不能直接与H2O反应生成H2SiO3。
(2)非金属氧化物的熔点一般较低,但二氧化硅的熔点很高。
(3)酸性氧化物一般不与酸反应,但SiO2可以与氢氟酸反应SiO2+4HFSiF4↑+2H2O。
考法02 硅酸和硅酸盐的性质及应用
【典例2】某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸;
Ⅱ.A中看到白色沉淀时,…,关闭活塞a;
请回答:
(1)B中反应的离子方程式是________________________。
(2)通过步骤Ⅰ得知盐酸具有的性质是______(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______,X是______(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是____________,D中反应的化学方程式是________________________。
(5)碳、硅的非金属性逐渐减弱的原因是________________________(从原子结构角度加以解释)。
【解析】(1)B中发生盐酸与碳酸钙的反应,生成氯化钙、水、二氧化碳,该离子反应为CaCO3+2H+Ca2++CO2↑+H2O;(2)A中看到白色沉淀,盐酸能与盐反应,可知盐酸具有的酸性、挥发性;(3)X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl,C装置的作用是除HCl气体;(4)D中发生二氧化碳与硅酸钠溶液的反应,该反应为Na2SiO3+CO2+H2OH2SiO3(胶体)+Na2CO3,步骤Ⅱ中未写的操作和现象是关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后;(5)碳、硅的非金属性逐渐减弱的原因是碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱。
【答案】(1)CaCO3+2H+Ca2++CO2↑+H2O(2)AD
(3)除HCl气体,饱和NaHCO3
(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后,Na2SiO3+CO2+H2OH2SiO3↓+Na2CO3
(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
【知识拓展】硅酸和硅酸盐的性质
1.碳酸和硅酸性质的比较
H2CO3
H2SiO3
酸性
均为弱酸,且酸性H2CO3>H2SiO3
水溶性
能溶于水
难溶于水
稳定性
常温下易分解生成CO2和H2O
受热易分解生成SiO2和H2O
制备
CO2+H2OH2CO3
Na2SiO3+2HCl2NaCl+H2SiO3↓
转化关系
Na2SiO3+CO2+H2OH2SiO3↓+Na2CO3
2.Na2SiO3与Na2CO3性质的比较
Na2SiO3
Na2CO3
俗名
硅酸钠的水溶液俗称水玻璃、泡花碱
纯碱、苏打
水溶性
易溶于水,水溶液黏合性强,是一种矿物胶
易溶
与盐酸反应
Na2SiO3+2HCl2NaCl+H2SiO3↓
Na2CO3+2HCl(少量)
2NaCl+H2O+CO2↑
Na2CO3+HCl(少量)
NaCl+NaHCO3
与CO2反应
Na2SiO3+CO2(少量)+H2O
H2SiO3↓+Na2CO3
Na2SiO3+2CO2(过量)+2H2O
H2SiO3↓+2NaHCO3
Na2CO3+H2O+CO22NaHCO3
用途
制备硅胶和木材防火剂
制玻璃、制肥皂
【特别提醒】硅酸盐的组成和结构
由于硅酸盐的结构比较复杂,为了简化硅酸盐组成,采用氧化物的形式。实际上,硅酸盐不是以简单的氧化物的形式存在,而是以各种结构复杂的盐的形式存在。
考法03 无机非金属材料
【典例3】(2022·武汉高一检测)硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业上生产粗硅的反应:SiO2+2CSi(粗)+2CO↑;SiO2+3CSiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________________。
(2)工业上可以通过如图所示的流程制取纯硅:
①若反应Ⅰ为Si(粗)+3HClSiHCl3+H2,则反应Ⅱ的化学方程式为__________________________________________________________。
②整个制备过程中必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:______________________。
【解析】(1)若产品中单质硅与碳化硅的物质的量之比为1∶1,可将两化学方程式叠加,可知C和SiO2的物质的量之比为5∶2。(2)①由流程图可知反应Ⅱ是SiHCl3和H2反应生成纯硅和HCl,因此化学方程式为SiHCl3+H2Si(纯)+3HCl。②根据反应中的已知物质:SiHCl3+H2OH2SiO3+HCl,由原子守恒可知另一种物质为H2,因此反应的化学方程式为SiHCl3+3H2OH2SiO3+3HCl+H2↑。
【答案】(1)5∶2
(2)①SiHCl3+H2Si(纯)+3HCl
②SiHCl3+3H2OH2SiO3+3HCl+H2↑
【知识拓展】含硅物质的化学性质
1.无机非金属材料分类
2.新型无机非金属材料分为高纯度的含硅元素的材料、新型陶瓷、碳纳米材料。
3.高纯硅的制备
①SiO2+2CSi+2CO↑
②Si+3HClSiHCl3+H2
③SiHCl3+H2Si+3HCl
【特别提醒】(1)区分Si和SiO2的用途。Si是应用最为广泛的半导体材料,SiO2可用于制造光导纤维。
(2)石英玻璃的主要成分是SiO2,不是硅酸盐。
分层提分
题组A 基础过关练
1.(2022·广东选择考)广东一直是我国对外交流的重要窗口,馆藏文物是其历史见证。下列文物主要由硅酸盐制成的是( )。
文物
选项
A.南宋鎏
金饰品
B.蒜头纹
银盒
C.广彩瓷
咖啡杯
D.铜镀
金钟座
【解析】选C。南宋鎏金饰品的主要原料是金属,不属于硅酸盐材料,故A错误;蒜头纹银盒的材料为银,不属于硅酸盐材料,故B错误;广彩瓷咖啡杯的材料为陶瓷,属于硅酸盐材料,故C正确;铜镀金钟座的主要材料为金属,不属于硅酸盐材料,故D错误。
2.(2022•常州高一检测)我国“化学”一词最早出于《化学鉴原》(1871年)。该书把一种元素翻译为“矽(xi)”。在地壳里,“矽”的含量在所有元素含量中占第二位,现代把这种“矽”元素命名为( )。
A.锡 B.硒 C.氧 D.硅
【解析】选D。地壳中含量居前五位的元素是氧、硅、铝、铁、钙,含量居第二位的元素是硅。
3.(2022·绍兴高一检测)碳纳米管是继足球烯(C60)以后发现的又一种碳单质,以下有关碳纳米管与足球烯(C60)的说法错误的是( )。
A.它们的物理性质有较大差异
B.在常温下它们的化学性质都稳定
C.它们是不同的碳单质
D.它们分别完全燃烧后生成物不同
【解析】选D。碳纳米管和足球烯中碳原子排列方式不同,物理性质不同;它们都是碳单质,在常温下化学性质比较稳定;二者完全燃烧时都生成二氧化碳。
4.陶瓷版“冰墩墩”和“雪容融”均产自中国陶瓷之乡,下列说法错误的是( )。
A.陶瓷、玻璃和水泥均属于无机非金属材料
B.陶瓷版“冰墩墩”上黑色涂料的主要成分为Fe2O3
C.陶瓷可用于日用的器皿、建筑材料等
D.陶瓷是以黏土及天然矿物岩为原料,经加工烧制而成的
【解析】选B。水泥、玻璃、陶瓷均属于无机非金属材料,故A正确;Fe2O3是红棕色物质,而陶瓷版“冰墩墩”上为黑色涂料,故不是氧化铁,故B错误;陶瓷可用于日用的器皿、建筑材料等,故C正确;陶瓷是以黏土及天然矿物岩为原料,经加工烧制发生复杂的化学反应而制成的,故D正确。
5.下列反应不能一步完成的是( )。
A.SiO2Na2SiO3 B.SiO2H2SiO3
C.Na2SiO3H2SiO3 D.H2SiO3SiO2
【解析】选B。SiO2+2NaOHNa2SiO3+H2O,A项正确;SiO2不与水反应,不能一步生成H2SiO3,B项错误;Na2SiO3+2HClH2SiO3↓+2NaCl,C项正确;H2SiO3SiO2+H2O,D项正确。
6.(2022·嘉兴高一检测)下列关于SiO2和CO2的叙述正确的是( )。
A.两者都是酸性氧化物,故均不与酸反应
B.两者都可以与NaOH溶液反应
C.两者熔、沸点均较低
D.两者都能与水反应生成对应的酸且碳酸的酸性强于硅酸
【解析】选B。SiO2能与氢氟酸反应生成四氟化硅和水,故A错误;SiO2和CO2都是酸性氧化物,都能与NaOH溶液反应,故B正确;CO2熔、沸点较低,SiO2熔、沸点较高,故C错误;二氧化硅不溶于水,不能与水反应,故D错误。
7.(四川省遂宁市2021~2022学年高一上学期期末)中国景德镇瓷器精美绝伦,瓷器表面的兔毫釉主要成分为SiO2,还含有少量Al2O3和Fe2O3。下列说法错误的是( )。
A.SiO2属于酸性氧化物
B.景德镇瓷器不宜保存酸性或碱性太强物质
C.兔毫釉极易被空气氧化,瓷器不能在空气中久置
D.Al2O3中氧的质量分数高于Fe2O3
【解析】选C。兔毫釉主要成分中SiO2属于酸性氧化物,Fe2O3属于碱性氧化物,Al2O3属于两性氧化物,A选项正确;Al2O3和Fe2O3能够和酸性物质反应,Al2O3和SiO2能够和碱性物质反应,B选项正确;大多数硅酸盐性质特别稳定,能够长时间放置在空气中,C选项错误;Al2O3和Fe2O3中氧原子个数相同,Al2O3的摩尔质量小,所以Al2O3中氧元素的质量分数高,D选项正确。
8.2022年北京冬奥会的各种科技让外国友人震惊,其中北京冬奥会火炬“飞扬”的制作材料和冬奥项目中的“速度担当”——用航天级技术造中国雪车所使用的材料也是备受关注。
(1)冬奥火炬和中国雪车使用的均是一种新型无机非金属材料——碳纤维复合材料,其中碳纤维与碳纳米管、石墨烯____________(填“是”或“不是”)同素异形体。
(2)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和________________;还需要加入适量______________调节水泥硬化速率。
(3)高铁上的信息传输系统使用了光导纤维,其主要成分是______________;乘务员使用的无线通话机的芯片材料是________________。
(4)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为__________________________。
(5)高铁上的卫生间没有任何异味,是由于所使用的马桶、地漏和洗手盆下水口都是纳米硅胶的高科技产品。向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为____________________________________________。
【解析】(1)碳纤维与碳纳米管、石墨烯均为碳的单质,互为同素异形体;
(2)生产水泥的主要原材料是石灰石和黏土;(3)光导纤维主要成分是SiO2,具有良好的导光性;硅单质是半导体材料,常用于制作计算机芯片和太阳能电池,乘务员使用的无线通话机的芯片材料是硅;(4)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,化学方程式为SiO2+4HFSiF4↑+2H2O;(5)向硅酸钠溶液中加入稀盐酸,反应生成硅酸胶体,离子方程式:SiO32-+2H+H2SiO3(胶体)。
【答案】(1)是(2)石灰石;石膏
(3)SiO2;Si(4)SiO2+4HFSiF4↑+2H2O
(5)SiO32-+2H+H2SiO3(胶体)
题组B 能力提升练
1.(2022•荆门高一检测)《天工开物》第七卷《陶埏(陶瓷)》中“水火既济而土合.…后世方土效灵,人工表异,陶成雅器,有素肌、玉骨之象焉”所述的“陶成雅器”的主要原料是( )。
A.黏土
B.纯碱、石灰石、石英砂
C.黏土、石灰石
D.二氧化硅、硅酸钙、硅酸铝
【解析】选A。陶瓷的传统概念是指所有以黏土等无机非金属矿物为原材料,经过高温烧制而成的产品,题干中陶成雅器,“水火既济而土合”为陶器的生产工艺,所以所述的“陶成雅器”的主要原料是黏土。
2.(宁夏石嘴山市2021~2022学年高一上学期期中测试)下列说法正确的是( )。
A.二氧化硅具有良好的半导体特性,故而可用作光导纤维
B.硅酸钠为盐,非碱类物质,故可用玻璃瓶盛装
C.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸
D.硅溶于氢氧化钠溶液,只有水作氧化剂,NaOH既非氧化剂也非还原剂
【解析】选D。硅具有良好的半导体特性,二氧化硅可用作光导纤维,故错误;硅酸盐具有粘性,容易将玻璃瓶与玻璃塞粘到一起,不能用玻璃瓶盛装,故错误;高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故错误;硅与氢氧化钠溶液反应生成硅酸钠和氢气,水中氢离子化合价降低,做氧化剂,故正确。
3.(福建泉州2021~2022学年度高一期末检测)中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法正确的是( )。
A.高品质的白瓷晶莹剔透,属于纯净物
B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料
C.氮化硅陶瓷属于传统无机非金属材料
D.“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化
【解析】选D。白瓷含有多种成分属于混合物,A项错误;陶瓷属于无机非金属材料,B项错误;氮化硅陶瓷属于新型无机非金属材料,C项错误;“窑变”时,高温下釉料中的金属化合物由于还原程度的不同,形成不同颜色的低价态化合物,D项正确。
4.(2022~2023年度河南洛阳高一上学期期中检测)高纯度晶体硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场“革命”。它的制备方法如图所示,下列说法错误的是( )。
A.硅和二氧化硅均能与氢氟酸反应
B.步骤①中易产生SiC杂质,SiC属于共价化合物
C.步骤③的反应属于置换反应
D.熔融NaOH固体,可在石英坩埚中进行
【解析】选D。石英中的SiO2能与NaOH反应,不能选用石英坩埚熔融NaOH固体,D项错误。
5.下列说法正确的是( )。
A.由SiO2不能与水反应生成硅酸可知,SiO2不是酸性氧化物
B.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
C.由SiO2可制作光导纤维可知,SiO2可导电
D.由SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
【解析】选B。酸性氧化物是能跟碱生成盐和水的氧化物,SiO2能与碱反应生成硅酸盐和水,所以SiO2是酸性氧化物,酸性氧化物不是根据能否跟水反应确定的,故A错误;CO2通入Na2SiO3溶液产生白色沉淀硅酸,根据强酸可以制弱酸,可知酸性H2CO3>H2SiO3,故B正确;SiO2可制作光导纤维,是因为SiO2的导光性,SiO2不导电,故C错误;SiO2可与NaOH等碱溶液反应生成盐和水,SiO2虽然可与氢氟酸反应,但不生成盐和水且不能和其他酸反应,SiO2和酸的反应不具有普遍性,所以SiO2不是两性氧化物,SiO2是酸性氧化物,故D错误。
5.含硅元素的物质有很多用途,下列说法不正确的是( )。
A.硅晶片是生产芯片的基础材料,其主要成分为SiO2
B.高压输电线路使用的陶瓷绝缘材料属于硅酸盐材料
C.水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料
D.超导陶瓷具有超导性,可应用于电力和交通领域
【解析】选A。光导纤维的主要成分是SiO2,而芯片的主要成分是Si,A项错误;陶瓷不导电,具有良好的绝缘性,其主要成分为硅酸盐,可用于高压输电线路使用的绝缘材料,B项正确;硅酸钠的水溶液俗称水玻璃,不易燃烧,可用作木材防火剂的原料,C项正确;超导陶瓷具有超导性,是一种优良的导体,故可用于电力和交通领域,D项正确。
7.下列离子方程式中书写正确的是( )。
A.水玻璃中通入过量的二氧化碳:Na2SiO3+CO2+H2O2Na++CO32-+H2SiO3↓
B.二氧化硅放入澄清石灰水中:Ca(OH)2+2SiO2CaSiO3↓+H2O
C.二氧化硅与氢氟酸反应:SiO2+4H++4F-SiF4↑+2H2O
D.单质硅溶于烧碱溶液中:Si+2OH-+H2OSiO32-+2H2↑
【解析】选D。水玻璃是硅酸钠的水溶液,硅酸钠是易溶于水的强电解质,以离子形式存在,向其中通入过量CO2反应产生NaHCO3和H2SiO3,反应的离子方程式为SiO32-+2CO2+2H2OH2SiO3↓+2HCO3-,A错误;澄清石灰水中Ca(OH)2以离子形式存在,该反应方程式不符合质量守恒定律和物质存在形式,正确的离子方程式为Ca2++2OH-+SiO2CaSiO3+H2O,B错误;氢氟酸是弱酸,应该用化学式表示,C错误;单质硅溶于烧碱溶液中,生成硅酸钠和H2,反应符合反应事实,D正确。
8.含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第____________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为_______________,A与B在原子的电子层结构上的相同点是_____________________。
(2)易与C发生化学反应的酸是_________,反应的化学方程式是______________。
(3)将C与纯碱混合高温熔融时发生化学反应生成D,同时还生成B的最高价氧化物E;将少量的E通入D的水溶液中,生成含A的化合物F。
①分别写出生成D和F的化学反应方程式:______________________________,____________________________________________。
②要将纯碱高温熔化,下列坩埚中不可选用的是________________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
【解析】含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3。(1)A的最外层电子数为4,位于第ⅣA族,与A同族但相对原子质量比A小的元素B为碳,其原子结构示意图为,二者最外层均有4个电子;(2)二氧化硅与氢氟酸反应生成四氟化硅与水,化学方程式为SiO2+4HFSiF4↑+2H2O;(3)①将SiO2与纯碱混合高温熔融时反应生成Na2SiO3,同时还生成B的最高价氧化物E,则E为CO2,化学方程式为SiO2+Na2CO3Na2SiO3+CO2↑;将少量的CO2与Na2SiO3水溶液反应,生成了含A的化合物F为H2SiO3,化学方程式为Na2SiO3+CO2+H2ONa2CO3+H2SiO3↓;②普通玻璃坩埚、石英玻璃坩埚中的二氧化硅在高温下都能与碳酸钠反应,应在铁坩埚中熔化,A、B两选项符合题意。
【答案】(1)ⅣA;;最外层均有4个电子(2)氢氟酸;SiO2+4HFSiF4↑+2H2O(3)①SiO2+Na2CO3Na2SiO3+CO2↑;Na2SiO3+CO2+H2ONa2CO3+H2SiO3↓②AB
8.(2021~2022学年贵州贵阳高一上期末检测)工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式___________________________。工业上还可以利用镁制取硅,反应为2Mg+SiO22MgO+Si,同时会发生副反应:2Mg+SiMg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
A.石灰石 B.锌粒 C.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是_______________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①________________,②_________________。
【解析】碳和二氧化硅在高温下反应生成硅和CO,反应的化学方程式为SiO2+2CSi+2CO↑。(1)Mg可以与CO2、N2发生化学反应,Mg与氢气不能发生反应,因此可用氢气作为保护气。选用的药品为稀硫酸和锌粒,再用浓硫酸干燥。选b;(2)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体燃烧会发生爆炸,所以反应开始前应该先通氢气排尽装置中的空气;Mg与SiO2反应的条件是加热,当反应引发后,移走酒精灯,反应能继续进行,这说明Mg与SiO2的反应是放热反应;(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4HCl2MgCl2+SiH4↑,SiH4常温下是一种不稳定、易自燃的气体,反应的方程式为SiH4+2O2SiO2↓+2H2O,所以往反应后的混合物中加入稀盐酸,可观察到闪亮的火星。
【答案】SiO2+2CSi+2CO↑(1)b
(2)防止加热条件下H2与空气混合爆炸;Mg与SiO2的反应是放热反应
(3)①Mg2Si+4HCl2MgCl2+SiH4↑②SiH4+2O2SiO2↓+2H2O
题组C 培优拔尖练
1.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如下:
下列说法错误的是( )。
A.反应①中氧化剂和还原剂的物质的量之比为1∶2
B.流程中HCl和H2可以循环利用
C.反应①②③均为置换反应
D.生成的硅单质是光导纤维的主要成分
【解析】选D。反应①的化学方程式为SiO2+2C2CO↑+Si,SiO2是氧化剂,C是还原剂,氧化剂和还原剂的物质的量之比为1∶2,A项正确;反应②中的HCl是反应物、H2是生成物,反应③中H2是反应物、HCl是生成物,故流程中HCl和H2可以循环利用,B项正确;反应①SiO2+2C2CO↑+Si,反应②Si+3HClH2+SiHCl3,反应③H2+SiHCl3Si+3HCl,均为置换反应,C项正确;光导纤维的主要成分是SiO2,Si单质是良好的半导体材料,D项错误。
2.(2021~2022学年浙江省杭州市四校高一下4月份段考)美国科学家制成了用C60作车轮的“纳米汽车”(如图所示),每辆“纳米汽车”是由一个有机分子和4个C60分子构成,直径约6到9纳米。“纳米汽车”可以用来运输单个的有机分子。下列说法不正确的是( )。
A.C60属于新型无机非金属材料
B.C60可以在一定条件下转化为金刚石,且发生物理变化
C.C60与碳纳米管互为同素异形体
D.用激光笔照射该“纳米汽车”分散在蒸馏水中形成的分散系,光线通过时出现明亮的光路
【解析】选B。常见的无机非金属材料如氮化硅、晶体硅、二氧化硅、C60等,其中C60为新型无机非金属材料,故A正确;有新物质生成是化学变化,C60和金刚石属于不同物质,所以C60在一定条件下转化为金刚石是化学变化,故B错误;C60与碳纳米管均是碳元素形成的不同种单质,互为同素异形体,故C正确;胶体具有丁达尔效应,该分散系为胶体,所以具有丁达尔效应,故D正确。
3.(2021~2022学年浙江省9+1高中联盟高一下期中)AlN属于类金刚石氮化物,是一种新型的高温结构陶瓷,熔融状态下不导电。AlN极易水解,其水解方程式为:AlN+3H2OAl(OH)3+NH3↑。下列有关AlN的说法正确的是( )。
A.AlN熔沸点高,硬度大,属于离子化合物
B.可以通过铝和氮气在空气中加热反应制得纯净的AlN
C.AlN性质稳定,可耐酸耐碱
D.AlN陶瓷可以用作集成电路散热基板
【解析】选D。AlN是一种新型的高温结构陶瓷,熔融状态下不导电,说明其不含离子键,不是离子化合物,故A错误;空气中含有水,AlN极易水解,所以在空气中无法得到纯净的AlN,故B错误;AlN极易水解,水解方程式为:AlN+3H2OAl(OH)3↓+NH3↑,可知AlN性质不稳定,可以与强酸和强碱反应,故C错误;依据题意可知AlN是一种新型的耐高温结构陶瓷,故可以用作集成电路散热基板,故D正确。
4.(2020年7月·浙江学考真题)Ca3SiO5是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )。
A.可发生反应:Ca3SiO5+4NH4ClCaSiO3+2CaCl2+4NH3↑+2H2O
B.具有吸水性,需要密封保存
C.能与SO2反应生成新盐
D.与足量盐酸作用,所得固体产物主要为SiO2
【解析】选D。将Ca3SiO5改写为氧化物形式后的化学式为:3CaO·SiO2,其具有CaO和SiO2的双重性质。Ca3SiO5与NH4Cl反应可以认为CaO先和水反应生成Ca(OH)2,Ca(OH)2再与NH4Cl发生反应生成CaCl2、NH3和H2O及Ca(OH)2与SiO2反应生成CaSiO3,则其总反应的方程式为:Ca3SiO5+4NH4ClCaSiO3+2CaCl2+4NH3↑+2H2O,A选项正确;CaO能与水反应,所以需要密封保存,B选项正确;亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+Ca3SiO53CaSO3+H2SiO3,C选项正确;盐酸的酸性比硅酸强,当盐酸与Ca3SiO5反应时,发生反应:6HCl+Ca3SiO53CaCl2+H2SiO3+2H2O,D选项不正确。
5.(2021年1月高三八省联考湖北卷)水泥是人类最伟大的发明之一,主要成分为硅酸三钙(3CaO·SiO2)。将其与适量的水反应,形成相互交联的结构,反应式如下2(3CaO·SiO2)+6H2O3CaO·2SiO2·3H2O+3Ca(OH)2(放热反应)。但是,需要避免交联过程热膨胀及产生的水蒸气在建筑结构中造成空隙。我国三峡大坝的建设者在全世界首创了以冰代水的浇灌方法,有效解决了这一问题,保证了大坝建筑质量。下列说法错误的是( )。
A.水泥由黏土和石灰石等研磨、煅烧制得
B.水泥生产过程中加入石膏,可以调节水泥的硬化速率
C.水的作用是提供结晶水以稳定交联结构
D.以冰代水的优点是减少了热膨胀及水蒸气的产生
【解析】选C。水泥由石灰石和粘土等混合,经高温煅烧制得,A说法正确;水泥生产过程中加入石膏的目的是为了调节水泥的凝结硬化速度,调整水泥的凝结时间,B说法正确;水与硅酸三钙(3CaO·SiO2)发生化学反应,生成的产物形成相互交联的结构,C说法错误;硅酸三钙(3CaO·SiO2)与水反应放热,以冰代水减少了热膨胀及水蒸气产生的气泡,保证建筑质量,D说法正确。
6.沸石是一种含水架状结构的多孔性铝硅酸盐晶体,其基本结构单元是硅氧四面体和铝氧四面体。沸石的化学组成为:Ma[(AlO2)x·(SiO2)y]·z(H2O),其中M为金属阳离子。下列推测不正确的是( )。
A.沸石的架状结构中存有的空气,可作为气泡的凝结核,能使反应液平稳沸腾
B.若金属阳离子带n个单位正电荷,则x=a·n
C.增大x/y(铝硅比)的值,可以增强沸石的耐酸、耐碱和耐高温的性能
D.沸石具有筛分分子的作用,可用于分离、提纯气体或液体混合物
【解析】选C。沸石能够防止液体暴沸,其原因是沸石的架状结构中存有的空气,可作为气泡的凝结核,能使反应液平稳沸腾,A选项正确;“AlO2”显-1价,“SiO2”显0价,“H2O”显0价,M显+n价,根据正负化合价的代数和等于0,则有a×(+n)+x×(-1)=0,所以x=a·n,B选项正确;增大x/y(铝硅比)的值,则铝元素的含量增加(相当于Al2O3增加),沸石的耐酸、耐碱性能降低,C选项错误;由于沸石多孔性结构,因此沸石具有筛分分子的作用,可用于分离、提纯气体或液体混合物,D选项正确。
7.(2022·大连高一上期末)用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________。
(2)在实验室过滤操作中所用的玻璃仪器有_____________,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________。
(3)该流程中可以循环使用的物质是:_____________。(填化学式)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________。
【解析】氟硅酸加入硫酸钾发生反应生成氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,过滤得到硫酸和氟硅酸钾,干燥后在热水中水解成氟化钾、氟化氢及硅酸,加入浓硫酸反应得到硫酸钾、氟化氢、和四氯化硅等,净化冷凝,通过精馏得到纯净的氟化氢;(1)氟硅酸加入硫酸钾发生反应生成氟硅酸钾和硫酸,反应器中的化学方程式为:H2SiF6+K2SO4H2SO4+K2SiF6↓;(2)依据过滤装置和过程选择需要的玻璃仪器为漏斗、烧杯、玻璃棒,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤而不是用水,其目的是氟硅酸钾不溶于酒精,减少用水洗涤溶解氟硅酸钾损失;(3)反应过程中参与反应,在反应过程中又重新生成的物质可以循环使用,分析流程判断流程中硫酸和硫酸钾在制备过程中先参加反应,随后又生成,可以循环使用;(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6和水,依据原子守恒配平书写化学方程式为:6HF+SiO2H2SiF6+2H2O。
【答案】(1)H2SiF6+K2SO4H2SO4+K2SiF6↓
(2)烧杯、漏斗、玻璃棒;氟硅酸钾不溶于酒精,减少用水洗涤溶解氟硅酸钾损失
(3)H2SO4、K2SO4(4)6HF+SiO2H2SiF6+2H2O
8.(2022·广西北海高一上学期期末)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_______________,还可使用_________代替硝酸。
(2)沉淀A的主要成分是____________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为___________________________。
(3)加氨水过程中加热的目的是__________________________,沉淀B的主要成分为_________、_________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液测定,通过测定草酸的量可间接获知钙的含量,测定反应为:2MnO4-+6H++5H2C2O42Mn2++10CO2↑+8H2O。实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L-1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为_______________。
【解析】(1)铁离子在pH较小时易生成沉淀,加入硝酸可氧化亚铁离子生成铁离子,比避免引入新杂质,还可用过氧化氢代替硝酸;(2)由以上分析可知沉淀A为SiO2,不溶于强酸但可与一种弱酸反应,应为与HF的反应,方程式为SiO2+4HFSiF4↑+2H2O;(3)滴加氨水,溶液呈碱性,此时不用考虑盐类水解的问题,加热的目的是防止生成胶体而难以分离,生成的沉淀主要是Al(OH)3、Fe(OH)3;(4)反应的关系式为5Ca2+~5H2C2O4~2KMnO4,n(KMnO4)=0.0500mol/L×36.00×10-3L=1.80×10-3mol,n(Ca2+)=4.50×10-3mol,水泥中钙的质量分数为×100%=45.0%。
【答案】(1)将样品中的Fe2+氧化为Fe3+;H2O2
(2)SiO2;SiO2+4HFSiF4↑+2H2O
(3)防止胶体生成,易生成沉淀;Al(OH)3、Fe(OH)3
(4)45.0%
【同步讲义】高中化学(人教版2019)选修第二册--第07讲:杂化轨道理论简介 讲义: 这是一份【同步讲义】高中化学(人教版2019)选修第二册--第07讲:杂化轨道理论简介 讲义,文件包含第07讲杂化轨道理论简介学生版docx、第07讲杂化轨道理论简介教师版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
【同步讲义】高中化学(人教版2019)必修第二册--第19讲 糖类 讲义: 这是一份【同步讲义】高中化学(人教版2019)必修第二册--第19讲 糖类 讲义,文件包含同步讲义高中化学人教版2019必修第二册--第19讲糖类学生版docx、同步讲义高中化学人教版2019必修第二册--第19讲糖类教师版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
【同步讲义】高中化学(人教版2019)必修第二册--第18讲 乙酸 讲义: 这是一份【同步讲义】高中化学(人教版2019)必修第二册--第18讲 乙酸 讲义,文件包含同步讲义高中化学人教版2019必修第二册--第18讲乙酸学生版docx、同步讲义高中化学人教版2019必修第二册--第18讲乙酸教师版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。













