




【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第10讲 化学反应的方向 讲学案
展开
一、自发过程与自发反应
1.自发过程:在一定条件下,不需借助外力就能____________的过程。其特点是高能状态 → 低能状态(对外做功或释放热量);有序 → 无序(无序体系更加稳定)。如:高山流水,自由落体,冰雪融化。
2.自发反应:在给定的条件下,可以____________到显著程度的化学反应。如:钢铁生锈。杨sir化学,侵权必究
3.特征:具有____________,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定不能自发进行。
【答案】自发进行 自发进行 方向性
思考与交流:自发反应不需要任何条件就能自发进行吗?
【答案】不是,如H2和O2反应需要点燃。
二、焓判据
1.放热过程中体系能量_______,ΔH_______,具有自发的倾向。
2.实验发现,大多数放热反应是可以自发进行的。杨sir化学,侵权必究
例如:Zn(s) +CuSO4(aq) =ZnSO4 (aq) +Cu(s) ΔH =-216.8kJ/mol
3.有些吸热反应也可以自发进行,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热的,但是这个反应却是可以自发进行的,故不能只根据放热或者吸热来判断化学反应的方向,焓变只是影响反应方向的一种因素。
【答案】降低 <0
三、熵判据
1.熵的定义
描述体系_____________的物理量,一般用S表示。熵值越大,体系的混乱度_______。
2.熵的大小
同种物质的熵值与其存在状态有关, S(g) ____ S(l) ____ S(s)。
3.熵判据
体系的混乱度(即熵值)增加, ΔS>0,反应有自发的倾向。杨sir化学,侵权必究
有些熵减的过程也能自发进行,如乙烯聚合为聚乙烯的反应,故熵变只是影响反应方向的一种因素。
【答案】混乱程度 越大 > >
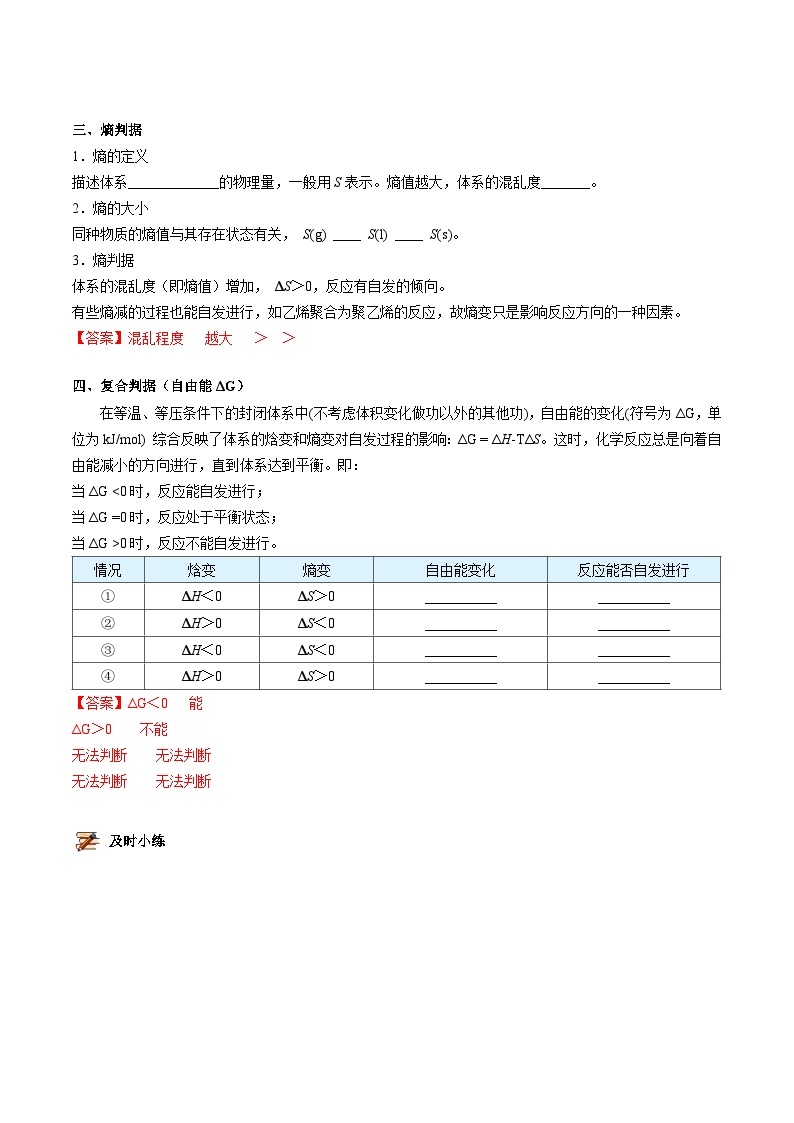
四、复合判据(自由能ΔG)
在等温、等压条件下的封闭体系中(不考虑体积变化做功以外的其他功),自由能的变化(符号为ΔG,单位为kJ/mol) 综合反映了体系的焓变和熵变对自发过程的影响:ΔG = ΔH-TΔS。这时,化学反应总是向着自由能减小的方向进行,直到体系达到平衡。即:杨sir化学,侵权必究
当ΔG <0时,反应能自发进行;
当ΔG =0时,反应处于平衡状态;杨sir化学,侵权必究
当ΔG >0时,反应不能自发进行。
情况 | 焓变 | 熵变 | 自由能变化 | 反应能否自发进行 |
① | ΔH<0 | ΔS>0 | _________ | _________ |
② | ΔH>0 | ΔS<0 | _________ | _________ |
③ | ΔH<0 | ΔS<0 | _________ | _________ |
④ | ΔH>0 | ΔS>0 | _________ | _________ |
【答案】ΔG<0 能
ΔG>0 不能
无法判断 无法判断
无法判断 无法判断
及时小练
【答案】任何温度下都能自发进行 任何温度下都不能自发进行 低温下能自发进行 高温下能自发进行
命题点一:自发过程与自发反应杨sir化学,侵权必究
【例1】下列过程是非自发的是
A.水由高处向低处流
B.氯气和溴化钾溶液的反应
C.铁在潮湿空气中生锈
D.室温下水结成冰
【答案】D
【详解】
A.水由高处向低处流,是自发进行的过程,故A不选;
B.氯气的氧化性比溴强,氯气能够与KBr溶液发生置换反应,属于自发进行的过程,故B不选;
C.铁生锈为自发进行的氧化还原反应,反应放热,常温下可自发进行,故C不选;
D.室温下冰会自发的融化,室温下水结成冰不是自发进行的过程,故D选;
故选D。
命题点二:熵的大小比较杨sir化学,侵权必究
【例2】相同温度和压强下,关于物质熵的大小比较,合理的是
A. B.
C. D.
【答案】B
【详解】
A.和物质的量相同,且均为气态,含有的原子总数多,的摩尔质量大,所以熵值,A错误;
B.相同状态的相同物质,物质的量越大,熵值越大,所以熵值,B正确;
C.等量的同物质,熵值关系为:,所以熵值,C错误;
D.从金刚石和石墨的结构组成上来看,金刚石的微观结构更有序,熵值更低,所以熵值,D错误;
答案为:B。
【变 2】判断下列反应的熵值的变化,在横线上填入“增大”“减小”或“不变”。
(1):_______。杨sir化学,侵权必究
(2):_______。
【答案】减小 不变
【详解】
(1)反应中,气体分子数减少,混乱度减小,熵减小;
(2)反应中,气体分子数不变,混乱度几乎不变,熵几乎不变。
命题点三:自由能判断反应进行的方向杨sir化学,侵权必究
【例3】化学反应进行的方向是一个比较复杂的问题。下列有关说法正确的是
A.反应的
B.在不同状态时的熵值:
C.反应 能否自发进行与温度有关
D.或的反应一定能自发进行
【答案】C
【详解】
A.反应的气体分子数减少,该反应的,选项A错误;
B.同一物质在固态时的熵值小于气态时的熵值,选项B错误;
C.反应的气体分子数增加,,又因为,时,反应能自反进行,因此选项所给反应能否自发进行与温度有关,选项C正确;
D.且的反应一定能自发进行,选项D错误;
答案选C。
【变3-1】下列说法不正确的是
A.室温下不能自发进行,说明该反应的
B.放热及熵增加的反应,一定能自发进行杨sir化学,侵权必究
C.已知反应,高温下为自发过程,低温下为非自发过程
D.知道了某过程有自发性之后,则可确定过程是否一定会发生
【答案】D
【详解】
A.根据反应方程式,该反应为熵增,根据进行分析,该反应不能自发进行,>0,因此可以说明该反应为,故A说法正确;
B.放热反应,推出<0,熵增,推出>0,根据复合判据,任何温度下,该反应都能自发进行,故B说法正确;
C.该反应是熵增,推出>0,该反应,根据复合判据,高温下能够自发进行,低温下非自发进行,故C说法正确;
D.过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的概率,故D说法错误;
答案为D。
【变3-2】现有两个热化学反应方程式:
(l)+H2(g)(l) ΔH>0 ①
(l)+2H2(g)(l) ΔH<0 ②
下列说法正确的是
A.反应①②中都存在:ΔS>0
B.反应①一定不能自发进行
C.在通常情况下,①②都能自发进行
D.反应②高温时,可自发进行
【答案】B
【详解】
A.由题中热化学反应方程式可知,反应①②均为熵减反应,即ΔS<0,A项错误;
B.由题可知,反应①ΔH>0,ΔS<0,则ΔH-TΔS>0,所有温度下反应都不能自发进行,B项正确;
C.由B项可知,反应①在所有温度下都不能自发进行;反应②的ΔH<0,ΔS<0,则在低温条件下,ΔH-TΔS<0,即反应②低温时,可自发进行,C项错误;
D.由题可知,反应②ΔH<0,ΔS<0,则在低温条件下,ΔH-TΔS<0,即反应②低温时,可自发进行,D项错误;
答案选B。
【例4】某化学反应A(s)=D(g)+E(g) ΔH-TΔS=(-4500+11T)kJ·mol-1(其中ΔH为焓变,ΔS为熵变,T为热力学温度,单位为K),要防止反应发生,温度必须
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
【答案】A
【详解】
要防止反应发生,ΔH-TΔS>0,则-4500+11T>0,解得T>409,答案选A。
【例5】已知体系自由能变化时反应能自发进行.两个氢化反应的与温度的关系如图所示,下列说法正确的是杨sir化学,侵权必究
A.反应①的
B.反应②在时的反应速率很快
C.温度大于时,反应①能自发进行
D.反应②的
【答案】C
【分析】
由图像分析可知:反应①随温度的升高,逐渐减小;反应②随温度的升高逐渐增大,结合分析解答。
【详解】
A.反应①随温度的升高,逐渐减小,则,故A错误;
B.该题我们可以推测自发反应时的温度,但无法推测什么温度的反应快慢,故B错误;
C.因时,反应能自发进行,反应①在温度大于1000℃时,故此时反应①能自发进行,故C正确;
D.根据数学知识可知,为该图像的截距,而反应而的截距小于0,故,故D错误;
答案选C。
【例6】回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解,发生反应:,该反应的∆H________(填“>”或“<”,下同)0,∆S_______0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为。反应在常温下能够自发进行,则反应的∆H______(填“>”或“<”)0。
(3)已知在、时石灰石分解反应的、。
①常温下,该反应________(填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________(填“能”或“不能”)成为反应进行方向的决定因素。
(4)已知,该反应能够自发进行的反应条件是______。杨sir化学,侵权必究
(5)某吸热反应能自发进行,则该反应的∆S_____(填“>”或“<”)0。
【答案】> > 不能 < 不能 能 高温 >
【详解】
(1)由于在中燃烧生成为放热反应,则二氧化碳分解生成和氧气的反应为吸热反应,,根据化学方程式可知,反应后气体的化学计量数之和增加,,故低温下,反应不能自发进行。
(2)时反应自发进行,通过化学方程式可知常温下,常温下反应能够自发进行,则。
(3)①根据时反应自发进行,已知,,则常温下不能自发进行;
②该反应的、,高温条件下能使,而常温条件下,则该反应中温度能成为决定反应进行方向的因素。
(4)该反应的、,则高温时,反应能自发进行。
(5)已知某吸热反应能自发进行,即,,则。
【例7】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:△H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___________
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___________
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=v逆(H2)
c.容器内压强保持不变杨sir化学,侵权必究
d.混合气体的密度保持不变
【答案】ABCD c
【详解】
(1)A.反应自发进行需要根据△H-T△S<0判断,只靠△H判断不准确,故A错误;
B.根据△H-T△S<0判断反应的自发性,只靠△S判断不准确,故B错误;
C.该反应为放热反应,高温不利于反应物的转化,在高温下进行,是为了加快反应速率,故C错误;
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能,催化剂不能改变反应的△H,故D错误;
故答案为:ABCD;
(2)a.容器内N2、H2、NH3的浓度之比为1∶3∶2不能说明各组分含量保持不变,不能说明反应达到平衡状态,故a不选;
b.3v正(N2)=v逆(H2),反应达到平衡,则v正(N2)=v逆(H2)没有达到平衡状态,故b不选;
c.该反应前后气体分子数发生变化,恒容容器内压强保持不变,说明各组分含量保持不变,反应达到平衡,故c选;
d.混合气体总质量不变,恒容容器中气体的体积不变,则气体的密度始终保持不变,混合气体的密度保持不变,不能说明反应达到平衡,故d不选;
故答案为:c。
【练1】下列说法中正确的是
A.吸热反应反应一定不能发生反应
B.某吸热反应能自发进行,因此该反应是熵增反应
C.需要加热才能发生的反应,一定是吸热反应
D.催化剂可以改变反应进行的方向杨sir化学,侵权必究
【答案】B
【详解】
A.吸热反应在一定条件下能发生反应,例如加热时碳和二氧化碳可以反应生成CO,A错误;
B.某吸热反应能自发进行,即ΔH>0,根据ΔG=ΔH-TΔS<0可知该反应一定是熵增反应,B正确;
C.需要加热才能发生的反应,不一定是吸热反应,例如碳燃烧等,C错误;
D.催化剂可以改变反应速率,不能改变反应进行的方向,D错误;
答案选B。
【练2】以下判断正确的是
A.C(s)+CO2(g)=2CO(g) △H>0,该反应常温下不能自发
B.2Mg(s)+O2(g)=2MgO(s) △H<0,该反应高温才能自发
C.自发反应的熵一定增大,非自发反应的熵一定减小
D.放热反应都可以自发进行,而吸热反应不能自发进行
【答案】A
【详解】
A.在高温下△G=△H-T△S<0反应能进行,△H>0,该反应常温下不能自发,故A正确;
B.△G=△H-T△S<0反应能进行,由于△H<0,则该反应在常温就能自发进行,故B错误;
C.自发进行的反应熵值不一定增大,化学反应的方向由焓变和熵变共同决定,非自发反应的熵不一定减小,故C错误;
D.不能根据焓变判断反应的自发性,放热反应不一定都是自发进行的,吸热反应也可能是自发进行,如碳酸氢铵的分解,故D错误;
故选A。
【练3】对于化学反应能否自发进行,下列说法中错误的是
A.非自发过程在一定条件下可能变成自发过程
B.若△H>0,△S<0,任何温度下都不能自发进行
C.若△H<0,△S>0,任何温度下都能自发进行
D.需要加热才能够进行的过程肯定不是自发过程
【答案】D
【详解】
A.非自发过程在一定条件下可能变成自发过程,如铜和稀硫酸在电解条件下可发生,故A正确;
B.若△H>0,△S<0,则△H-T△S>0任何温度下都不能自发进行,故B正确;
C.若△H<0,△S>0,则△H-T△S<0任何温度下都能自发进行,故C正确;
D.需要加热才能够进行的过程可能是自发过程,如碳酸钙高温分解,故D错误;
故答案为:D
【练4】下列关于化学反应方向及其判据的说法中正确的是
A.1molSO3在不同状态时的熵值:S[SO3(s)]>S[SO3(1)]>S[SO3(g)]
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
C.放热反应都可以自发进行,而吸热反应不能自发进行
D.2KClO3(s)=2KCl(s)+3CO2(g)ΔH>0能否自发进行与温度无关
【答案】B
【详解】
A.物质聚集状态不同熵值不同 , 气体 S> 液体 S> 固体 S,1molSO3在不同状态时的熵值:S[SO3(s)]<S[SO3(1)]<S[SO3(g)],故A错误;
B.反应的自发性由焓变和熵变共同决定,该反应为,常温不能自发,说明高温时,说明则该反应的ΔH>0,故B正确;
C.反应的自发性由焓变和熵变共同决定,当时反应能自发进行, 时反应不能自发进行,焓变小于零的反应,,若 ,高温下可以 ,反应不能自发进行,熵变大于零的反应,,若 ,高温下可以 时反应可自发进行,故C错误;
D.、 ,由 的反应可自发进行,可知能否自发进行与温度有关,故D错误;
故答案为B。
【练5】下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.自发反应在任何条件下都能发生
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固,液、气三种状态的熵值相同杨sir化学,侵权必究
【答案】C
【详解】
A.反应能否自发进行取决于焓变和熵变的复合判据,对于吸热反应,在一定温度下也能进行,故A错误;
B.反应是否自发进行,由熵变、焓变、温度共同决定,故B错误;
C.△G=△H-T•△S<0时,反应能自发进行,适合于所有的过程,所以由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程,故C正确;
D.熵值表示混乱度的大小,混乱度越大,熵值越大,同一物质的固态、液态、气态混乱度依次增大,故D错误;
故选C。
【练6】判断下列说法的正误。
①的反应一定能自发进行 _______
②的反应一定不能自发进行 _______
③常温下,晶体与晶体的反应可自发进行 ________
④常温下,反应可自发进行 _______
⑤反应的焓变是影响反应能否自发进行的一个因素 ______
【答案】错误 错误 正确 正确 正确
【详解】
①焓变是影响反应能否自发进行的一个因素,但不是唯一因素,大多数放热反应()能自发进行,故①错误;
②部分吸热反应()也能自发进行,故②错误;
③中的反应为吸热反应,但常温下可自发进行,故③正确;
④中的反应为放热反应,常温下可自发进行,故④正确;
⑤反应的焓变是影响反应能否自发进行的一个因素,故⑤正确。
【练7】有A、B、C、D四个反应:
反应 | A | B | C | D |
ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
①在任何温度下都能自发进行的反应是______;
②任何温度下都不能自发进行的反应是______;杨sir化学,侵权必究
③另两个反应中,在温度高于______℃时可自发进行的反应是______;在温度低于______℃时可自发进行的反应是______。
【答案】C B 77 A -161.6 D
【详解】
①自发反应需满足△G=ΔH-TΔS<0,若ΔH<0且ΔS>0,则△G一定小于0,反应在任何温度下都能自发进行,故此处填C;
②若ΔH>0且ΔS<0,则△G一定大于0,反应在任何温度下都不能自发进行,故此处填B;
③将反应A对应数据代入ΔH-TΔS<0计算,得反应自发进行的温度要求为:T>350 K,即350-273=77 ℃,故此处A、77 ℃;将反应D对应数据代入ΔH-TΔS<0计算,得反应自发进行的温度要求为:T<111.4 K,即111.4-273= -161.6 ℃,故此处D、-161.6 ℃;
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第17讲 暑假小测(3): 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第17讲 暑假小测(3),文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第17讲暑假小测3教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第17讲暑假小测3学生版docx等2份学案配套教学资源,其中学案共16页, 欢迎下载使用。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第15讲 水的电离 讲学案: 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第15讲 水的电离 讲学案,文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第15讲水的电离教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第15讲水的电离学生版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第12讲 暑假小测(2): 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第12讲 暑假小测(2),文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第12讲暑假小测2教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第12讲暑假小测2学生版docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。












