

【暑假初升高】人教版化学初三(升高一)暑假预习-第19讲 元素周期律 讲学案
展开第19讲 元素周期律
【学习目标】
1.了解元素原子核外电子排布、原子半径、元素主要化合价等元素性质的周期性变化,理解元素周期律及其实质。
2.会判断微粒半径的大小。
3.知道元素周期表的简单分区,进一步认识元素周期表是元素周期律的具体表现形式。
4.学会运用元素周期表、元素周期律的知识,解决有关问题。
【基础知识】
①原子结构与元素性质、元素化合价的关系
原子类别
与元素性质的关系
与元素化合价的关系
稀有气体
最外层电子数为8(He为2),结构稳定,性质不活泼
原子结构为稳定结构,常见化合价为零
金属元素原子
最外层电子数一般小于4,较易失去电子
易失去最外层电子,达到稳定结构,其最高正价为+m(m为最外层电子数)
非金属元素原子
最外层电子数一般大于或等于4,较易获得电子,形成8电子稳定结构
得到一定数目的电子,达到稳定结构,其最低负价为m-8(H为m-2)
②元素的主要化合价
元素最高价与最低价的关系
元素最高化合价=最外层电子数(O、F除外)
最低化合价=最外层电子数-8
|最高化合价|+|最低化合价|=8
常见元素化合价的特点
H:+1、-1、0价,如H2O、NaH、H2。
F:-1、0价,如NaF、F2(F无最正价)。
O:常见有-2、-1、0价,如CaO、Na2O2、O2(O无最高正价)。
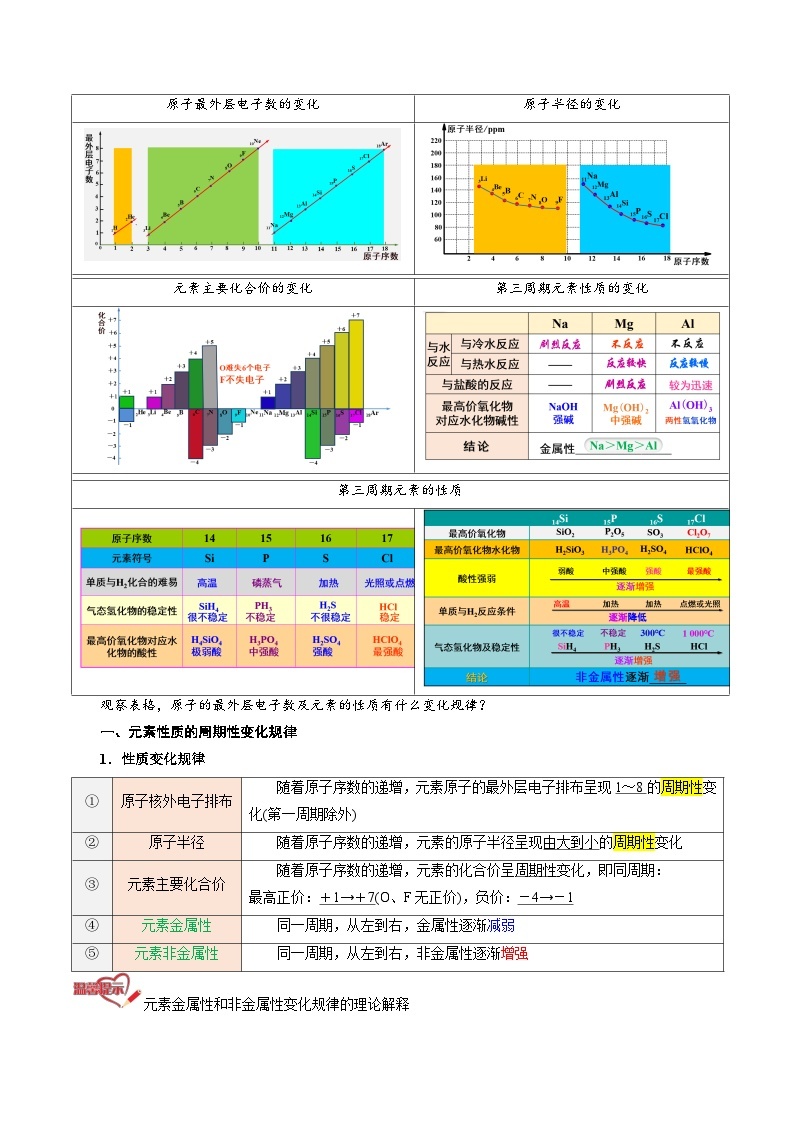
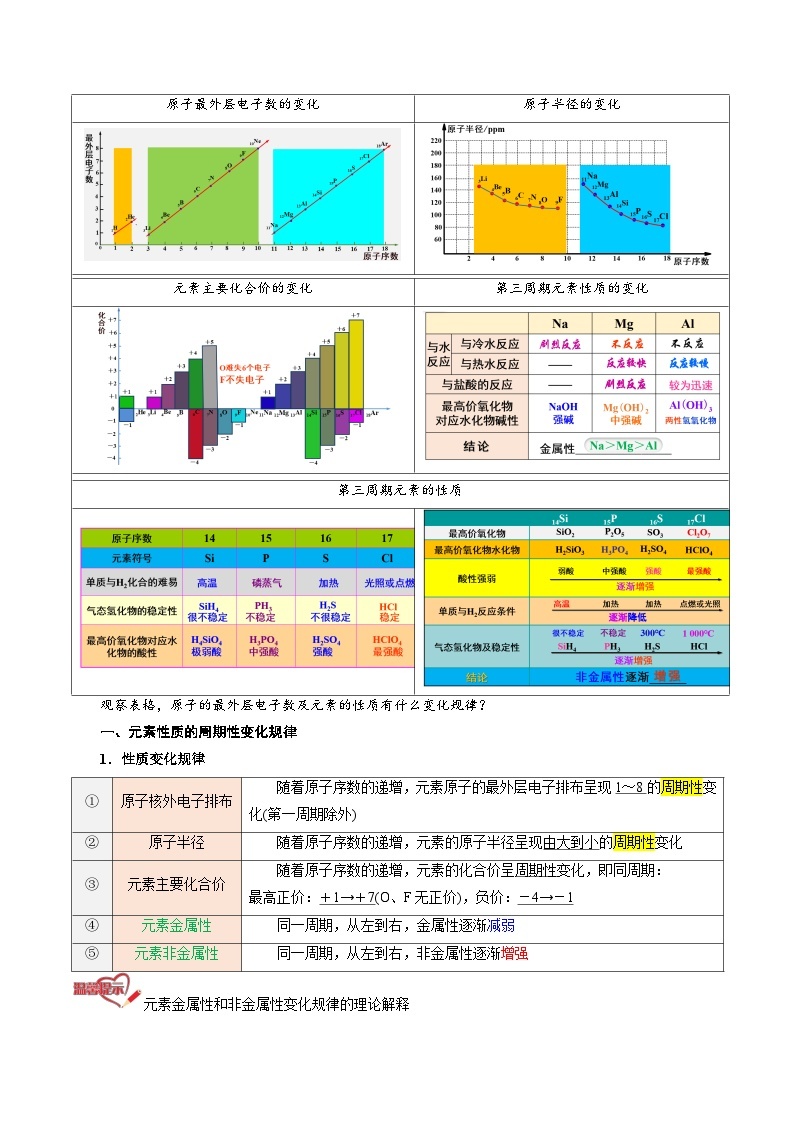
原子最外层电子数的变化
原子半径的变化
元素主要化合价的变化
第三周期元素性质的变化
第三周期元素的性质
观察表格,原子的最外层电子数及元素的性质有什么变化规律?
一、元素性质的周期性变化规律
1.性质变化规律
①
原子核外电子排布
随着原子序数的递增,元素原子的最外层电子排布呈现1~8的周期性变化(第一周期除外)
②
原子半径
随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化
③
元素主要化合价
随着原子序数的递增,元素的化合价呈周期性变化,即同周期:
最高正价:+1→+7(O、F无正价),负价:-4→-1
④
元素金属性
同一周期,从左到右,金属性逐渐减弱
⑤
元素非金属性
同一周期,从左到右,非金属性逐渐增强
元素金属性和非金属性变化规律的理论解释
同一周期元素,电子层数相同,从左到右,核电荷数依次增多,最外层电子数逐渐增多,原子半径逐渐减小,越容易得到电子形成稳定结构,非金属性逐渐增强,金属性逐渐减弱。
(2022年河南省信阳市期末)如图,甲至庚为短周期七种元素常见化合价与原子序数的关系,下列说法正确的是
A.甲元素位于元素周期表第14列
B.丙、丁、庚三种元素的原子半径由大到小的顺序为:庚>丁>丙
C.最简单氢化物的稳定性:乙>丙
D.这七种元素中,最高价氧化物的水化物酸性最强的是己
2.元素周期律
概念
元素的性质随着原子序数的递增而呈周期性变化
实质
元素性质的周期性变化是原子核外电子排布周期性变化的必然结果
(2022年北京市丰台区期中)下列有关性质的比较,不能用元素周期律解释的是
A.金属性:Mg>Al B.热稳定性:Na2CO3>NaHCO3
C.还原性:S2->Cl- D.碱性:NaOH>Mg(OH)2
同周期同主族元素的原子半径呈现周期性变化,若元素位于不同周期、主族,如何判断半径大小?
二、粒子半径大小的比较方法
类型
方法
实例
同周期
——“序大径小”
周期,从左到右,随着原子序数的递增,原子半径逐渐减小
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
同主族
——“序大径大”
同主族,从上到下,随着原子序数的递增,原子半径逐渐增大
r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)
同元素
原子和离子——“阴大阳小”
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如r(Na+)<r(Na);r(Cl-)>r(Cl)
不同价态的阳离子——“数大径小”
带电荷数越多,粒子半径越小
r(Fe3+)<r(Fe2+)<r(Fe)
同结构
——“序大径小”
电子层结构相同的离子,核电荷数越大,离子半径越小
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
同
(2022年河南省林州市期末)比较下列各组微粒半径,正确的是
①Cl<Cl-<Br- ②F-<Mg2+<Al3+ ③Na+<Na<K ④S2-<Cl-<Br-
A.①③ B.②③ C.③④ D.①④
三、元素周期表和元素周期律的应用
1.元素周期表的分区及应用
(1)元素周期表的金属区和非金属区
金属元素在分界线的左侧,但分界线的左侧并不都是金属元素,如氢元素属于非金属元素
元素周期表的左下方元素的金属性最强,右上方元素的(稀有气体元素除外)非金属性最强
由于元素的金属性和非金属性没有严格的界限,因此,位于分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性
(2)元素化合价与其在周期表中位置的关系
①O、F原子半径小,原子核对外层电子的吸引能力强,F无正化合价,O无最高正价。
②元素的最高正价和最低负价的绝对值之差与族序数的关系:
最高正价-|最低负价|
6
4
2
0
主族族序数
ⅦA
ⅥA
ⅤA
ⅣA
2.一定区域内寻找新物质
①金属与非金属分界线半导体材料,如Si、Ge、Ga等。
②过渡元素催化剂和耐高温、耐腐蚀合金的元素,如Fe、Ni、Pt、Pd等。
③周期表右上角制造农药的元素,如氟、氯、硫、磷附近的元素。
3.“位—构—性”关系及应用
(1)元素的“位—构—性”之间的关系
结构与位置的关系
结构位置
结构与性质的关系
结构性质
位置、结构和性质的关系
同周期(左→右)―→最外层电子数递增―→非金属性增强、金属性减弱
同主放(上→下)―→电子层数递增―→非金属性减弱、金属性增强
2.元素“位—构—性”规律中的特例
①绝大多数原子的原子核是由质子和中子构成的,只有氕(H)无中子。
②元素周期表中的周期一般是从金属元素开始,但第一周期例外,是从氢元素开始。
③所有元素中,碳元素形成的化合物种类最多。
④非金属单质一般不导电,但石墨是导体,晶体硅是半导体。
⑤氟无正价,氧无最高正价;在Na2O2中氧显-1价;在NaH中氢显-1价。
陌生元素的性质的推断
(1)与同周期前、后元素相比较,依据同周期元素性质的递变规律推测元素的性质。
(2)与同主族上、下元素相比较,依据同主族元素性质的递变规律推测元素的性质。
(3)比较不同周期,不同主族元素性质时,可借助“三角”规律进行推断。
若A、B、C三种元素位于元素周期表中如图所示位置,有关元素的各种性质均可排出顺序(但D不能参与排列)。如原子半径:C>A>B;金属性:C>A>B;非金属性:B>A>C。
(2022年湖北省期末)铬(Cr)是一种重要的金属,其金属性介于锌和铁之间。根据元素周期律的知识,下列关于铬及其化合物的说法错误的是
A.铬与冷水能发生剧烈反应
B.Cr(OH)3的碱性比NaOH的弱
C.高温条件下,Cr2O3能与Al反应置换出Cr
D.铬能与稀盐酸发生反应
【考点剖析】
考点一:化合价变化规律应用
例1.(2022年江苏省天一中学期末)下图是部分短周期元素的常见化合价与原子序数的关系图,下列说法正确的是
A.非金属性强弱:A>B
B.离子半径大小:G2->C2-
C.原子半径大小:G>F>E>D
D.将0.5 mol D2C2与水完全反应转移1 mol e-
考点二:化合价与原子半径变化规律应用
例1.(2022年黑龙江省大庆铁人中学期末)几种短周期元素的原子半径及某些化合价见下表
元素代号
A
B
D
E
G
H
I
J
化合价
-1
-2
+4、-4
-1
+5、-3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
分析判断下列说法正确的是
A.D、H、J的氧化物分别为酸性氧化物、两性氧化物、碱性氧化物
B.A、H、J的离子半径由大到小的顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
考点三:元素周期表与元素周期律综合
例3.(2022年安徽省安庆市期末)A、B、C、D、E均为短周期元素且原子序数依次增大,其中A元素的某一同位素常用于考古时测定一些文物年代,B元素的原子最外层电子数是次外层电子数的3倍,含C元素的物质焰色试验火焰呈黄色,B与D同族,E-与某稀有气体具有相同的电子层结构。下列说法正确的是
A.简单离子半径:E>D>C
B.氢化物稳定性:A>B
C.B、C形成的化合物之一可用作供氧剂
D.最高价氧化物的水化物的酸性:E>D
考点四:金属性与非金属性强弱判断
例4.(2022年河南省濮阳市期末)联合国将2019年定为“国际化学元素周期表年”,彰显了元素周期表的重要性。下表是元素周期表的一部分,①~⑨代表9种短周期主族元素。
①
②
③
④
⑤
⑥
⑦
⑧
⑨
回答下列问题:
(1)这9种元素中原子半径最小的是_______(填元素符号)。
(2)因在元素①的电池材料领域做出了杰出贡献,古迪纳夫等三人荣获2019年诺贝尔化学奖,①的单质与氧气共热时的化学方程式为_________________________________。
(3)⑦的单质与⑤的最高价氧化物的水化物的水溶液反应的离子方程式为_______________________________________________。
(4)设计实验比较②与⑧的非金属性强弱,写出简要的操作、现象与结论:_______________________________________________________________________。
考点五:元素周期表和周期律的应用
例5.(2022年广东省汕头市潮南区期末)元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左下方区域的金属元素 B.右上方区域的非金属元素
C.金属元素和非金属元素分界线附近元素 D.稀有气体元素
考点六:元素性质的预测
例6.(2022年黑龙江省大庆铁人中学期末)元素周期表中第116号元素已由俄罗斯科学家找到。假设第116号元素的元素符号为R,则下列有关叙述中正确的是
A.R的非金属性比S强
B.R元素原子的内层电子共有110个
C.R是过渡金属元素
D.R元素原子的最高价氧化物的水化物为强酸
【真题演练】
1.(2022年河北省廊坊市期末)元素周期表中某区域的一些元素多用于制造催化剂和耐高温、耐腐蚀的合金,该区域是
A.稀有气体元素区域
B.过渡元素区域
C.右上方的非金属元素区域
D.金属元素和非金属元素分界线附近的元素区域
2.(2022年上海市静安区期末)下列化合物中,阳离子与阴离子半径之比最大的是
A.LiCl B.NaBr C.KI D.KF
3.(2022年安徽省宣城市期末)下列关于物质性质的比较,不正确的是
A.元素最高化合价:F>N B.原子半径:Al>Si
C.元素金属性强弱:K>Na D.酸性强弱:H2SO4>H3PO4
4.(2022年北京市房山区期中)下列性质的比较,不能用元素周期律解释的是
A.原子半径:S>O B.热稳定性:Na2CO3>NaHCO3
C.还原性:I->Br- D.酸性:H2SO4>H3PO4
5.(2022年江苏省江阴市期末)下列关于物质性质的比较,正确的是
A.酸性强弱:HIO4>HBrO4>HClO4
B.原子半径大小:S>Na>O
C.氢化物稳定性大小:HF>H2O>PH3
D.碱性强弱:LiOH>NaOH>KOH
6.(2022年江苏省天一中学期末)砷为第四周期第VA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是
A.砷在通常情况下是固体
B.可以存在-3、+3、+5等多种化合价
C.砷的最高价氧化物对应水化物的酸性比H3PO4弱
D.砷的气态氢化物比磷的气态氢化物稳定
7.(2022年甘肃省兰州市教育局第四片区期末)四种短周期元素在元素周期表中的位置如图所示,T是地壳中含量最高的金属元素。下列说法不正确的是
Q
T
R
W
A.W氢化物比R的氢化物稳定
B.T的最高价氧化物对应的水化物可能为强碱
C.Q的原子半径比T的小
D.W和Q的原子序数相差10
8.(2022年广东省潮州市潮安区期末)下面为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
族
周期
IA
0
1
①
IIA
IIIA
IVA
VA
VIA
VIIA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)①的元素名称为:___________,元素④的原子结构示意图为___________。
(2)②的最高价氧化物对应水化物酸性比③的最高价氧化物对应水化物酸性弱的原因是_________(填字母)。
A.②的单质为固体,而③的单质为气体
B.原子半径②比③大
C.②的非金属性比③弱
D.原子序数③比②大
(3)②、④组成的能引起温室效应的化合物的电子式为_____________________,其中含有的化学键为___________。
(4)②、⑧的最高价氧化物对应水化物的酸性从强到弱的顺序为_________________(用化学式表示)。
(5)③、⑤、⑦三种元素的离子半径从大到小顺序为___________(用元素符号表示)。
(6)写出元素⑤⑥对应的最高价氧化物的水化物相互之间发生反应的化学方程式_____________________________。
【过关检测】
1.(2022年北京市房山区期中)下列元素中,原子半径最小的是
A.Na B.Al C.S D.Cl
2.(2022年河北省廊坊市期末)元素周期表中某区域的一些元素多用于制造催化剂和耐高温、耐腐蚀的合金,该区域是
A.稀有气体元素区域
B.过渡元素区域
C.右上方的非金属元素区域
D.金属元素和非金属元素分界线附近的元素区域
3.(2022年安徽省安庆市期末)不能用元素周期律解释的是
A.酸性:HCl>H2CO3 B.碱性:NaOH>Mg(OH)2
C.与水反应:K比Na剧烈 D.与H2反应:F2比Cl2剧烈
4.(2022年江苏省连云港市期末)短周期主族元素X、Y、Z、M、N的原子序数依次增大,原子半径及主要化合价见下表:
4元素
X
Y
Z
M
N
原子半径/pm
66
186
160
143
104
主要化合价
-2
+1
+2
+3
-2、+4、+6
根据表中信息,判断以下说法正确的是
A.离子半径:r(N2-)>r(Z2+)
B.由X、Y两种元素组成的化合物只有一种
C.相同条件下,简单气态氢化物的热稳定性:N>X
D.元素Y、Z、M中,M原子失电子能力最强
5.(2022年黑龙江省大庆铁人中学期末)短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是其质子数的,X原子的核电荷数等于Z原子的最外层电子数,元素Y的最外层电子数与最内层电子数相等。下列说法正确的是
A.单质的沸点:W<X
B.简单离子的半径:Z>Y
C.X、Z的氧化物对应的水化物均为强酸
D.X、Y可形成化合物Y2X3
6.(2022年福建省泉州市两校联考期中)在通常条件下,下列各组物质的性质排列错误的是
A.还原性强弱:Cl-<Br-<I- B.热稳定性:HF>H2O>NH3
C.微粒半径大小:S2->Na+>O2- D.酸性:HCl>H2CO3>HClO
7.(2022年广东省广州市海珠区期末)已知:33As(砷)与P为同族元素。下列说法不正确的是
A.As原子核外最外层有5个电子
B.AsH3的电子式是
C.热稳定性:AsH3<PH3
D.非金属性:As<Cl
8.(2022年安徽省宣城市期末)短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是
A.X是第二周期第ⅣA族元素 B.Y形成的最高价氧化物的水化物是弱碱
C.X的简单气态氢化物的稳定性比Z的弱 D.X、Y、Z三种元素可形成化合物Y2ZX4
9.(2022年广东省广州市海珠区期末)联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期表的重要性。表中列出了部分元素在周期表中的位置:
回答下列问题:
(1)元素a~k中非金属性最强的是_________(填元素符号),b与g的原子核电荷数相差_______(填数值)。
(2)e、f、j三种元素最高价氧化物对应的水化物的碱性由强到弱依次为__________(填化学式)。
(3)设计一个实验方案,比较h、k单质氧化性的强弱_____________________________________。
(4)金属镓(Ga)常用作光学玻璃、真空管、半导体的原料。
①预测Ga的化学性质并填写表格:
预测性质(所填物质类别不同)
反应后可能的生成物(填化学式)
Ga能与___________反应
__________
Ga能与___________反应
Ga2(SO4)3、_________
Ga能与NaOH溶液反应
___________
以上预测都是依据__________________________________________________。
②氮化镓(CaN)材料的研究与应用是目前全球半导体研究的前沿和热点。工业上用含铁酸镓Ga2(Fe2O4)3矿渣经过硫酸浸出获得2种金属盐,进一步利用镓盐可制备具有优异光电性能的CaN。写出Ga2(Fe2O4)3用硫酸浸出时发生反应的离子方程式为_____________________________________________。
10.(2022年河南省新乡市期末)某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。
实验方案
实验现象
①将氯气通入Na2S溶液中
有淡黄色固体(S)生成
②将一小块金属镁,用砂纸磨去表面的氧化膜后,放入试管中,加入2 mL水,观察现象,记录为现象I ,过一会儿,加热试管至液体沸腾,观察现象,记录为现象II
现象 I :无明显变化
现象II:金属镁逐渐溶解,有气体生成
③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液
溶液变蓝
④将一小块金属钠放入冷水中
钠浮在水面上,熔成小球,四处游动,逐渐消失
回答下列问题:
(1)实验①相关反应的离子方程式为___________________________。由实验①可知,C1、S的非金属性由强到弱的顺序为_________________(用元素符号表示,下同)。由实验③可知,Br、I的非金属性由强到弱的顺序为_______________。
(2)由实验②和实验④知,碱性:NaOH___________(填“>”或“<”)Mg(OH)2。
(3)实验结论:同主族元素自上而下,元素的非金属性逐渐___________(填“增强”或“减弱”,下同);同周期元素,原子序数逐渐增大,金属性逐渐___________,非金属性逐渐___________。由此可知:H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为_____________________________(填化学式,下同);常见氢化物NH3、H2O、HF、H2S中稳定性最强的是________。
【暑假初升高】人教版化学初三(升高一)暑假预习-第17讲 元素周期表 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第17讲 元素周期表 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第17讲元素周期表解析版docx、暑假初升高人教版化学初三升高一暑假预习-第17讲元素周期表原卷版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第16讲 原子结构与核素 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素解析版docx、暑假初升高人教版化学初三升高一暑假预习-第16讲原子结构与核素原卷版docx等2份学案配套教学资源,其中学案共24页, 欢迎下载使用。
【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第15讲 金属材料 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料解析版docx、暑假初升高人教版化学初三升高一暑假预习-第15讲金属材料原卷版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。












