



- 专题01 硫、氮、硅及其化合物的性质及转化——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 5 次下载
- 专题03 物质的制备与性质实验探究——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 3 次下载
- 专题04 化学能与热能——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 2 次下载
- 专题05 化学能与电能——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 3 次下载
- 专题06 化学反应速率与平衡思想——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册) 学案 2 次下载
专题02 无机推断题与无机综合题——2022-2023学年高一化学下学期期末专项突破学案(人教版2019必修第二册)
展开必刷02 无机推断题与无机综合题(14题)
1.已知某物质X能发生如图转化,下列有关转化关系中物质及其反应的叙述错误的是
XYZA
A.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
B.若X为S单质,则A为硫酸
C.若X为S单质,则A不一定能与金属铜反应生成Y
D.若X为N2或NH3,则A为硝酸
【答案】A
【分析】X经两步氧化反应生成Z,Z与H2O反应生成A,常见的符合转化关系的有:NaNa2ONa2O2NaOH、S(或H2S) SO2SO3H2SO4、N2(或NH3) NONO2HNO3等;据此分析作答。
【解析】A.反应①和②一定为氧化还原反应,反应③不一定为非氧化还原反应,如X、Y、Z、A依次为N2、NO、NO2、HNO3时,反应③为3NO2+H2O=2HNO3+NO,该反应属于氧化还原反应,A错误;
B.若X为S单质,S与O2点燃时反应生成的Y为SO2,SO2发生催化氧化生成的Z为SO3,SO3与H2O化合成硫酸,即A为硫酸,B正确;
C.根据B项分析,A为硫酸,Cu与浓硫酸常温下不反应,Cu与浓硫酸加热时反应生成CuSO4、SO2和水,Cu与稀硫酸不反应, C正确;
D.若X为N2或NH3,N2与O2放电或高温下化合成NO、NH3发生催化氧化反应生成NO,Y为NO,NO与O2化合成NO2,Z为NO2,NO2与H2O反应生成HNO3和NO,则A为HNO3,D正确;
答案选A。
2.如图中的字母代表硫及其化合物,相关推断不合理的是
A.ab溶液反应有d生成
B.e和f都存在酸式盐
C.硫酸型酸雨的形成过程涉及b→c的转化
D.检验g中阴离子所用试剂只需BaCl2溶液
【答案】D
【解析】根据硫及其化合物的转化关系图可知,a为H2S,b为H2SO3,c为H2SO4,d为S,e为硫化物,f为亚硫酸盐,g为硫酸盐。
A项,H2S和H2SO3反应可以生成中间价态的S,正确;B项,若为钠盐,则e为-2价的Na2S或NaHS,f为Na2SO3或NaHSO3,正确;C项,b为H2SO3,c为H2SO4,硫酸型酸雨是H2SO3被空气中氧气氧化为H2SO4,正确;D项,检验硫酸根,应该用盐酸和BaCl2溶液,错误。
3.某固体X由(NH4)2CO3、Cu2O、Fe、Fe2O3、NaAlO2、K2SO4中四种组成,取固体粉末X进行连续实验,实验过程及产物如下:
已知:Cu2O+2H+=Cu2++Cu+H2O,下列说法不正确的是
A.固体C是Cu,固体A一定含有Cu2O
B.气体B可能使品红溶液褪色
C.气体A可以用湿润的红色石蕊试纸检验
D.固体X不可能同时含有Fe和Fe2O3
【答案】B
【分析】
固体X由(NH4)2CO3、Cu2O、Fe、Fe2O3、NaAlO2、K2SO4中四种组成,固体X和NaOH溶液反应生成气体A,该气体为NH3,则固体X中一定含有(NH4)2CO3,向溶液A中加入适量盐酸,生成气体B和固体B,气体B为CO2,固体B为Al(OH)3,则X中一定含有NaAlO2,向固体A中加入过量盐酸,生成固体C,固体C为Cu,则X中一定含有Cu2O,向溶液B中加入KSCN溶液、H2O2,溶液变红,说明溶液B中含有Fe2+或Fe3+,则X中一定含有Fe元素,即含有Fe或Fe2O3。
【解析】A.由分析可知,固体C为Cu,固体A一定含有Cu2O,A项正确;
B.气体B为CO2,不能使品红溶液褪色,B项错误;
C.气体A为NH3,是碱性气体,可以使湿润的红色石蕊试纸变蓝,所以气体A可以用湿润的红色石蕊试纸检验,C项正确;
D.固体X由(NH4)2CO3、Cu2O、Fe、Fe2O3、NaAlO2、K2SO4中四种组成,X中一定含有(NH4)2CO3、NaAlO2、Cu2O,故X只能含有Fe和Fe2O3中的一种,即固体X不可能同时含有Fe和Fe2O3,D项正确;
答案选B。
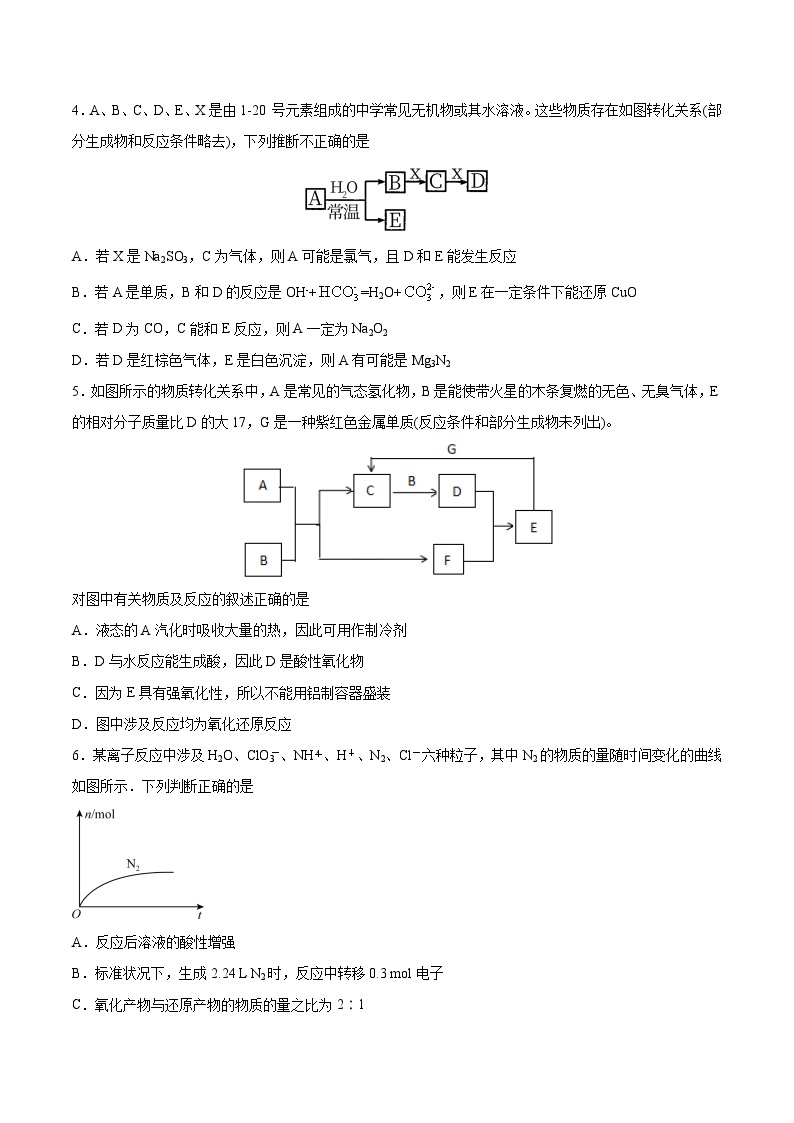
4.A、B、C、D、E、X是由1-20 号元素组成的中学常见无机物或其水溶液。这些物质存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是
A.若X是Na2SO3,C为气体,则A可能是氯气,且D和E能发生反应
B.若A是单质,B和D的反应是OH-+=H2O+,则E在一定条件下能还原CuO
C.若D为CO,C能和E反应,则A一定为Na2O2
D.若D是红棕色气体,E是白色沉淀,则A有可能是Mg3N2
【答案】C
【解析】A.若X是Na2SO3,C为气体SO2,D是NaHSO3,若A是Cl2,Cl2与H2O反应产生HCl和HClO,B是HCl,E是HClO,NaHSO3具有还原性,而HClO具有强氧化性,二者会发生氧化还原反应产生Na2SO4和HClO,故D和E能发生反应,A正确;
B.若A是单质,能与水反应生成B与E,B、D反应的离子方程式OH-+=H2O+,则可推知A为Na,B为NaOH、E为H2,若X为CO2,则C为Na2CO3,D为NaHCO3,H2在加热条件下能将CuO还原为Cu单质,B正确;
C.D为CO,可以判断X为C,B为O2,C为CO2,A与水反应生成O2,A在常温下与水反应能够产生O2,则A可能为K2O2或Na2O2或F2。C能和E反应,若A为F2,则E为HF,而HF与CO2不反应,故A可能为Na2O2,也可能是K2O2,但不一定是Na2O2,C错误;
D.若D是红棕色气体,则D是NO2,X是O2,C是NO,B是NH3,E是白色沉淀,若A是Mg3N2,Mg3N2与H2O反应产生NH3和Mg(OH)2,E是Mg(OH)2,符合物质转化关系,D正确;
故合理选项是C。
5.如图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无臭气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。
对图中有关物质及反应的叙述正确的是
A.液态的A汽化时吸收大量的热,因此可用作制冷剂
B.D与水反应能生成酸,因此D是酸性氧化物
C.因为E具有强氧化性,所以不能用铝制容器盛装
D.图中涉及反应均为氧化还原反应
【答案】AD
【分析】
B能使带火星的木条复燃的无色无味气体,则B是O2;G是一种紫红色金属单质,则G是Cu,A是常见的气态氢化物,能与氧气反应生成C与F,则C、F分别为氧化物与水中的一种,而C能与氧气反应生成D,则C为氧化物,F是H2O,D与水反应得到E,E能与Cu反应得到C,中学中N、S元素化合物符合转化关系,由于E的相对分子质量比D大17,可推知E为HNO3、D是NO2,则A是NH3,C是NO,结合对应物质的性质进行解答。
【解析】根据上述分析可知:A是NH3,B是O2,C是NO,D是NO2,E为HNO3,F是H2O,G是Cu。
A.A是NH3,液氨气化吸收大量的热,使周围环境温度降低,因此液氨可用作制冷剂,A正确;
B.D是NO2,NO2与水反应产生HNO3和NO,反应过程中元素化合价发生了变化,所以NO2不是酸性氧化物,B错误;
C.E为HNO3,具有强氧化性,在室温下遇Fe、Al,能够将金属氧化,在金属表面产生一层致密的氧化物保护膜,阻止金属进一步反应,因此能用铝制容器盛装,C错误;
D.在上述图中涉及反应中,都存在元素化合价的变化,因此均为氧化还原反应,D正确;
故合理选项是AD。
6.某离子反应中涉及H2O、ClO3-、NH、H+、N2、Cl-六种粒子,其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是
A.反应后溶液的酸性增强
B.标准状况下,生成2.24 L N2时,反应中转移0.3 mol电子
C.氧化产物与还原产物的物质的量之比为2∶1
D.ClO3-被还原,是还原剂
【答案】A
【解析】由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH是反应物,其N的价态升高,NH作还原剂,ClO-则作氧化剂,其还原产物是Cl-,则反应的离子方程式为:ClO-+NH―→Cl-+N2↑,Cl降低2价、N升高3价,据电子守恒有3ClO-+2NH―→3Cl-+1N2↑,再据电荷守恒有有3ClO-+2NH―→3Cl-+1N2↑+2H+,最后由质量守恒得3ClO-+2NH=3Cl-+N2↑+2H++3H2O。
A项,反应生成H+,溶液的酸性增强,正确;B项,反应3ClO-+2NH=3Cl-+N2↑+2H++3H2O中转移的电子数为6,则生成2.24 L N2(0.1 mol),转移电子的物质的量为0.6 mol,错误;C项,由方程式可知,N2为氧化产物,Cl-是还原产物,氧化产物与还原产物的物质的量之比为1∶3,错误;D项,由上述方程式可知,该反应的还原剂是NH,ClO3-被还原,ClO3-是氧化剂,错误。
7.已知A是一种常见非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,其转化关系如图所示:
(1)若E、D的水溶液均呈酸性,试写出E与B反应时的化学方程式___________。
(2)若D是一种难溶于水的凝胶,试写出反应③的离子方程式___________。
(3)若E的水溶液呈碱性,若D的水溶液显酸性,写出反应②的化学方程式___________。
【答案】2H2S+SO2=3S↓+2H2O SiO2+2OH﹣=+H2O 4NH3+5O24NO+6H2O
【解析】(1)从图中可知单质A可被O2氧化,若E、D的水溶液均呈酸性,说明A应是S,E是H2S,B是SO2,顺次推知C是SO3,D是H2SO4,H2S和SO2反应的方程式为2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O;
(2)非金属元素最高价氧化物对应的水化物难溶于水的只有H2SiO3,则A是Si,E是SiH4,B是SiO2,C应是硅酸盐,D是H2SiO3,SiO2与NaOH等溶液反应生成硅酸盐,反应的离子方程式为SiO2+2OH﹣=+H2O,故答案为:SiO2+2OH﹣=+H2O;
(3)若E的水溶液呈碱性,应为NH3,若由转化关系可知A为N2,B为NO,C为NO2,D的水溶液显酸性,应为HNO3,E为氨气,发生催化氧化生成NO,反应的方程式为4NH3+5O24NO+6H2O,故答案为:4NH3+5O24NO+6H2O。
8.A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如图所示(反应条件及其他物质已经略去):
ABCD。
(1)若A为淡黄色固体单质,且D为强酸。
①A为_______ ,写出一个证明该物质具有氧化性的化学方程式____________。
②写出B→C化学方程式_________。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出A→B的化学方程式__________。
②D的浓溶液需保存在棕色试剂瓶的原因是__________(写化学方程式)。
③B、C都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应 C.形成光化学烟雾 D.引起水体富营养化
【答案】S Fe+SFeS 2SO2+O22SO3 4NH3+5O24NO+6H2O 4HNO3(浓)4NO2↑+O2↑+2H2O AC
【分析】
(1)根据物质颜色和终态可确定A为S单质,根据一系列反应得出D为硫酸;
(2)根据使湿润的红色石蕊试纸变蓝确定A是氨气,进而确定D是硝酸。
【解析】(1)①常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸;可根据S与Fe在加热时反应产生Fe说明S具有氧化性,反应方程式为:Fe+SFeS ;
②B→C转化的化学方程式2SO2+O22SO3;
(2)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是NH3;NH3与O2反应产生的B是NO;NO与O2反应产生的C是NO2;NO2与H2O反应产生的D是HNO3。
①NH3与O2在催化剂存在条件下发生氧化反应产生NO、H2O,反应方程式为:4NH3+5O24NO+6H2O;
②D是HNO3,浓硝酸不稳定,光照易分解,浓度越大,温度越高,物质越容易分解,为避免硝酸分解,通常将其保存在棕色试剂瓶,物质分解反应方程式为:4HNO3(浓)4NO2↑+O2↑+2H2O;
③NO、NO2与空气中的O2、H2O接触,会产生HNO3,导致酸雨;还会与空气中的飘尘作用产生光化学烟雾,故NO、NO2对环境造成的危害表现在产生酸雨和光化学烟雾,合理选项是AC。
【点睛】
本题考查元素及化合物的推断。把S和NH3以及硫酸、硝酸的制取、环境污染等结合起来,引导学生对S、N两种元素及其化合物的性质进行总结,启发学生,学习时要善于归纳总结,形成比较系统的知识结构。
9.A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
请回答下列问题:
(1)D的化学式为__________,Y的化学式为__________,E的化学式为__________。
(2)Y与氧化铜反应,每生成1 mol B消耗3 mol氧化铜,该反应的化学方程式为:______________________。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为___________________。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?(填“有”或 “没有”)______,理由是______________________。
(5)A的单质在中学化学中应用非常广泛,写出实验室制取它的化学方程式:______________。
【答案】H2 NH3 NO 2NH3+3CuON2+3Cu+3H2O 6NO+4NH35N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀 MnO2+4HClCl2↑+MnCl2+2H2O
【分析】
E的相对分子质量比F小16,且F为红棕色气体,则F为NO2,E为NO,根据转化关系图可知,C为O2,因NO2可以与H2O反应生成NO和HNO3,则可推出Z为H2O,G为HNO3,结合图中关系及“A、B、C、D是四种常见气体单质”信息可知,D为H2,又X与Y结合能生成白烟,两者应为氨气与HCl气体,其中Y还可以与CuO发生氧化还原反应生成B单质和水,则逆推知,A为Cl2,B为N2,X为HCl,Y为NH3,白烟的成分为氯化铵,据此结合题意分析解答。
【解析】根据上述分析可知,A为Cl2,B为N2,C为O2,D为H2,F为NO2,E为NO,X为HCl,Y为NH3,Z为H2O,G为HNO3,则
(1)D的化学式为H2;Y的化学式为NH3;E的化学式为NO;
(2)Y(NH3)具有还原性,可与氧化铜会发生氧化还原反应,每生成1 mol B(N2)消耗3 mol氧化铜,转移6mol电子,该反应的化学方程式为2NH3+3CuON2+3Cu+3H2O;
(3)Y(NH3)与E(NO)在一定条件下可发生归中反应生成B(N2)和Z(H2O),根据氧化还原反应的规律可知,该反应的化学方程式为:6NO+4NH35N2+6H2O;
(4)二氧化氮可以与水反应生成硝酸和NO,硝酸具有强氧化性,可将二氧化硫或亚硫酸氧化为硫酸,进而与钡离子会反应生成不溶于水也不溶于酸的硫酸钡白色沉淀,故答案为:有;二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀;
(5)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,其化学方程式为:MnO2+4HClCl2↑+MnCl2+2H2O。
10.Ⅰ.物质X、Y、Z均含同种短周期元素,其转化关系如下图所示(反应条件未标出)。
XYZ
(1)若X是无色极易溶于水的刺激性气味气体,Z是红棕色气体,由Y与W反应生成Z的化学方程式是_______。
(2)若X含三种短周期元素,其中两种元素的原子的质子数之和等于另一种元素原子的质子数,单质W是常见金属,则X的稀溶液转化为Y的离子方程式是_______。
(3)若X是空气的主要成分之一,W原子的最外层电子数是内层电子数的二倍;则Y与W反应生成0.1 mol Z时,反应中转移的电子数为_______。
Ⅱ.已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式_______。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是_______
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式_______。
【答案】2NO+O2=2NO2 Fe+4H++=Fe3++NO↑+2H2O 6.02×1022(或0.1NA) C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 3Cu+8H++2=3Cu2++2NO↑+4H2O 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
【解析】Ⅰ.(1)若Z是红棕色气体,则Z为NO2,X是无色极易溶于水的刺激性气味气体,则X为NH3,从而得出Y为NO,W为O2,由Y(NO)与W(O2)反应生成Z(NO2)的化学方程式是2NO+O2=2NO2。答案为:2NO+O2=2NO2;
(2)若X含三种短周期元素,其中两种元素的原子的质子数之和等于另一种元素原子的质子数,则三种元素构成含氧酸,从而得出三种元素为H、N、O,单质W应为Fe,则X(HNO3)的稀溶液转化为Y[Fe(NO3)3]的离子方程式是Fe+4H++=Fe3++NO↑+2H2O。答案为:Fe+4H++=Fe3++NO↑+2H2O;
(3)若W原子的最外层电子数是内层电子数的二倍,则其为碳,X是空气的主要成分之一,则其为O2,从而得出Y为CO2,Z为CO;Y(CO2)与W(C)反应生成0.1 mol Z(CO)时,可建立关系式CO——e-,从而求出反应中转移的电子数为6.02×1022(或0.1NA)。答案为:6.02×1022(或0.1NA);
Ⅱ.常温下,E是一种无色无味的液体,则E为H2O。
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,则A为碳、B为浓硫酸、C和D分别为CO2、SO2,此反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。答案为:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A为Cu、B为稀硝酸、C为NO,反应的离子方程式是3Cu+8H++2=3Cu2++2NO↑+4H2O。答案为:3Cu+8H++2=3Cu2++2NO↑+4H2O;
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,则C为NH3,反应物为NH4Cl和Ca(OH)2,此反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。答案为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
11.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A被称为国防金属,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,反应①的化学方程式为_____,反应④的化学方程式为______。
(2)若A为常见的金属单质,D、F是气态单质,且D、F混合光照爆炸生成B,反应①、②都在水溶液中进行,则检验E中阳离子最好的试剂是______(填化学式)。
【答案】2Mg+CO22MgO+C C+4HNO3(浓)CO2↑+4NO2↑+2H2O KSCN
【分析】
(1)若A为被称为国防金属,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,A所含元素的原子最外层电子数D是A的2倍,则A是Mg,D是C,B是CO2,C是MgO,F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,F是浓HNO3,E是Mg(NO3)2;
(2)若A是常见的金属的单质,D、F是气态单质,由转化关系可知A为变价金属,应为Fe,反应①在水溶液中进行。反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2。
【解析】(1)根据上述分析可知:A是CO2,B是Mg,C是MgO,D是C单质,E是Mg(NO3)2,F是HNO3。
反应①是Mg在CO2中燃烧反应产生MgO和C,反应方程式为:2Mg+CO22MgO+C;反应④是C与浓硝酸混合加热,发生氧化还原反应,产生CO2、NO2、H2O,反应的方程式为:C+4HNO3(浓)CO2↑+4NO2↑+2H2O;
(2)根据上述分析可知:A是Fe,B是HCl,C是FeCl2,D是H2,E是FeCl3,F是Cl2。
E是FeCl3,其阳离子是Fe3+,检验Fe3+的方法是:取待检物质少许配成溶液,向其中滴加少量KSCN溶液,若溶液变为红色,说明发生反应:Fe3++3SCN-=Fe(SCN)3,产生了红色Fe(SCN)3,据此检验Fe3+,故检验试剂是KSCN。
【点睛】
本题考查无机物的推断。把握物质的性质,根据某物质的特殊性质或现象寻找突破口,然后结合物质的转化关系逐一推断。熟悉常见单质及其化合物的性质是解本题关键。
12.下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由地壳中含量最多的金属元素组成的单质,反应⑦为置换反应,D为红棕色固体,K是一种红棕色气体,C是一种强酸。
请填写下列空白:
(1)已知M为硝酸亚铁,写出下列物质的化学式:A:_______E:_______。
(2)写出反应④的离子方程式:_______。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的_______(填写序号)。
(4)写出检验C溶液中阴离子的方法:_______。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式:_______。
【答案】SO2 Fe(OH)3 3Fe2++4H++=3Fe3++2H2O+NO↑ ②⑧ 取样于试管中,加入盐酸酸化,取清液,再加入氯化钡溶液,若产生白色沉淀,则为硫酸根离子。
【分析】
I是由地壳中含量最多的金属元素组成的单质,则I是Al;K是一种红棕色气体,K是NO2;L和O2反应生成NO2,则L为NO;NO2和H2O反应生成J的溶液,J为HNO3;Al和D反应生成G和H,反应⑦为置换反应,D为红棕色固体,由此推测该反应为铝热反应,则D为Fe2O3,G和HNO3反应NO和Fe(NO3)2溶液,则G为Fe,H为Al2O3;E能转化为Fe2O3,F和NaOH溶液反应生成E,则F为Fe(NO3)3,E为Fe(OH)3;FeS2和O2反应生成Fe2O3和A,A为SO2;SO2和O2反应生成B,B为SO3;SO3和H2O反应生成C的溶液,C是一种强酸,则C为H2SO4。
【解析】(1)由分析可知,A为SO2,E为Fe(OH)3;
(2)反应④是Fe(NO3)2溶液和硫酸反应生成Fe(NO3)3和NO,离子方程式为:3Fe2++4H++=3Fe3++2H2O+NO↑;
(3)反应②是SO2和O2反应生成SO3,既属于化合反应又属于氧化还原反应;反应③是SO3和H2O反应生成H2SO4,属于化合反应,但不属于氧化还原反应;反应⑥是Fe(OH)3转化为Fe2O3,属于分解反应,不属于氧化还原反应;反应⑧是NO和O2反应生成NO2,既属于化合反应又属于氧化还原反应;反应⑨是NO2和H2O反应生成HNO3和NO,属于氧化还原反应,但不属于化合反应;答案选②⑧;
(4)检验硫酸根的方法为:取样于试管中,加入盐酸酸化,取清液,再加入氯化钡溶液,若产生白色沉淀,则为硫酸根离子;
(5)将Fe2O3与KNO3、KOH高温共融可制得K2FeO4、KNO2和H2O,化学方程式为:。
13.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
ABC
(1)若含金属W的合金是目前用量最大的合金。A是有色气体。
①W在周期表中属于___族(填主族、副族)元素。
②向装有C溶液的试管中加入NaOH溶液,观察到的实验现象为___。过程中发生的氧化还原反应的方程式为___。
(2)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1。
①B的化学式为___。
②实验室制取B时,收集方法为___。
③C与水反应时,氧化剂与还原剂物质的量之比为___。
(3)若A为淡黄色固体单质,W为气体单质。
①下列说法正确的是___。
A.A和W的原子价电子数相等
B.A和W对应的元素在自然界既可以以游离态存在,也可以以化合态存在
C.A在过量的W气体中燃烧,可以直接生成C
D.简单氢化物沸点H2A比H2W高
②C溶于水形成化合物D,在加热的条件下,D的浓溶液与A反应的化学方程式为___。
【答案】副 先产生白色沉淀,迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+2H2O+O2=4Fe(OH)3 NO 排水法收集 1:2 AB S+2H2SO4(浓)3SO2↑+2H2O
【解析】(1)若含金属W的合金是目前用量最大的合金,则W为Fe ,A是有色气体,又能与Fe反应,所以A为 Cl2、B为FeCl3、C为FeCl2。
①Fe在周期表中的位置:第四周期第VIII族,属于副族元素,故答案为:副;
②向装有FeCl2溶液的试管中加入NaOH溶液,观察到的实验现象为:先产生白色沉淀,迅速变为灰绿色,最终变为红褐色,过程中发生的氧化还原反应的方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:先产生白色沉淀,迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(2)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为 N2、W为O2、B为NO、C为NO2。
①B的化学式为:NO,故答案为:NO;
②由于NO能与O2反应,实验室制取NO时,不能用向上排空气法收集,NO不溶于水,用排水法收集,故答案为:排水法收集;
③NO2与水反应的化学方程式为:3NO2+H2O=2HNO+NO,NO2既是氧化剂又是还原剂,由还原产物、氧化产物可知,氧化剂与还原剂物质的量之比为1:2,故答案为:1:2;
(3)若A为淡黄色固体单质,W为气体单质,则A为S、W为O2、B为SO2、C为SO3。
①A.S和O均为第VIA族元素,最外层电子数均为6,则原子价电子数相等,故A正确;
B.氧元素在自然界既可以以游离态氧气存在,也可以以化合态存在如氧化铝等,游离态的硫元素存在于火山喷口附近或地壳的岩层里,化合态的硫元素存在于火上喷出物里,故 B正确;
C.S在过量氧气体中燃烧,只能生成二氧化硫,不能直接生成三氧化硫,故C错误;
D.H2S与H2O相比,水分子间存在氢键,水的沸点比硫化氢高,故D错误;
故答案为:AB;
②SO3溶于水形成化合物D为H2SO4,在加热的条件下,浓硫酸与S反应的化学方程式为:S+2H2SO4(浓)3SO2↑+2H2O,故答案为:S+2H2SO4(浓)3SO2↑+2H2O。
14.人们从化石燃料的燃烧过程中获得能量,同时也产生废气及颗粒等污染物,它们在太阳辐射等作用下,经过复杂变化形成次生污染物(如图所示),进而在一定的天气条件下造成酸雨、雾霾、光化学烟雾等污染现象。某班同学分成几个学习小组,以其中的SO2为例,进行了一系列的研究性学习:
(1)在空气、水蒸气的共同作用下,SO2最终会形___________(填化学式)随雨水落下,损伤农作物、加快建筑物腐蚀。
(2)甲组同学设计用生石灰进行燃煤脱硫工艺,如图所示,请写出脱硫生成X的总反应方程式:______________________________________。
(3)乙组同学拟用碱液吸收的方法去除烟气中的SO2,设计了如下两种方案:
方案A
方案B
方案展示后,全班同学讨论后认两种方案各有优势并可以进一步优化:
新方案优点是:___________(填物质名称)实现了循环利用,降低了成本,符合资源再利用的原则。
(4)为测定空气中SO2的含量,丙组同学将空气样品经过管道通入盛有200 mL 0.1 mol·L-1酸性KMnO4溶液的密闭容器中,该反应的离子方程式为________________________
_________________________,若管道中空气流量为a L·min-1,经过b min溶液恰好褪色,假定空气中的SO2可被溶液充分吸收,则该空气样品中的SO2含量为___________g·L-1(用含a、b的代数式表示)。
【答案】(1)H2SO4 (2)2CaO+2SO2+O2=2CaSO4 (3)氢氧化钠 (4)2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】(1)在空气、水蒸气的共同作用下,SO2最终被氧化、吸收会形H2SO4随雨水落下,损伤农作物、加快建筑物腐蚀;(2)用生石灰进行燃煤脱硫生成X,X是CaSO4,总反应方程式:2CaO+2SO2+O2=2CaSO4;(3)对比前后方案可知,新方案氢氧化钠实现了循环利用,降低了成本,符合资源再利用的原则;(4)空气中SO2经过管道通入酸性KMnO4溶液的密闭容器中,发生反应:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;依题意,KMnO4物质的量是0.200 L×0.1 mol·L-1=0.02 mol,溶液恰好褪色,则KMnO4完全反应,根据方程式的系数关系可知,通入的SO2物质的量为0.02 mol×=0.05 mol,则该空气样品中的SO2含量为= g·L-1。
专题08 化学实验题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册): 这是一份专题08 化学实验题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册),文件包含专题08化学实验题突破高一化学下学期期末专项突破鲁科版2019必修第二册解析版docx、专题08化学实验题突破高一化学下学期期末专项突破鲁科版2019必修第二册原卷版docx等2份学案配套教学资源,其中学案共20页, 欢迎下载使用。
专题06 工艺流程和无机推断题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册): 这是一份专题06 工艺流程和无机推断题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册),文件包含专题06工艺流程和无机推断题突破高一化学下学期期末专项突破鲁科版2019必修第二册解析版docx、专题06工艺流程和无机推断题突破高一化学下学期期末专项突破鲁科版2019必修第二册原卷版docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
专题05 有机合成与推断题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册): 这是一份专题05 有机合成与推断题突破——高一化学下学期期末专项突破学案(鲁科版2019必修第二册),文件包含专题05有机合成与推断题突破高一化学下学期期末专项突破鲁科版2019必修第二册解析版docx、专题05有机合成与推断题突破高一化学下学期期末专项突破鲁科版2019必修第二册原卷版docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。