
第3章 烃的衍生物——【期末复习】高二化学单元复习知识点梳理(人教版2019选择性必修3)
展开第3章 烃的衍生物知识清单
【知识网络】
【知识归纳】
考点1 卤代烃
一、卤代烃的结构及物理性质
1.结构特点及分类
2.物理性质
(1)溶解性:卤代烃不溶于水,可溶于大多数有机溶剂,某些卤代烃本身是很好的溶剂
(2)沸点
①同一类卤代烃的沸点随碳原子数的增加而升高;
②同一类卤代烃同分异构体的沸点随烃基中支链的增加而降低;
③同一烃基的不同卤代烃的沸点随卤素原子的相对原子质量的增大而增大。
(3)状态
①常温下,少数卤代烃(如CH3Cl)为气体
②常温下,大多数为液体或固体(如氯仿、四氯化碳等)。
(4)密度:脂肪烃的一氯代物和一氟代物密度小于水,其他的一般大于水。
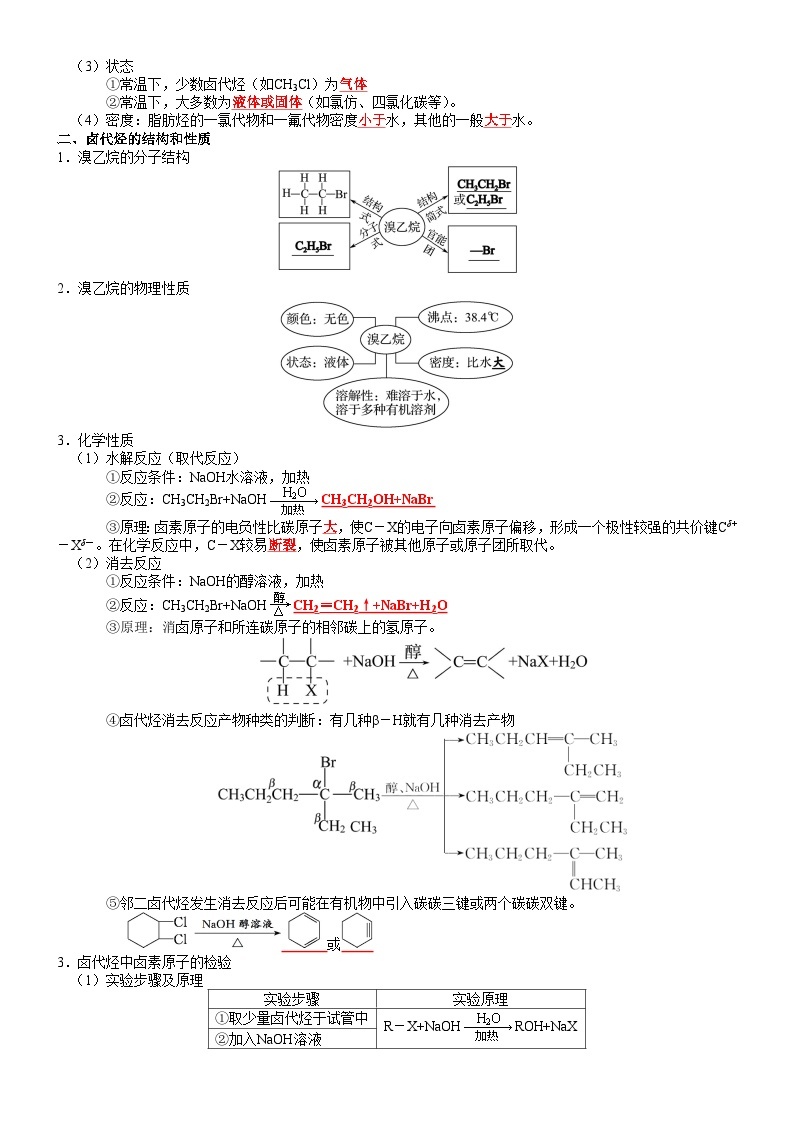
二、卤代烃的结构和性质
1.溴乙烷的分子结构
2.溴乙烷的物理性质
3.化学性质
(1)水解反应(取代反应)
①反应条件:NaOH水溶液,加热
②反应:CH3CH2Br+NaOHCH3CH2OH+NaBr
③原理:卤素原子的电负性比碳原子大,使C-X的电子向卤素原子偏移,形成一个极性较强的共价键Cδ+-Xδ-。在化学反应中,C-X较易断裂,使卤素原子被其他原子或原子团所取代。
(2)消去反应
①反应条件:NaOH的醇溶液,加热
②反应:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
③原理:消卤原子和所连碳原子的相邻碳上的氢原子。
④卤代烃消去反应产物种类的判断:有几种β-H就有几种消去产物
⑤邻二卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。
或
3.卤代烃中卤素原子的检验
(1)实验步骤及原理
实验步骤
实验原理
①取少量卤代烃于试管中
R-X+NaOHROH+NaX
②加入NaOH溶液
③加热
④冷却⑤加入稀硝酸酸化
HNO3+NaOH=NaNO3+H2O
⑥加入AgNO3溶液
AgNO3+NaX=AgX↓+NaNO3
(2)实验流程及结论
(3)卤代烃中卤素原子检验的误区
①卤代烃分子中虽然含有卤素原子,但C-X键在加热时,一般不易断裂。在水溶液中不电离,无X-(卤素离子)存在,所以向卤代烃中直接加入AgNO3溶液,得不到卤化银的沉淀。检验卤代烃的卤素原子,一般是先将其转化成卤素离子,再进行检验。
②所有的卤代烃都能够水解,但不一定都会发生消去反应
③检验的步骤可总结为:水解→中和→检验。
考点2 醇
一、醇的概述
1.概念:烃分子中饱和碳原子上的一个或几个氢原子被羟基取代的产物。
2.饱和一元醇通式:CnH2n+1OH(n≥1)或CnH2n+2O(n≥1)
3.分类
依据
类别
举例
按烃基
的种类
脂肪醇
CH3OH、CH2OHCH2OH
芳香醇
、
按羟基
的数目
一元醇
CH3CH2OH
二元醇
多元醇
按烃基的
饱和程度
饱和醇
CH3CH2CH2OH
不饱和醇
CH2=CH-CH2OH
4.物理性质
(1)沸点
①直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高
②醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃
(2)水溶性
①低级脂肪醇易溶于水
②饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小
5.醇的命名
(1)CH3-CH2--CH3命名为4-甲基-2-戊醇。
(2)命名为2,2-二甲基-1-丙醇。
(3)CH3-CH2-OH的名称为2-甲基-1-丙醇。
(4)的名称为2,3-二甲基-3-戊醇。
二、醇的化学性质
1.氧化反应(以正丙醇为例)
(1)可燃性:2CH3CH2CH2OH+9O26CO2+8H2O
(2)KMnO4(H+)
①反应:CH3CH2CH2OHCH3CH2COOH
②现象:褪色
(3)催化氧化:2CH3CH2CH2OH+O22CH3CH2CHO+2H2O
【规律方法】醇的催化氧化规律
2.消去反应
(1)醇的消去反应条件:浓硫酸/加热
(2)醇的消去原理
①消羟基和β-H形成不饱和键
②若醇无相邻碳原子或无β-H时,则不能发生消去反应。如CH3OH、(CH3)3CCH2OH。
(3)正丙醇的消去反应:CH3CH2CH2OHCH3CH=CH2↑+H2O
(4)邻二醇发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键
CH3---CH3CH2=CH-CH=CH2或CH3-C≡C-CH3
4.取代反应(以正丙醇为例)
(1)与浓氢卤酸(HX)反应:CH3CH2CH2OH+HXCH3CH2CH2X+H2O
(2)成醚反应(分子间脱水):2CH3CH2CH2OHCH3CH2CH2OCH2CH2CH3+H2O
(3)与CH3COOH的酯化反应
①反应:CH3COOH+CH3CH2CH2OHCH3COOCH2CH2CH3+H2O
②断键原理:酸脱羟基醇脱氢
(4)与Na的置换反应:2CH3CH2CH2OH+2Na2CH3CH2CH2ONa+H2↑
三、实验室制乙烯
1.实验原理:CH3CH2OHCH2=CH2↑+H2O
2.实验装置
3.实验步骤
(1)在长颈圆底烧瓶中加入乙醇和浓硫酸(体积比约为1∶3)的混合液,放入几片碎瓷片。
(2)加热混合液,使液体温度迅速升至170 ℃。
(3)将生成的气体分别通入酸性KMnO4溶液和Br2的CCl4溶液中。
4.实验现象
(1)试管中有气泡产生。
(2)KMnO4酸性溶液褪色。
(3)Br2的CCl4溶液褪色。
5.注意事项
(1)配制乙醇和浓H2SO4的混合液时应将浓H2SO4缓慢加入盛有无水乙醇的烧杯中,边加边搅拌冷却。
(2)加热混合液时要迅速升温至170 ℃,从而减少副反应的发生,因为在140 ℃时乙醇分子间脱水生成乙醚。
(3)实验时温度计水银球应位于反应液中,控制温度在170 ℃。
(4)收集乙烯应选用排水集气法,因为乙烯难溶于水,密度比空气略小。
(5)浓硫酸具有脱水性和强氧化性,能将无水酒精碳化、氧化为碳单质、CO、CO2等多种物质,自身被还原成SO2,所以生成的乙烯中可能有CO2、SO2等杂质气体。
四、醇的同分异构体
1.跨类异构:相同碳原子数的饱和一元醇和饱和醚互为同分异构体
2.C5H12O的同分异构体
(1)醇类的同分异构体:羟基取代法
①C5H12OC5H11OHC5H12用羟基取代戊烷分子中的氢原子
②画出戊烷的碳链有3种连接方式
③在碳链各碳原子上连接羟基,用“↓”表示连接的不同位置。
(2)醚类的同分异构体:氧插入法
(3)结论:分子式为C5H12O的有机物共8种醇和6种醚,总共14种同分异构体。
考点3 酚
一、酚的组成、结构、物理性质和用途
1.酚的概念:芳香烃分子中苯环上的氢原子被羟基取代后的有机物。
2.苯酚的分子结构
3.苯酚的物理性质
(1)苯酚俗称石炭酸,是有特殊气味的无色晶体,熔点为43℃。
(2)常温下,苯酚在水中的溶解度不大,温度高于65℃时,能与水互溶。易溶于酒精等有机溶剂。
(3)苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性。若不慎沾到皮肤上应立即用酒精清洗。
4.苯酚的应用和危害
二、苯酚的化学性质
1.苯酚的弱酸性
(1)弱酸性:OHO-+H+
(2)弱酸强弱:H2CO3>OH>HCO3-
①石蕊试液:不变红
②Na2CO3溶液:OH+Na2CO3ONa+NaHCO3
③NaHCO3溶液:不反应
④向ONa溶液中通入CO2,无论CO2过量与否,产物均是NaHCO3。
ONa+H2O+CO2OH +NaHCO3
(3)NaOH溶液
①反应:OH+NaOHONa+H2O
②应用:除试管内壁的苯酚
(4)金属钠:2OH+2NaONa+H2↑
2.苯酚与溴水的取代反应
(1)条件:常温下,与浓溴水反应
(2)现象:产生白色沉淀
(3)反应
(4)原理:卤素原子取代羟基邻、对位的氢
(5)应用:定性检验酚的在、定量测定样品中酚的含量
3.氧化反应
(1)强还原性:常温下苯酚易被空气中的氧气氧化而显粉红色。
(2)可燃性:C6H6O+7O26CO2+3H2O
(3)KMnO4(H+):褪色
4.显色反应
(1)反应:6C6H5OH+Fe3+[Fe(OC6H5)6]3-+6H+
(2)现象:溶液变成紫色
(3)应用:用于苯酚和FeCl3的互相定性检验,也可用于酚类的检验
5.苯酚与甲醛的缩聚反应
(1)反应
(2)应用:可制造酚醛树脂
(3)原理:醛脱氧,酚脱羟基邻、对位的氢
6.加成反应
(1)加成物质:在催化剂作用下和H2加成
(2)加成反应:OH+3H2-OH
三、有机物中“基团”的相互影响
1.苯酚中苯环和酚羟基的相互影响
(1)苯环对侧链(羟基)的影响,导致酚羟基中的氧氢键易断
①弱酸性
②显色反应
(2)侧链(羟基)对苯环的影响使酚羟基邻对位被活化,导致苯环上易发生多取代反应
①卤代,如苯酚与浓溴水反应
②硝化,如苯酚与浓硝酸反应:
+3HNO3+3H2O
2.有机分子内原子或原子团的相互影响
(1)链烃基对其他基团的影响:甲苯的硝化反应产物是三硝基甲苯,而同样的条件下的苯的硝化只能生成一硝基苯。
(2)苯基对其他基团的影响:
①水、醇、苯酚提供氢离子的能力大小:R-OH<H-OH<C6H5-OH
②烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色。
(3)羟基对其他基团的影响:
①羟基对C-H键的影响:使和羟基相连的C-H键更不稳定。
②羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代。
四、酚的同分异构体
1.跨类异构:相同碳原子数的酚、芳香醇和芳香醚互为同分异构体
2.C7H8O的芳香族同分异构体
(1)芳香醇类的同分异构体:CH2OH
(2)芳香醚类的同分异构体:OCH3
(3)酚的同分异构体:苯环上含-OH和-CH3两个取代基,有邻、间、对三种
、、CH3-OH
3.C8H10O的芳香族同分异构体
(1)芳香醇类的同分异构体:CH2CH2OH、-CH3
①只有1个侧链:
②有2个侧链(-CH3和-CH2OH):有邻、间、对三种
、、CH3-CH2OH
(2)芳香醚类的同分异构体
①只有1个侧链:OCH2CH3、CH2OCH3
②有2个侧链(-CH3和-OCH3):有邻、间、对三种
、、CH3-OCH3
(3)酚的同分异构体
①苯环上含-OH和-CH2CH3两个取代基,有邻、间、对3种
、、CH3CH2-OH
②苯环上含-OH和2个-CH3两个取代基,有6种
、、、、、
考点5 醛、酮
一、乙醛、醛类
1.乙醛的组成
(1)官能团:醛基,符号为--H或-CHO
(2)分子“四式”
分子式
结构简式
结构式
电子式
C2H4O
CH3CHO
(3)物理性质
①颜色:无色
②气味:有刺激性气味
③状态:液体
④溶解性:能跟水、乙醇等互溶
2.醛类
(1)概念:由烃基(或氢原子)与醛基构成的化合物。
(2)饱和一元醛的通式为CnH2nO(n≥1)或CnH2n+1CHO(n≥0)
(3)常见的醛
甲醛
苯甲醛
结构简式
HCHO
CHO
俗称
蚁醛
苦杏仁油
颜色
无色
无色
气味
强烈刺激性气味
苦杏仁气味
状态
气体
液体
溶解性
易溶于水
微溶于水,可溶于乙醇、乙醚
3.醛的命名
(1)一是选主链:含醛基的最长碳链为主链
(2)二是定碳位:靠近醛基的一端开始编号,-CHO为第1位。
(3)命名
①CH3-CH2CHO,命名为3-甲基丁醛;
②CH3-CHO,命名为2-甲基丙醛。
二、醛的化学性质
1.醛的加成反应
(1)原理
(2)加成的物质:H2、HX、HCN、NH3、氨的衍生物、醇类等
(3)乙醛的加成反应
2.还原反应:CH3CHO+H2CH3CH2OH
3.氧化反应
4.醛的氧化反应
(1)可燃性:CnH2nO+O2nCO2+nH2O
(2)催化氧化:2CH3CHO+O22CH3COOH
(3)强氧化剂
①能使酸性高锰酸钾溶液褪色
②能使溴水褪色
(4)银镜反应
①现象:产生光亮银镜
②反应:RCHO+2[Ag(NH3)2]OH2Ag↓+RCOONH4+3NH3+H2O
(5)乙醛与新制氢氧化铜悬浊液反应:
①现象:产生砖红色沉淀
②反应:RCHO+2Cu(OH)2+NaOHRCOONa+Cu2O↓+3H2O
三、检验醛基的实验
1.银镜反应实验
(1)配制银氨溶液
①过程:在洁净的试管中加入AgNO3溶液,向AgNO3溶液中滴加稀氨水,边滴边振荡,至最初产生的沉淀恰好完全溶解为止
②反应:AgNO3+NH3·H2OAgOH↓+NH4NO3;AgOH+2NH3·H2O[Ag(NH3)2]OH+2H2O
(2)银镜反应
①反应:CH3CHO+2[Ag(NH3)2]OHCH3COONH4+2Ag↓+3NH3+H2O
②加热方式:水浴加热,不可用酒精灯直接加热
③反应环境:银氨溶液自身显强碱性
④反应液配制:银氨溶液随用随配,不可久置
⑤仪器洗涤:银镜可用稀硝酸浸泡洗涤除去
⑥应用:用于制镜、保温瓶胆、醛基的检验与测定
2.醛与新制的Cu(OH)2悬浊液反应
(1)配制新制的Cu(OH)2悬浊液
①过程:向2 mL NaOH溶液中滴几滴CuSO4溶液(碱要过量)
②反应:CuSO4+2NaOHCu(OH)2↓+Na2SO4
(2)氧化反应
①反应:CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O
②加热方式:反应液必须直接加热煮沸
③反应环境:银氨溶液自身显强碱性
④反应液配制:配制悬浊液时,NaOH必须过量;新制Cu(OH)2悬浊液要随用随配,不可久置
⑤仪器洗涤:Cu2O可用稀硝酸浸泡洗涤除去
⑥应用:用于醛基的检验与测定
四、甲醛的特殊性
1.结构的特殊性
(1)空间结构:甲醛分子中碳原子采用sp2杂化,四个原子共平面
(2)官能团:含有两个醛基
2.氧化反应特殊性
(1)甲醛与银氨溶液反应
H--H+4[Ag(NH3)2]OH(NH4)2CO3+6NH3+4Ag↓+2H2O
(2)甲醛与新制Cu(OH)2悬浊液的反应
H--H+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O
3.常用的定量关系
(1)银镜反应
①普通醛:R-CHO~2[Ag(NH3)2]OH~2Ag
②甲醛:HCHO~4[Ag(NH3)2]OH~4Ag
(2)与新制Cu(OH)2悬浊液的反应
①普通醛:R-CHO~2Cu(OH)2~Cu2O
②甲醛:HCHO~4Cu(OH)2~2Cu2O
五、酮
1.酮的结构
2.丙酮的物理性质:无色有特殊气味的易挥发液体,与水以任意比互溶
3.丙酮的化学性质
(1)氧化反应
①能够燃烧
②不能被银氨溶液、新制Cu(OH)2悬浊液氧化
(2)还原反应:CH3--CH3+H2CH3--CH3
(3)加成反应
六、醛、酮的同分异构体
1.官能团类型异构
(1)相同碳原子数的饱和一元醛、饱和一元酮、脂环醇、烯醇等互为同分异构体
(2)C3H6O的常见同分异构体
醛
酮
环醇
烯醇
CH3CH2CHO
CH3COCH3
CH2=CH-CH2OH
2.醛类碳骨架异构的写法--“取代法”
(1)C4H8O的醛C3H7-CHO(2种,-C3H7有2种)
(2)C5H10O的醛C4H9-CHO(4种,-C4H9有4种)
(3)C6H12O的醛C5H11-CHO(8种,-C5H11有8种)
3.酮类碳骨架异构的写法--“插入法”
(1)将C5H10O去掉一个酮基后还剩余4个碳原子,其碳骨架有以下2种结构:
(2)找出对称结构,将酮基放在合适的位置,一共有如下3个位置可以安放:
考点5 羧酸
一、羧酸的组成和结构
1.羧酸
(1)概念:由烃基(或氢原子)和羧基相连构成的有机化合物。
(2)饱和一元羧酸的通式:CnH2nO2(n≥1)或CnH2n+1COOH(n≥0)
2.羧酸的分类
依据
类别
举例
烃基种类
脂肪酸
乙酸:CH3COOH
芳香酸
苯甲酸:COOH
羧基数目
一元羧酸
甲酸:HCOOH
二元羧酸
乙二酸:HOOC-COOH
多元羧酸
柠檬酸:
烃基是否饱和
饱和羧酸
丙酸:CH3CH2COOH
不饱和羧酸
丙烯酸:CH2CHCOOH
3.物理性质
(1)状态:液态和固态,无水乙酸又称为冰醋酸。
(2)水溶性:C≤4与水互溶(氢键),C>4随碳链增长溶解度迅速减小。
(3)熔沸点:羧基数目相同时,碳原子数越多,沸点越高;羧酸的沸点比相应醇的沸点高。
4.几种常见的羧酸
甲酸
苯甲酸
乙二酸
俗名
蚁酸
安息香酸
草酸
结构简式
HCOOH
COOH
色、态、味
无色有腐蚀性液体、刺激性气味
无色晶体、易升华
无色透明晶体
溶解性
易溶于水、有机溶剂
微溶于水、易溶于乙醇
能溶于水、乙醇
用途
工业还原剂、合成医药、农药和染料等的原料
食品防腐剂,合成香料、药物
化学分析还原剂,化工原料
5.羧酸的命名
(1)CH3CH2CH2COOH的名称是3-甲基戊酸
(2)CH3COOH的名称是2,3-二甲基丁酸
(3)名称为4-甲基-3-乙基戊酸。
二、羧酸的化学性质
1.从结构角度认识羧酸的性质
由于受氧原子电负性较大等因素的影响,当乙酸发生化学反应时,羧基结构中的两个部位容易断裂:
(1)O-H键断裂时,解离出H+,使羧酸表现出酸性;
(2)C-O键断裂时,-OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
2.弱酸性
(1)一元弱酸,具有酸的通性
①与指示剂反应:使石蕊试剂变红色
②与氢前面的金属反应,如乙酸与Na的反应:2CH3COOH+2Na→2CH3COONa+H2↑
③与盐溶液反应,如乙酸与Na2CO3反应:2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑
④与碱反应,如乙酸与NH3·H2O的反应:CH3COOH+NH3·H2O→CH3COONH4+H2O
⑤与金属氧化物反应,如乙酸与CaO的反应:2CH3COOH+CaO→(CH3COO)2Ca+H2O
(2)甲酸、苯甲酸、乙二酸的酸性比较
甲酸
苯甲酸
乙二酸
实验操作
①取0.01mol·L-1上述酸溶液,滴入紫色石蕊试液
②取0.01mol·L-1上述酸溶液,测pH
现象
①紫色石蕊试液变红色②pH大于2
结论
甲酸、苯甲酸和乙二酸具有弱酸性
(3)乙酸、碳酸、苯酚的酸性比较
实验装置
实验现象
A中:有气泡产生。C中:溶液变浑浊
实验结论
结合现象,根据强酸制弱酸的规律可知:酸性:乙酸>碳酸>苯酚
3.氧化反应
(1)可燃性:CnH2nO2+O2nCO2+nH2O
(2)KMnO4(H+):不褪色
3.酯化反应
(1)乙酸和乙醇的反应:CH3COOH+CH3CH2OHCH3COOC2H5+H2O
(2)酯化反应机理
①同位素示踪法:CH3COOH+H18OCH2CH3CH3CO18OCH2CH3+H2O
②实质:酸脱羟基,醇脱氢。
三、酯化反应的特点及类型
1.酯化反应的特点
(1)所有的酯化反应,条件均为浓硫酸、加热。酯化反应为可逆反应,书写方程式时用“”。
(2)利用自身酯化或相互酯化生成环酯的结构特点以确定有机物中羟基位置。
(3)在形成环酯时,酯基(--O-)中只有一个O参与成环。
(4)酸与醇发生反应时,产物不一定生成酯。若是羧酸或者无机含氧酸与醇反应,产物是酯;若是无氧酸如氢卤酸与醇反应则生成卤代烃。
2.酯化反应的类型
(1)一元羧酸和一元醇的酯化反应
R-COOH+R'-CH2OHR--O-CH2R'+H2O
(2)一元羧酸与二元醇的酯化反应
(3)二元酸与二元醇的酯化反应
①反应生成普通酯
+HOOC-COOCH2-CH2OH+H2O
②反应生成环酯
++2H2O
③反应生成聚酯
n+n+2nH2O
(4)无机含氧酸的酯化反应
+3HO-NO2+3H2O
(5)高级脂肪酸与甘油的酯化反应
+3C17H35COOH+3H2O
四、含羟基物质性质的比较
比较项目
含羟基的物质
醇
水
酚
羧酸
羟基上氢原子活泼性
在水溶液中电离程度
极难电离
难电离
微弱电离
部分电离
酸、碱性
中性
中性
很弱的酸性
弱酸性
与Na反应
反应放出H2
反应放出H2
反应放出H2
反应放出H2
与NaOH反应
不反应
不反应
反应
反应
与Na2CO3反应
不反应
不反应
反应
反应
与NaHCO3反应
不反应
不反应
不反应
反应放出CO2
能否由酯水解生成
能
不能
能
能
结论
羟基的活泼性:羧酸>酚>水>醇
【特别警示】羟基与酸性强弱的关系
(1)醇、酚、羧酸的结构中均有-OH,可分别称之为“醇羟基”“酚羟基”和“羧羟基”。由于这些-OH相连的基团不同,-OH受相连基团的影响就不同。故羟基上的氢原子活性也就不同,表现在性质上也相差较大,一般来说,羟基上的氢原子活性“羧羟基”>“酚羟基”>“醇羟基”。
(2)羧酸都是弱酸,不同的羧酸酸性不同,但低级羧酸都比碳酸的酸性强。几种简单的羧酸的酸性关系为甲酸>苯甲酸>乙酸>丙酸。乙酸与H2SO3、H2CO3、HF等几种弱酸的酸性关系为H2SO3>HF>CH3COOH>H2CO3。
(3)低级羧酸才会使紫色石蕊试液变红,醇、酚、高级脂肪酸不会使紫色石蕊试液变红。
考点6 羧酸衍生物
一、酯
1.羧酸衍生物:羧酸分子中羧基上的羟基被其他原子或原子团取代后的产物。
(1)酰基:羧酸分子中的羧基去掉羟基后剩余的基团,结构简式为--R
(2)常见的羧酸衍生物
羧酸衍生物
酰卤
酸酐
酯
酰胺
结构简式
R--Cl
R--O--R′
R--Cl
R--NH2
2.酯
(1)概念:酰基(R--)和烃氧基(RO-)相连后的产物。
(2)官能团的名称:酯基,结构简式:--O-R。
(4)饱和一元酯的通式:CnH2nO2(n≥2)
(5)命名:依据水解生成的酸和醇的名称命名,称为“某酸某酯”。
酯
HCOOC2H5
名称
甲酸乙酯
二乙酸乙二酯
乙二酸二乙酯
乙二酸乙二酯
(6)物理性质
①密度:酯类密度一般比水小
②溶解性:难溶于水,易溶于乙醇、乙醚等有机溶剂。
③味态:低级酯是有香味的液体,易挥发。
(7)化学性质--水解反应
①酸性条件:RCOOR'+H2ORCOOH+R'OH(部分进行)
②碱性条件:RCOOR'+NaOHRCOONa+R'OH(完全进行)
二、油脂
1.油脂的组成和结构
(1)组成:油脂是由高级脂肪酸与甘油形成的酯,属于酯类物质
(2)结构
①单甘油酯:R=R'=R''
②混甘油酯:R、R'、R''不完全相同
③天然油脂都是多种混甘油酯的混合物。
2.分类
3.物理性质
4.化学性质
(1)水解反应
①酸性水解:制备甘油和高级脂肪酸
②碱性水解(皂化反应):制备甘油和肥皂
(2)加成反应--不饱和油脂的特性
①溴水:液态油能够使溴水褪色(鉴别植物油和动物油)。
②氢化反应:液态油与氢气的加成反应,又叫油脂的硬化。这样制得的油脂叫人造脂肪,又叫硬化油。
+3H2。
5.油脂和矿物油的比较
物质
油脂
矿物油
油
脂肪
组成
不饱和高级脂肪酸的甘油酯
饱和高级脂肪酸的甘油酯
多种烷烃、环烷烃、芳香烃
状态
液态
固态
液态
化学性质
能水解,兼有烯烃的性质
能水解
具有烃的性质,不能水解
存在
花生、大豆、芝麻等油料作物中
动物脂肪
石油
联系
油和脂肪统称油脂,均属于酯类
烃类
三、胺和酰胺
1.胺
(1)结构和用途
(2)化学性质:碱性
①原因:氮原子上有孤对电子,能够与H+以配位键结合
②反应:NH2+HClNH3Cl
2.酰胺
(1)概念:酰胺是羧酸分子中羟基被氨基(或取代的氨基)所替代得到的化合物
(2)结构
(3)常见的酰胺
名称
乙酰胺
苯甲酰胺
N,N-二甲基甲酰胺
结构简式
CH3--NH2
-NH2
H--N(CH3)2
(4)水解反应:CH3CONH2+H2OCH3COOH+NH4+
①强酸性条件:RCONH2+H2O+HClRCOOH+NH4Cl
②强碱性条件:RCONH2+NaOHRCOONa+NH3↑
四、酯的同分异构体的判断
1.烃基组合法
(1)R--OR',R从H原子开始,R'到-CH3结束
(2)C5H10O2的酯类同分异构体
①甲酸酯类:H--OC4H9,酯种类:H原子种类(1)×丁基种类(4)=4种
②乙酸酯类:CH3--OC3H7,酯种类:甲基种类(1)×丙基种类(2)=2种
③丙酸酯类:C2H5--OC2H5,酯种类:乙基种类(1)×乙基种类(1)=1种
④丁酸酯类:C3H7--OCH3,酯种类:丙基种类(2)×甲基种类(1)=2种
2.酯基插入法
(1)酯基插入方式:--O-和-O--
(2)分子式为C9H12O2的芳香酯的同分异构体是在CH2CH3中插入酯基
(3)插入的酯基分别在中的①②③④位置
①插入①得到O--CH2CH3和-O-CH2CH3。
②插入②得到CH2-O--CH3和CH2--O-CH3。
③插入③时得到O--H和-O-H(是羧酸,舍去)。
④插入④时得到CH2CH2-O--H和CH2CH2--O-H(是羧酸,舍去)。
考点7 有机合成
一、碳骨架的构建
1.碳链的增长
(1)卤代烃的取代反应
①溴乙烷与氰化钠在酸性条件下的反应:
CH3CH2Br+NaCN→CH3CH2CN+NaBr,CH3CH2CNCH3CH2COOH。
②溴乙烷与丙炔钠的反应
CH3CH2Br+NaC≡CCH3→CH3CH2C≡CCH3+NaBr
(2)醛酮的加成反应
①丙酮与HCN的反应
②乙醛与HCN的反应
CH3CHO+HCNCH3CH(OH)CN
③羟醛缩合(以乙醛为例)
CH3CHO+CH3CHOCH3CH(OH)CH2CHO
④醛、酮与RMgX加成:
+RMgX。
2.碳链的缩短
(1)与酸性KMnO4溶液的氧化反应
①烯烃、炔烃的氧化反应
CH3-CHCH3CH3COOH+ CH3--CH3
②苯的同系物的氧化反应
CH2CH3COOH
(2)脱羧反应
①无水醋酸钠与氢氧化钠的反应:CH3COONa+NaOHCH4↑+Na2CO3
②2-甲基丙酸钠与氢氧化钠的反应:CH3-COONa+NaOHCH3CH2CH3↑+Na2CO3
(3)某些有机物的水解反应
①蛋白质的水解反应
②糖类的水解反应
③酯的水解反应
(4)水解的裂化或裂解
①异丁烷裂化:CH3-CH3CH4+CH3CH=CH2
②十八烷裂化:C18H38C8H18(辛烷)+ C8H16(辛烯)
二、官能团的引入和消除
1.官能团的引入
(1)碳碳双键的引入
①醇的消去:CH3CH2OHCH2=CH2↑+H2O
②卤代烃的消去:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
③邻二卤代烃的消去:+ZnCH2=CH2↑+ZnCl2
④炔烃与H2的加成:CH≡CH+H2CH2=CH2
(2)卤素原子的引入
①与HX的加成:CH2=CH2+HBrCH3CH2Br、CH≡CH+HBrCH2=CHBr
②与X2的加成:CH2=CH2+X2、CH≡CH+X2
③烷烃、芳香烃的取代反应:CH4+Cl2CH3Cl+HCl、+Br2Br +HBr
④烯烃、羧酸的α-H取代
CH3-CH=CH2+Cl22-CH=CH2+HCl
RCH2COOH+Cl2R--COOH +HCl
⑤醇与卤代烃的取代:CH3CH2OH+HBrCH3CH2Br+H2O
(3)羟基的引入方式
①烯烃与水加成:CH2=CH2+H2OCH3CH2OH
②醛、酮与H2加成:CH3CHO+H2CH3CH2OH
③醛、酮与HCN加成:CH3--H +HCNCH3--CN
④羟醛缩合:CH3--H +H-CH2CHOCH3--CH2-CHO
⑤卤代烃的水解:CH3--CH3+NaOHCH3--CH3+NaBr
⑥酯的水解:CH3--O-C2H5+H2OCH3COOH+C2H5OH
⑦酚钠与酸反应:ONa+H2O+CO2OH +NaHCO3
(4)羧基的引入方式
①烯的氧化:RCH2CH=CH2RCH2COOH+CO2↑
②腈的水解:CH3CH2CNCH3CH2COOH
③醛的氧化:2RCHO+O22RCOOH
(5)羰基的引入方式
①烯的氧化:CH2CH3CO2↑+CH3--CH3
②叔醇的催化氧化:2R--R′+O22R--R′+2H2O
3.官能团的消除
(1)通过加成反应消除或-C≡C-
①CH2=CH2+H2CH3CH3
②CH3-C≡C-CH3+2H2CH3CH2CH2CH3
(2)通过消去反应或氧化反应或酯化反应消除-OH
①CH3CH2OHCH2=CH2↑+H2O
②2CH3CH2OH+O22CH3CHO+2H2O
③CH3CH2OH+CH3COOHCH3COOC2H5+H2O。
(3)通过氧化反应或加成反应可消除-CHO
①2CH3CHO+O22CH3COOH
②CH3CHO+H2CH3CH2OH
(4)通过消去反应或水解反应可消除卤素原子
①CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
②CH3CH2Br+NaOHCH3CH2OH+NaBr
(5)通过水解反应消除酯基
①CH3COOC2H5+H2OCH3COOH+C2H5OH
②CH3COOCH2CH3+NaOHCH3CH2OH+CH3COONa
4.成环与开环的反应
(1)成环
①羟基酸分子内酯化
(内酯)+H2O
②二元酸和二元醇分子间酯化成环
+(环酯)+2H2O
③双烯合成反应
+
(2)开环
①环酯的水解反应
+2H2O+
②某些环状烯烃的氧化反应
HOOC(CH2)4COOH
CH3--(CH2)4COOH
三、官能团的转化和保护
1.典型的官能团的转化关系
1.官能团的保护
有机合成时,往往在有机物分子中引入多个官能团,但有时在引入某一个官能团时容易对其他官能团造成破坏,导致不能实现目标化合物的合成。因此,在制备过程中要把分子中的某些官能团通过恰当的方法保护起来,在适当的时候再将其转变回来,从而达到有机合成的目的。
(1)醇羟基的保护
R-OHR-O-R′R″-O-R′R″-OH
(2)酚羟基的保护
因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把-OH变为-ONa将其保护起来,待氧化后再酸化将其转变为-OH。
(3)碳碳双键的保护
碳碳双键也容易被氧化,在氧化其他基团前可以利用其与卤素单质、卤化氢等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
例如,已知烯烃中在某些强氧化剂的作用下易发生断裂,因而在有机合成中有时需要对其进行保护,过程可简单表示如下:
①+Br2 +Zn+ZnBr2
②CH2=CHRCH2Cl-CH2RCH2Cl-CH2R′CH2=CHR′
(4)氨基(-NH2)的保护
例如,在对硝基甲苯合成对氨基苯甲酸的过程中应先把-CH3氧化成-COOH,再把-NO2还原为-NH2。防止当KMnO4氧化-CH3时,-NH2(具有还原性)也被氧化。
(5)醛基的保护
①醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,对其保护和恢复过程为:
Ⅰ.Ⅱ.R-CHO
再如检验碳碳双键时,当有机物中含有醛基、碳碳双键等多种官能团时,可以先用弱氧化剂,如银氨溶液、新制Cu(OH)2悬浊液等氧化醛基,再用溴水、酸性KMnO4溶液等对碳碳双键进行检验。
②醛与醇反应生成缩醛:
+H2O
生成的缩醛比较稳定,与稀碱和氧化剂均难反应,但在稀酸中微热,缩醛会水解为原来的醛。
考点8 有机合成路线的设计及应用
一、有机合成路线的设计与实施
1.有机合成路线确定的要素
(1)基础:在掌握碳骨架构建和官能团转化基本方法的基础上。
(2)设计与操作:进行合理的设计与选择,确定合成路线,以较低的成本和较高的产率,通过简便而对环境友好的操作得到目标产物。
2.有机合成的过程
3.有机合成路线设计应遵循的四个原则
(1)符合绿色化学思想。
①有机合成中的原子经济性;
②原料的绿色化;
③试剂与催化剂的无公害性。
(2)原料价廉,原理正确。
(3)路线简捷,便于操作,条件适宜,安全可靠。
(4)易于分离,产率高。
4.有机合成的发展
(1)有机合成的技术和效率不断提高的影响因素
①新的有机反应;
②新试剂的不断发现;
③有机合成理论的发展
(2)发展过程
时间
发展过程
20世纪初
维尔施泰特通过十余步反应合成颠茄酮,总产率仅有0.75%
十几年后,罗宾逊改进了合成思路,仅用3步反应便完成合成,总产率达90%
20世纪中后期
伍德沃德与多位化学家合作,成功合成了一系列结构复杂的天然产物,促进了有机合成技术和有机反应理论的发展
科里提出了系统化的逆合成概念,开始利用计算机来辅助设计合成路线,让合成路线的设计逐步成为有严密思维逻辑的科学过程,使有机合成进入了新的发展阶段。
(3)有机合成发展的作用
①使人们能通过人工手段合成原本只能从生物体内分离、提取的天然产物。
②使人们可以根据实际需要设计合成具有特定结构和性能的新物质。
③为化学、生物、医学、材料等领域的研究和相关工业生产提供了坚定的物质基础。
④有力地促进了人类健康水平提高和社会发展进步。
二、有机合成的分析方法
1.正合成法
此法是采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间产物,逐步推向待合成有机物,其思维程序是原料中间产物产品。
2.逆合成法
此法是采用逆向思维方法,从产品的组成、结构、性质入手,找出合成所需要的直接或间接的中间产物,逐步推向已知原料,其思维程序是产品中间产物原料。
3.综合比较法
此法是采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳的合成路线。其思维程序是原料中间产物目标产物。
二、常见的有机合成路线
1.烃、卤代烃、烃的含氧衍生物之间的转化关系
烃R-H卤代烃R-X醇类R-OH醛类R-CHO羧酸R-COOH酯类RCOOR′
2.一元合成路线
R-CH=CH2卤代烃一元醇一元醛一元羧酸酯
3.二元合成路线
CH2=CH2CH2X-CH2X二元醇二元醛二元羧酸链酯、环酯、聚酯
4.芳香族化合物合成路线
(1)
(2)
第2章 官能团与有机化学反应 烃的衍生物——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3): 这是一份第2章 官能团与有机化学反应 烃的衍生物——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修3),共21页。
第3章 溶液中的离子平衡——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修1): 这是一份第3章 溶液中的离子平衡——【期末复习】高二化学单元复习知识点梳理(鲁科版2019选择性必修1),共26页。试卷主要包含了强电解质和弱电解质,电离方程式,溶液pH的计算,沉淀溶解平衡的应用,沉淀溶解平衡的实际应用,沉淀溶解平衡的计算等内容,欢迎下载使用。
第5章 合成高分子——【期末复习】高二化学单元复习知识点梳理(人教版2019选择性必修3): 这是一份第5章 合成高分子——【期末复习】高二化学单元复习知识点梳理(人教版2019选择性必修3),共8页。