

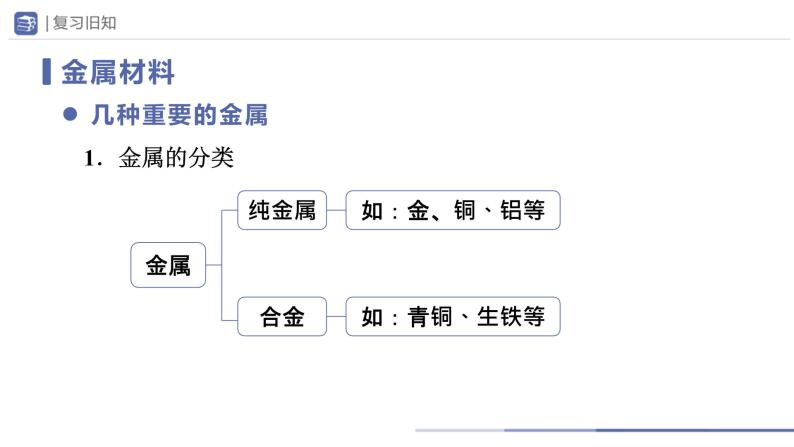


人教版九年级下册课题 1 金属材料试讲课课件ppt
展开某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,与金属线相连的警报系统就会立刻报警。“防盗玻璃”能报警,这利用了金属的什么性质?
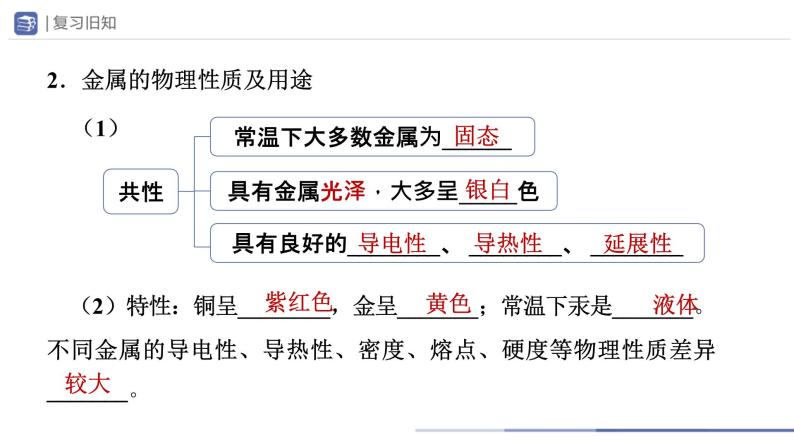
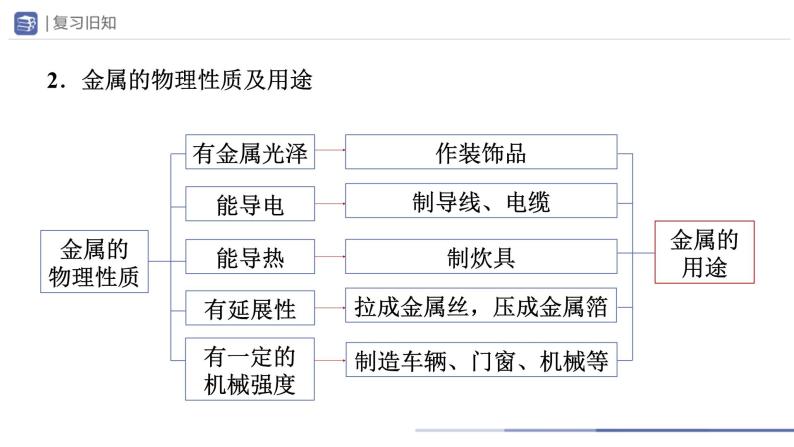
2.金属的物理性质及用途
(2)特性:铜呈________,金呈_______;常温下汞是_______。不同金属的导电性、导热性、密度、熔点、硬度等物理性质差异_______。
常温下大多数金属为______
具有良好的________、 ________、 ________
拉成金属丝,压成金属箔
制造车辆、门窗、机械等
3.决定和影响金属用途的有关因素
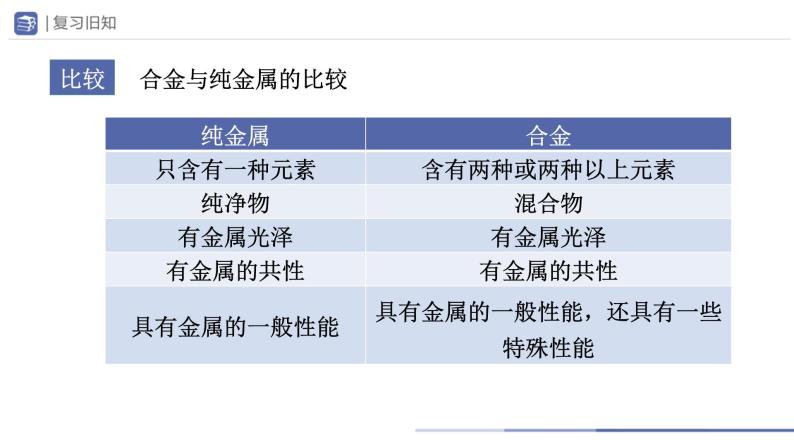
1.概念:在某种金属中加热熔合其他金属或非金属而形成的、具有______特征的物质。
2.性能:与其组分金属相比,合金的硬度和强度_______、抗腐蚀性_______、熔点______。 3.生铁是铁含量为__________的铁合金,钢是含碳量为___________的铁合金。
4.常见的合金有:不锈钢、黄铜、青铜、焊锡、18K黄金。
结论:多数金属能与氧气发生反应,但反应的难易程度和剧烈程度不同。
金属与盐酸、稀硫酸的反应
镁与盐酸 锌与盐酸 铁与盐酸 铜在盐酸中
反应剧烈,有大量气泡产生,溶液仍为无色,生成的气体能够燃烧并产生淡蓝色火焰
反应较剧烈,有较多气泡产生,溶液仍为无色,生成的气体能够燃烧并产生淡蓝色火焰
反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成的气体能够燃烧并产生淡蓝色火焰
四种金属的活动性顺序:镁>锌>铁>铜。
金属与金属化合物溶液的反应
1.通式:金属+可溶性金属化合物→_____________________。 2.反应发生的条件 (1)必须是前面的置换后面的(K、Ca、Na除外)。 (2)反应中金属化合物必须______。
3.常见金属与金属化合物溶液的反应
(1)铝与硫酸铜溶液反应 实验现象: 化学方程式:
铝表面有红色固体生成,溶液由蓝色变成无色。
(2)铜与硝酸银溶液反应 实验现象: 化学方程式:
铜表面有银白色物质生成,溶液由无色变成蓝色。
(3)铁与硫酸铜溶液反应 实验现象: 化学方程式:
铁表面析出红色物质,溶液由蓝色变为浅绿色。
1.概念:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
2.特征:反应物和生成物必须是一种单质和一种化合物。
3.通式:单质+化合物→新单质+新化合物。
4.常见类型: (1)金属置换非金属;(2)金属置换金属; (3)非金属置换金属;(4)非金属置换非金属。
化合反应、分解反应和置换反应的比较
A+BC → B+AC
1.金属活动性顺序
金属活动性由强逐渐减弱
(1)可判断金属的化学活动性
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2 .金属活动性顺序的应用
(2)可判断金属能否与酸发生置换反应而产生氢气
在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
(3)可判断金属能否与金属化合物溶液发生置换反应
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
(1)K、Ca、Na三种相当活泼的金属放入金属化合物的溶液中会与溶液中的水反应,而不能把其他金属从其化合物的溶液中置换出来。 (2)单质铁与酸等物质发生置换反应生成的含铁的化合物中铁显+2价。
1.金属在自然界的存在形式 (1)金属资源广泛地存在于地壳和海洋中。 (2)除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。 2.常见的金属矿石 赤铁矿[主要成分:_________________]、磁铁矿[主要成分:_____________________]、菱铁矿、铝土矿、黄铜矿及辉铜矿等。
氧化铁(或Fe2O3)
四氧化三铁(或Fe3O4)
(1)硬质玻璃管中:玻璃管内的粉末由红棕色逐渐变黑。 (2)试管中:试管内澄清石灰水变浑浊,反应的化学方程式为 。 (3)装置最末端玻璃管尖嘴处:气体燃烧,有淡蓝色火焰,反应的化学方程式为 。
(1)实验开始时,先通入一氧化碳,再点燃酒精喷灯,目的是防止一氧化碳和空气的混合气体受热发生爆炸。 (2)实验结束后,熄灭酒精喷灯,为防止生成的铁又被空气中的氧气氧化,应通入一氧化碳直至玻璃管冷却。 (3)实验要进行尾气处理的原因是除去未反应完的一氧化碳气体,防止污染空气。
含杂质物质的有关化学方程式的计算
(2)纯物质的质量=样品的质量×纯物质的质量分数
(1)化学方程式所表达的都是纯净物之间发生的反应,所体现的各物质的质量比都是纯物质之间的质量关系。
(2)含有杂质的物质在进行计算时,必须将其质量换算成纯物质的质量,再代入方程式进行计算。
1.金属的腐蚀和防护
铁与空气中的氧气、水等物质发生化学反应生成铁锈。
(1)铁锈蚀的条件:铁制品锈蚀的过程,实际上是铁与空气中的水蒸气、氧气等发生化学反应生成铁锈,其主要成分为Fe2O3·xH2O。
(2)铁制品锈蚀条件的探究
实验 1 实验 2 实验 3
棉花及氯化钙(干燥剂)
实验1中的铁钉生锈,水面处锈蚀严重。 实验2中的铁钉没有生锈。 实验3中的铁钉没有生锈。
实验1中的铁钉同时与水、空气接触,易生锈。 实验2中的铁钉只与水接触而不与氧气接触,不易生锈。 实验3中的铁钉只与氧气接触而不与水接触,不易生锈。
①实验用的铁钉必须干净无锈。 ②实验中的蒸馏水必须要煮沸后迅速冷却,其目的是除去溶解在水中的氧气,保证铁钉只与水接触。
铁生锈的条件是铁与空气中的氧气、水同时接触。
(2)改变内部条件:加入其他金属改变其组成,如调整铁的含碳量,按一定比例熔合铬、镍等制成不锈钢(合金)。
铝具有良好的抗腐蚀性能的原因:铝在空气中与_______反应,在其表面生成一层致密的_____________,从而阻止铝进一步被氧化。
(1)破坏外部条件:加保护膜,如刷油漆、涂油、电镀等;保持铁制品表面洁净干燥,如用过的菜刀、铁锅擦干净等。
①减少重金属对环境的污染。
(1)保护金属资源的原因
由于金属资源有限,且不可再生,随着人类的不断开发,金属资源不断减少,因此必须保护金属资源。
(2)废旧金属回收的意义
②节约资源和保护环境。
(1)防止金属的腐蚀。
(2)金属的回收利用。
(3)有计划、合理地开采矿物,严禁不顾国家利益随意采矿。
(4)寻找金属的代替品。
4.保护金属资源的途径有:
人教版九年级下册课题 1 金属材料完整版课件ppt: 这是一份人教版九年级下册课题 1 金属材料完整版课件ppt,共39页。PPT课件主要包含了导入新课,学习目标,讲授新知,金属材料的种类,金属材料的发展史,几种重要的金属,行成于思,金属的物理性质,金属之最,银的成本比铜高等内容,欢迎下载使用。
初中化学人教版九年级下册课题 1 金属材料复习课件ppt: 这是一份初中化学人教版九年级下册课题 1 金属材料复习课件ppt,共21页。PPT课件主要包含了FeAl,纯金属,AlCu,金属的物理性质,性质决定用途,是否美观,废料是否易于回收,物质的用途,物质的性质,对环境的影响等内容,欢迎下载使用。
人教版九年级化学下册---第八单元 金属和金属材料 单元复习(课件): 这是一份人教版九年级化学下册---第八单元 金属和金属材料 单元复习(课件),共48页。PPT课件主要包含了知识框架,考点讲练,难点突破,趁热打铁,考点一金属材料,金属材料的利用史,金属材料的种类,纯金属,金属之最,3金属的用途等内容,欢迎下载使用。













