






苏教版 (2019)选择性必修1第二单元 化学能与电能的转化精品课件ppt
展开1.宏观辨识与微观探析:从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。
2.证据推理与模型认知:建立对电解过程系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书写电解的电极反应式和总反应式。
二、酸、碱、盐溶液的电解规律
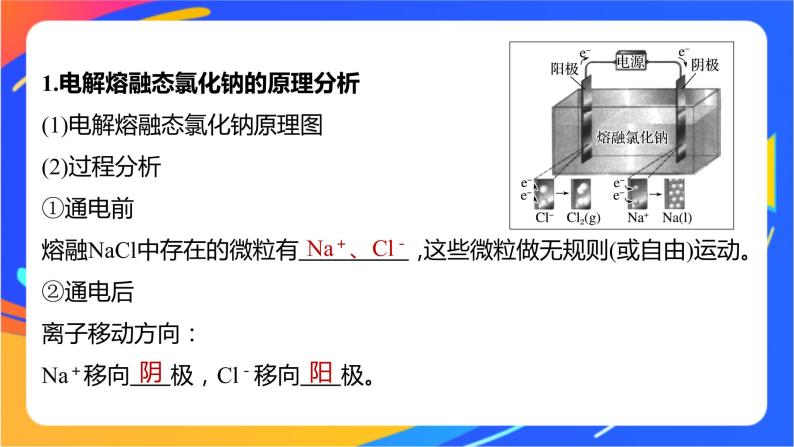
1.电解熔融态氯化钠的原理分析(1)电解熔融态氯化钠原理图(2)过程分析①通电前熔融NaCl中存在的微粒有 ,这些微粒做无规则(或自由)运动。②通电后离子移动方向:Na+移向 极,Cl-移向 极。
电极上发生的反应:阴极: ,发生 反应;阳极: ,发生 反应。(3)分析结论熔融的NaCl在 作用下发生了 ,分解生成了 。总反应方程式: 。
2Na++2e-===2Na
2Cl--2e-===Cl2↑
2.电解和电解池(1)电解:在直流电的作用下,在两电极上分别发生 和_____ 的过程。(2)电解池:将 转化为 的装置。(3)电解池的电极名称阴极:与电源 相连的电极,发生 反应;阳极:与电源 相连的电极,发生 反应。
(4)电解池的构成条件①具有直流电源;②两个电极(阴极、阳极);③电解质溶液或熔融电解质;④形成闭合回路。(5)电子和离子移动方向①电子:从电源 流向电解池的 ,从电解池的 流向电源的 。②离子:阳离子移向电解池的 ,阴离子移向电解池的 。
3.电解氯化铜溶液实验探究(1)按如图所示装置完成实验,并填写下表。
说明电解质溶液导电,形成闭合回路
Cu2++2e-===Cu
(2)实验原理分析①氯化铜溶液中存在的离子有 ,通电前这些离子在溶液中做自由运动。②通电时在电场的作用下,溶液中的离子做 ,即_________趋向a极, 趋向b极。③a极(阳极)Cl-的 性大于OH-,因而Cl-被 为Cl2,b极(阴极)Cu2+的 性大于H+,因而Cu2+被 为Cu。
Cu2+、Cl-、H+、OH-
(1)电解池的两个电极必须是活泼性不同的电极( )(2)电解池是把化学能转化为电能的装置( )(3)电解质溶液导电的过程为物理过程( )(4)电解池的阴极是指和直流电源负极相连的电极( )(5)电解池在工作时,阴极上发生还原反应( )(6)某些不能自发的氧化还原反应,可以通过电解来实现( )
如图所示装置进行实验,回答下列问题:
(1)判断装置名称:A池为________、B池为_______,判断依据是__________________________________________________________________________________________________________________。
能发生自发的氧化还原反应,判断电解池的依据为存在外加电源,两电极上不能发生自发的氧化还原反应
(2)Zn为____极,Cu电极的电极反应式为__________________。
(3)B池中,Cu2+移向____(填“C1”或“C2”)极,发生_________(填“氧化反应”或“还原反应”),C1电极上发生的电极反应式为____________________。
-2e-===Cl2↑
(4)电子在线路中是怎么转移的?怎么根据电子流向和离子流向判断电解池的阴阳极?
提示 电子在线路中转移的方向:原电池负极 电解池阴极,电解池 阳极原电池正极;电解池中:阳离子―→阴极,阴离子―→阳极。即电解池的阳极是电子流出、阴离子移向的电极;电解池的阴极是电子流入、阳离子移向的电极。
电解池阴极和阳极的判断依据
1.如图所示装置中属于电解池的是________(填序号)。
根据电解池的构成条件逐个判断。①②⑤无外接直流电源,不能构成电解池;④无电解质溶液或熔融电解质;⑦中蔗糖属于非电解质,不能构成电解池;⑧没有形成闭合回路,不能构成电解池。
2.如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:(1)a电极为_____,b电极为______。(2)c电极为_____,电极反应式为_________________,发生了_____反应。
d电极为_____,电极反应式为_________________,发生了______反应。
2H++2e-===H2↑
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电解反应方程式:_______________________。
酸、碱、盐溶液的电解规律
1.电极反应规律(1)阴极:无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子放电顺序:Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。放电顺序:活泼金属阳极>S2->I->Br->Cl->OH->含氧酸根离子。
2.酸、碱、盐溶液电解规律(惰性电极)用惰性电极电解下列酸、碱、盐溶液,请填写下表:(1)电解水型
(3)电解质和水都发生电解型
(1)用石墨作阳极、铁作阴极分别电解稀硫酸和硫酸钠溶液时,它们阴极和阳极的产物都相同( )(2)用石墨作电极电解氯化钠和硫酸铜的混合液,最初一段时间阴极和阳极生成的物质分别是铜和氯气( )(3)用石墨作电极电解熔融氯化钠,阴极的电极反应式为Na++e-===Na( )(4)用石墨作阴极、铜作阳极电解硫酸铜溶液,阳极的电极反应式为4OH--4e-===O2↑+2H2O( )
(5)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O 4Ag+4H++O2↑( )(6)铜作阳极电解盐酸的化学方程式为Cu+2HCl CuCl2+H2↑( )
1.用惰性电极电解盐酸与稀硫酸一段时间后,溶液中的pH变化为何不同?
提示 电解盐酸时,H+、Cl-放电,溶质HCl减少,pH增大;而电解稀硫酸时,H+、OH-放电,相当于电解稀硫酸中的水,硫酸浓度变大,pH减小。
2.有下列两组离子:①Cu2+、Na+、H+、Ag+;②Cl-、I-、 、OH-。(1)电解时,哪一组离子移向阳极?放电的先后顺序是什么?
提示 ②;放电的先后顺序是I->Cl->OH->
(2)电解时,哪一组离子移向阴极?放电的先后顺序是什么?
提示 ①;放电先后顺序是Ag+>Cu2+>H+>Na+。
3.根据电解池中的电极反应规律,分析判断:(1)电解质溶液电解时,其阳极产物可能是什么?
提示 若为活泼电极,电极材料失去电子而溶解,阳极产物为其阳离子;若为惰性电极,则非金属阴离子或OH-放电,阳极产物为非金属单质。
(2)电解质溶液电解时,其阴极产物可能是什么?
提示 阴极产物可能是金属单质或氢气。
(3)电解质溶液电解时,哪些离子一般在水溶液中是不放电的?
提示 ①活泼金属阳离子,如:K+、Ca2+、Na+、Mg2+、Al3+等。②含氧酸根离子,如:
1.为探究电解的放电规律,进行如下实验:
下列说法不正确的是A.对比①②可知,阴极放电顺序:Cu2+>H+>Na+B.对比①③可知,阳极放电顺序:Cl->OH->C.对比③④可知,阳极是铜时,会先于溶液中的离子放电D.对比①⑤可知,要电解得到金属只能用熔融态,不能用水溶液
根据①知Cu2+的氧化性强于H+,根据②知H+的氧化性强于Na+,得电子能力强(氧化性强)的离子优先放电,所以对比①②可知,阴极放电顺序:Cu2+>H+>Na+,故A正确;根据①知,离子放电顺序:Cl->OH-,根据③知离子放电顺序:OH-> ,故B正确;电解池的阳极若是活泼电极,则金属电极本身失电子,发生氧化反应,对比③④可知,阳极是铜时,会优先于溶液中的离子放电,故C正确;要电解得到金属不一定只能用熔融态,电解氯化铜溶液也能得到金属铜,故D错误。
2.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、 、Cl- 5种离子中两两恰当的组成电解质,按下列要求进行电解:(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是_____________。
以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质是HCl、CuCl2。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是_________________。若要恢复到电解前的状态,应加入的物质是______。
Na2SO4、H2SO4
实质上是电解水,H+、OH-分别在两极上放电,因此,其电解质是Na2SO4、H2SO4。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是_______________。若要恢复到电解前的状态,应加入的物质是_____________________。
CuO(或CuCO3)、HCl
电解质是CuSO4,2CuSO4+2H2O 2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
3.用石墨作电极电解1 ml·L-1 CuSO4溶液,当c(Cu2+)为0.5 ml·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态_______(填序号)。①CuSO4 ②CuO ③Cu(OH)2 ④CuCO3
电解过程中的反应:阳极4OH--4e-===2H2O+O2↑,阴极2Cu2++4e-===2Cu,总反应为2CuSO4+2H2O 2H2SO4+2Cu+O2↑。由以上反应可知,电解使2 ml CuSO4和2 ml H2O变成了2 ml H2SO4,同时析出铜,放出O2,溶液中每生成2 ml Cu,则放出1 ml O2,故需补充CuO。由于CuCO3加入溶液后,会与溶液中的硫酸反应,生成CO2气体,不存在于溶液中,相当于只加了CuO,所以也可以加入CuCO3。
(1)解答电解原理题的一般思路[以惰性电极电解Cu(NO3)2溶液为例]
(2)电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
题组一 电解及其装置(电解池)1.下列关于电解池工作原理的说法错误的是A.电解池是一种将电能转化成化学能的装置B.电解池中发生的反应是非自发的氧化还原反应C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.与原电池不同,电解池放电时,电极本身不会参加电极反应
如果阳极是活泼电极,电极本身失去电子,发生氧化反应。
2.下列关于如图所示装置的叙述正确的是A.甲、乙装置中的锌片都作负极B.甲、乙装置中溶液内的H+都在铜片上 被还原C.甲、乙装置中锌片上发生的反应都是还原反应D.甲装置中铜片上有气泡生成,乙装置中铜片质量减小
乙为电解池,锌片为阴极,故A错误;乙为电解池,溶液内的H+在阴极锌片上被还原,故B错误;甲为原电池,锌片为负极,发生氧化反应,故C错误;
甲装置中铜片为正极,H+在铜片上得电子被还原为氢气,乙装置中铜片为阳极,发生氧化反应,铜片质量减小,故D正确。
3.如图装置中发生反应的离子方程式为Zn+2H+===Zn2++H2↑,下列说法错误的是A.a、b不可能是同种材料的电极B.该装置可能是电解池,电解质溶液为稀盐酸C.该装置可能是原电池,电解质溶液为稀盐酸D.该装置可看作是铜—锌原电池,电解质溶液是稀硫酸
若该装置为电解池,则a、b两电极的材料可以都为Zn,A项错误;在保证阳极为Zn时,该电解池的电解质溶液可以为稀盐酸,B项正确;
在保证其中一电极的材料为Zn时,用活泼性比锌弱的材料作另一电极,该原电池的电解质溶液为稀盐酸或稀硫酸都可以,C、D项正确。
4.用如图所示装置以石墨为电极电解氯化铜溶液,Y电极上产生能使湿润的碘化钾淀粉试纸变蓝的黄绿色气体。下列判断正确的是A.a为电源正极B.X电极质量增加C.Y电极若换成Cu,反应中该电极质量不变D.X电极表面发生氧化反应
Y电极上产生能使湿润的碘化钾淀粉试纸变蓝的黄绿色气体,即产生氯气,则Y电极为阳极,与Y电极相连的b为电源正极,X电极为阴极,与X电极相连的a为电源负极。根据分析可知a为电源负极,故A错误;
X电极为阴极,铜离子在阴极被还原生成铜单质,所以X电极质量增加,故B正确、D错误;Y电极为阳极,若换成Cu,则Cu被氧化生成铜离子,电极质量减小,故C错误。
题组二 电解规律及其应用5.用惰性电极电解物质的量浓度相同、体积比为3∶1的硫酸铜和氯化钠的混合溶液,不可能发生的反应有A.2Cu2++2H2O 2Cu+4H++O2↑B.Cu2++2Cl- Cu+Cl2↑C.2Cl-+2H2O 2OH-+H2↑+Cl2↑D.2H2O 2H2↑+O2↑
设混合溶液的体积为4 L,物质的量浓度均为1 ml·L-1,溶液中硫酸铜和氯化钠的物质的量分别为3 ml 和1 ml,根据转移电子守恒,第一阶段:阳极上氯离子放电,阴极上铜离子放电,电解反应的离子方程式是Cu2++2Cl- Cu+Cl2↑,氯离子完全反应时,剩余铜离子2.5 ml;第二阶段:阳极上氢氧根离子放电,阴极上铜离子放电,电解反应的离子的化学方程式是2Cu2++2H2O 2Cu+4H++O2↑;第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电,电解反应的离子的化学方程式是2H2O 2H2↑+O2↑。
6.用石墨作电极,电解1 ml·L-1的下列溶液,则电解前后溶液的pH保持不变的是A.硫酸 B.氢氧化钠C.硫酸钠 D.氯化钠
用惰性电极电解硫酸、氢氧化钠溶液、硫酸钠溶液实质是电解水,浓度增大,硫酸溶液的pH减小,氢氧化钠溶液的pH增大,硫酸钠溶液的pH不变;电解氯化钠溶液时生成氢氧化钠,溶液的pH增大。
7.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是
A应通HCl,B应加CuO或CuCO3,C应加H2O,D不需加任何物质。
8.用石墨作电极完成下列电解实验。
下列对实验现象的解释或推测不合理的是A.a为电解池的阴极B.b处有氯气生成,且与水反应生成了盐酸 和次氯酸C.c处发生了反应:Fe-3e-===Fe3+D.d处:2H2O+2e-===H2↑+2OH-
a处试纸变蓝,生成OH-,为阴极,电极反应式为2H2O+2e-===H2↑+2OH-,故A正确;b处变红,局部褪色,是因为2Cl--2e-===Cl2↑、Cl2+H2O HCl+HClO,HCl的酸
性使溶液变红,HClO具有漂白性使局部褪色,故B正确;Fe为阳极,c处发生反应:Fe-2e-===Fe2+,故C错误;d处试纸变蓝,生成OH-,为阴极,电极反应式为2H2O+2e-===H2↑+2OH-,故D正确。
题组三 电解的相关综合9.根据金属活动性顺序表,不能发生反应:Cu+2H2O===Cu(OH)2↓+H2↑,但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的一组是
若要发生反应:Cu+2H2O===Cu(OH)2↓+H2↑,则应该使用Cu作阳极,电解质溶液为活泼金属的无氧酸的盐,因此符合题意的选项是B。
10.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是A.b为直流电源的正极B.将装置中的阳离子交换膜换成阴离子 交换膜,电极反应式不变C.阳极的电极反应式为SO2+2H2O-2e-=== +4H+D.电解时,H+由阴极室通过阳离子交换膜到阳极室
二氧化硫被氧化为硫酸根离子,所以二氧化硫所在的区为阳极区,阳极与电源正极相连,则b为电源负极,故A错误;
将装置中的阳离子交换膜换成阴离子交换膜,电极反应式发生改变,故B错误;阳极的电极反应式为SO2+2H2O-2e-=== +4H+,故C正确;电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,故D错误。
11.如图是CO2经电催化还原为CH4的装置示意图。下列说法不正确的是A.该过程是电能转化为化学能的过程B.铜电极的电极反应式为CO2+8 +8e- ===CH4+8 +2H2OC.一段时间后,①池中n(KHCO3)不变D.一段时间后,②池中溶液的pH一定下降
该装置连有电源,则该过程是电能转化为化学能的过程,A项正确;二氧化碳转化为甲烷的过程中,碳元素的化合价降低,在铜电极上发生还原反应,电极反应式为CO2+8 +8e-===CH4+8 +2H2O,B项正确;
由于①池溶液中的碳酸氢根离子被消耗,故一段时间后,碳酸氢钾的物质的量减少,C项错误;
①池中的铜电极为阴极,发生还原反应,②池中的铂电极为阳极,发生氧化反应,电极反应式为2H2O-4e-===O2↑+4H+,该过程中有H+生成,故溶液的pH降低,D项正确。
12.一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如图所示的转化。下列说法正确的是A.贮能时,电能转变为化学能和光能B.贮能和放电时,电子在导线中流向相同C.贮能时,氢离子由a极区迁移至b极区D.放电时,b极发生反应: +2H++e- ===VO2++H2O
A项,贮能时,太阳能转化为化学能,错误;B项,贮能相当于电解,放电时是原电池原理,电子流向相反,错误;C项,贮能时,a极发生反应V3++e-===V2+,
b极发生反应VO2+-e-+H2O=== +2H+,H+由b极区迁移到a极区,错误;D项,放电时,b极作正极,得电子,其电极反应式为 +2H++e-===VO2++H2O,正确。
13.利用如图装置进行实验,甲、乙两池中均为1 ml·L-1的AgNO3溶液,A、B为质量相同的Ag电极。已知Ag+浓度越大,氧化性越强。(1)实验开始时先闭合K1,断开K2。此时该装置为_______(填“原电池”或“电解池”)。A电极上发生的电极反应式是_________________。
Ag++e-===Ag
实验开始时先闭合K1,断开K2,此时该装置为电解池,A电极与负极相连作阴极,Ag+在阴极得电子生成Ag单质,电极反应式是Ag++e-===Ag。
(2)一段时间后,断开K1,测得A、B两个电极质量相差21.6 g。闭合K2,观察到电流计指针发生偏转。请指出电流的方向为_______(填“A→B”或“B→A”),并说明理由:___________________________________________。到电流计指针重新归零时,理论上离子交换膜通过的 的物质的量为____ml。
此时乙池中c(Ag+)大于甲池,B作电源
根据信息“Ag+浓度越大,氧化性越强”,电解一段时间后甲、乙两池中Ag+浓度不同且乙中较大,B上可发生电极反应:Ag++e-===Ag,作原电池(浓差电池)的正极;A作负极,故电流的
方向为B→A,当反应至两边Ag+浓度相等时,电势差为零,电流计指针重新归零,此时A减轻10.8 g,B增重10.8 g,共转移0.1 ml电子,溶液中迁移的 也为0.1 ml。
14.如图X是直流电源。Y池中c、d为石墨棒,Z池中e、f是质量相同的铜棒,接通电路后,发现d附近显红色。
(1)①b为电源的_____极(填“正”“负”“阴”或“阳”,下同)。
②Z池中e为____极。③连接Y、Z池线路,电子流动的方向是d____e(填“→”或“←”)。
(2)①写出c极的电极反应式:___________________。②写出Y池中总反应的化学方程式:______________________________________。③写出Z池中e极的电极反应式:_________________。
2Cl--2e-===Cl2↑
Cu-2e-===Cu2+
d极附近显红色,说明d为阴极,电极反应式为2H2O+2e-===H2↑+2OH-,c为阳极,电极反应式为2Cl--2e-===Cl2↑,Y池电解NaCl溶液的总反应的化学方程式为2NaCl+2H2O 2NaOH+
Cl2↑+H2↑;直流电源中a为正极,b为负极,Z池中f为阴极,e为阳极,电极反应式分别为Cu2++2e-===Cu、Cu-2e-===Cu2+,电子流动方向由e→d。
15.A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:
图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。据此回答下列问题:
(1)M为电源的____(填“正”或“负”)极,电极b上发生的电极反应为__________________________。
4OH--4e-===2H2O+O2↑
乙中c电极质量增加,则c处发生的电极反应为Cu2++2e-===Cu,即c电极为阴极,由此可推出b为阳极,a为阴极,M为负极,N为
正极。而Cu2+只能和 结合,可以确定B为硫酸铜;由常温下各烧杯中溶液的pH与电解时间t的关系图,可以确定A为KOH或NaOH,C为Na2SO4或K2SO4。甲中为KOH或NaOH溶液,相当于电解H2O,阳极b处阴离子OH-放电,即4OH--4e-===2H2O+O2↑。
(2)写出乙烧杯中电解反应的化学方程式:_________________________________________。
+O2↑+2H2SO4
乙烧杯中是电解CuSO4溶液,电解反应的化学方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
(3)如果电解过程中B溶液中的金属离子全部析出,此时电解____(填“能”或“否”)继续进行,原因是 __________________________________________________。
硫酸铜溶液已转变为硫酸溶液,反应变为
乙中铜全部析出后,电解质变为H2SO4,所以电解反应仍能继续进行。
(4)若经过这一段时间后,要使丙恢复到原来的状态,需要进行的操作是________________________。
向丙烧杯中加入一定量水
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优质ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优质ppt课件,共27页。PPT课件主要包含了电解熔融氯化钠,课堂小结,习题探究等内容,欢迎下载使用。
化学选择性必修1第二单元 化学能与电能的转化一等奖课件ppt: 这是一份化学选择性必修1第二单元 化学能与电能的转化一等奖课件ppt,共60页。PPT课件主要包含了内容索引,原电池的工作原理,原电池原理的应用,课时对点练,Zn+Cu2+,Cu+Zn2+,逐渐溶解,Zn2+,Cu2+,Cl-等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教学课件ppt,共19页。PPT课件主要包含了实验4-2,析出金属铜,产生了氯气,实验原理分析,通电后,②电极反应,←e-,e-←,Cu2+>H+,Cl->OH-等内容,欢迎下载使用。













