
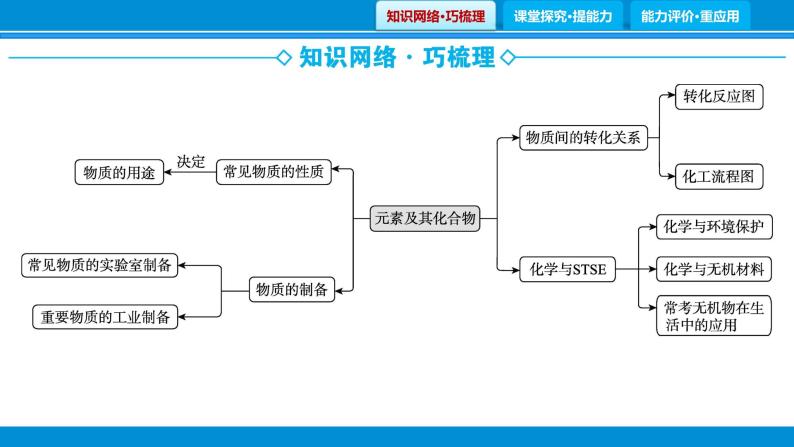





专题1 物质的转化、制备、性质与用途课件PPT
展开能力点1 物质间的转化关系
1.(2022·江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )A.自然固氮、人工固氮都是将N2转化为NH3B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4ClC.工业上通过NH3催化氧化等反应过程生产HNO3D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
解析:自然固氮是将N2转化为含氮化合物,但不一定是转化为NH3,比如雷雨时的自然固氮是将N2转化为NO,A项说法错误;侯氏制碱法以H2O、NH3、CO2、NaCl为原料首先制备NaHCO3和NH4Cl,反应的化学方程式为H2O+NH3+CO2+NaCl══NaHCO3↓+NH4Cl,然后使NaHCO3受热分解转化为Na2CO3,B项说法正确;工业上通过NH3催化氧化等反应生产HNO3,相关的化学反应方程式为4NH3+5O2 4NO+6H2O、2NO+O2══2NO2、3NO2+H2O══2HNO3+NO、4NO2+O2+2H2O══4HNO3,C项说法正确;氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,D项说法正确;故选A。
2.(2021·江苏卷)在指定条件下,下列选项所示物质间的转化能实现的是( )
解析:NO不溶于水也不与水反应,A错误;稀HNO3与Cu反应得到硝酸铜、水和NO,得不到NO2,B错误;NO有氧化性,CO有还原性,在高温、催化剂条件下二者可发生氧化还原反应转化为无毒的N2和CO2,C正确;O3有强氧化性,不能将硝酸根离子还原为N2,D错误。
3.(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )
解析:石灰水中Ca(OH)2浓度较小,一般用氯气和石灰乳反应制取漂白粉,故A错误;碳酸的酸性弱于盐酸,所以将二氧化碳通入氯化钠溶液中不会生成NaHCO3,故B错误;氧化性:Cl2>Br2>I2,所以氯气可以氧化溴化钠得到溴单质,溴单质可以氧化碘化钠得到碘单质,故C正确;电解氯化镁溶液无法得到镁单质,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电产生氢气,同时产生大量氢氧根,与镁离子产生沉淀,故D错误。
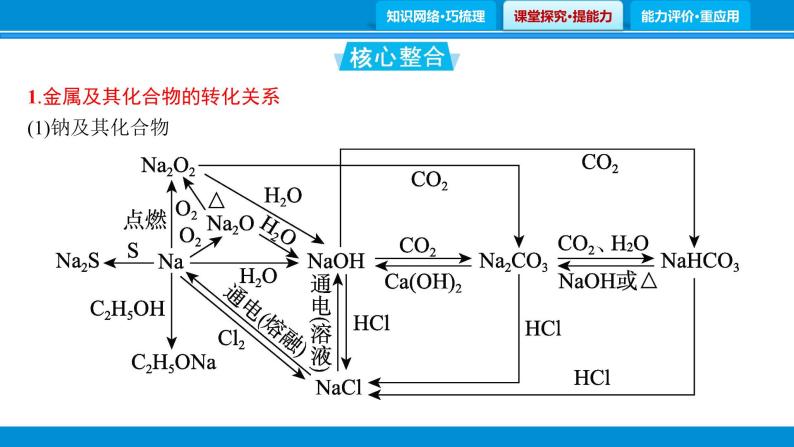
1.金属及其化合物的转化关系(1)钠及其化合物
写出下列反应的离子方程式。①Na和H2O的反应: 。 ②Na和CH3COOH的反应: 。 ③Na2O2和H2O的反应: 。 ④NaH和水的反应: 。 ⑤向NaOH溶液中通入过量CO2: 。 ⑥将Na2CO3溶液与石灰乳混合: 。 ⑦向Na2CO3溶液中通入过量CO2: 。
2Na+2H2O══2Na++2OH-+H2↑
2Na+2CH3COOH══2CH3COO-+2Na++H2↑
2Na2O2+2H2O══4Na++4OH-+O2↑
NaH+H2O══Na++OH-+H2↑
⑧将Na2CO3溶液和Ca(HCO3)2溶液混合: 。⑨将等物质的量浓度的NaHCO3溶液和NaOH溶液等体积混合: 。 ⑩将等物质的量浓度的NaHCO3溶液与澄清石灰水等体积混合: 。⑪将NaHCO3溶液与少量澄清石灰水混合: 。 ⑫向饱和Na2CO3溶液中通入过量CO2气体: 。
写出下列反应的方程式,是离子反应的写离子方程式。①Fe和过量稀HNO3的反应: 。 ②Fe在高温下和水蒸气的反应: 。 ③Fe2O3和Al的反应: 。 ④Fe2O3和CO的反应: 。 ⑤FeCl3溶液和Cu的反应: 。 ⑥FeCl3溶液与KSCN溶液的反应: 。 ⑦向FeCl2溶液中加入等物质的量的Na2O2: 。 ⑧向FeCl2溶液中加入NaClO: 。 ⑨Fe(OH)2长时间置于空气中: 。 ⑩Fe3O4和HCl的反应: 。
2Fe3++Cu══2Fe2++Cu2+
Fe3++3SCN-══Fe(SCN)3
4Fe2++4Na2O2+6H2O══4Fe(OH)3↓+8Na++O2↑
2Fe2++ClO-+4OH-+H2O══2Fe(OH)3↓+Cl-
4Fe(OH)2+O2+2H2O══4Fe(OH)3
Fe3O4+8H+══2Fe3++Fe2++4H2O
⑪Fe3O4和稀HNO3的反应: 。 ⑫FeO和HCl的反应: 。 ⑬FeO和稀HNO3的反应: 。 ⑭Fe(OH)2和HCl的反应: 。 ⑮Fe(OH)2和稀HNO3的反应: 。 ⑯Fe(OH)3和HI的反应: 。 ⑰FeBr2和少量Cl2的反应: 。 ⑱FeBr2和Cl2等物质的量的反应: 。 ⑲FeBr2和过量Cl2的反应: 。
FeO+2H+══Fe2++H2O
Fe(OH)2+2H+══Fe2++2H2O
2Fe(OH)3+6H++2I-══2Fe2++I2+6H2O
2Fe2++Cl2══2Fe3++2Cl-
2Fe2++2Br-+2Cl2══2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2══2Fe3++2Br2+6Cl-
写出下列反应的离子方程式。①Al和NaOH溶液的反应: 。 ②Al(OH)3和NaOH溶液的反应: 。 ③Al(OH)3和盐酸的反应: 。 ④Al2O3和NaOH溶液的反应: 。 ⑤Al2O3和盐酸的反应: 。 ⑥NaAlO2和过量盐酸的反应: 。 ⑦向NaAlO2溶液中通入过量CO2气体: 。 ⑧将NaAlO2溶液与NaHCO3溶液混合: 。 ⑨将NaAlO2溶液与AlCl3溶液混合: 。 ⑩向AlCl3溶液中加入过量NaOH溶液: 。 ⑪向AlCl3溶液中加入过量氨水: 。 ⑫将AlCl3溶液与NaHCO3溶液混合: 。
Al(OH)3+3H+══Al3++3H2O
Al2O3+6H+══2Al3++3H2O
2.非金属及其化合物的转化关系(1)氯及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。①Cl2和H2O的反应: 。 ②Cl2和NaOH溶液的反应: 。 ③Cl2和石灰乳的反应: 。 ④把Cl2通入到Na2SO3溶液中: 。 ⑤将Cl2和SO2混合通入H2O中: 。 ⑥将Cl2通入到H2S溶液中: 。 ⑦将浓盐酸和MnO2混合加热: 。 ⑧电解饱和食盐水: 。 ⑨将浓盐酸与漂白液混合: 。
Cl2+2OH-══Cl-+ClO-+H2O
2Cl2+2Ca(OH)2══2Ca2++2Cl-+2ClO-+2H2O
Cl2+H2S══S↓+2H++2Cl-
Cl-+ClO-+2H+══Cl2↑+H2O
⑩将浓盐酸与KClO3溶液混合: 。 ⑪向KMnO4固体中滴加浓盐酸: 。 ⑫向漂白粉溶液中通入少量CO2气体: 。 ⑬向漂白粉溶液中通入少量SO2气体: 。⑭向漂白粉溶液中通入过量SO2气体: 。
Ca2++2ClO-+CO2+H2O══CaCO3↓+2HClO
Ca2++3ClO-+SO2+H2O══CaSO4↓+Cl-+2HClO
写出下列反应的方程式,是离子反应的写离子方程式。①S和热NaOH溶液的反应: 。 ②把H2S气体通入CuSO4溶液中: 。 ③FeS和稀H2SO4反应: 。 ④FeS和稀HNO3反应: 。 ⑤将SO2气体通入到氢硫酸中: 。 ⑥把H2S气体通入到FeCl3溶液中: 。 ⑦把H2SO4、Na2SO3、Na2S三种溶液混合: 。 ⑧把SO2气体通入到酸性KMnO4溶液中: 。
H2S+Cu2+══CuS↓+2H+
FeS+2H+══Fe2++H2S↑
SO2+2H2S══3S↓+2H2O
H2S+2Fe3+══S↓+2Fe2++2H+
⑨Cu和浓硫酸的反应: 。 ⑩C和浓硫酸的反应: 。 ⑪把浓H2SO4滴到Na2SO3固体上: 。 ⑫将少量NaHSO4滴到Ba(OH)2溶液中: 。 ⑬将Ba(OH)2溶液滴加到NaHSO4溶液中至溶液呈中性: 。
H2SO4(浓)+Na2SO3══Na2SO4+H2O+SO2↑
(3)氮及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。①N2和H2的反应: 。 ②把NH3通入水中: 。 ③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3: 。 ④NH4HCO3溶液与少量NaOH溶液的反应: 。 ⑤NH4HCO3溶液与少量Ba(OH)2溶液的反应: 。 ⑥Mg3N2与H2O的反应: 。 ⑦Cu和稀HNO3的反应: 。 ⑧Cu和浓HNO3的反应: 。
Mg3N2+6H2O══3Mg(OH)2↓+2NH3↑
⑨Fe和少量稀HNO3的反应: 。 ⑩Fe和过量稀HNO3的反应: 。 ⑪C和浓HNO3的反应: 。 ⑫S和浓HNO3的反应: 。
(4)碳、硅及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。①Si和NaOH溶液的反应: 。 ②SiO2和NaOH溶液的反应: 。 ③SiO2和C的反应: 。 ④向Na2SiO3溶液中通入过量CO2气体: 。 ⑤Si和氢氟酸的反应: 。 ⑥Mg在CO2中燃烧: 。 ⑦向苯酚钠溶液中通入少量CO2气体: 。⑧向澄清石灰水中通入少量CO2气体: 。
Si+4HF══SiF4↑+2H2↑
Ca2++2OH-+CO2══CaCO3↓+H2O
⑨向澄清石灰水中通入过量CO2气体: 。 ⑩除去CO2中的CO: 。 ⑪Na2CO3和SiO2的反应: 。 ⑫CaO和MgCl2溶液的反应: 。
CaO+Mg2++H2O══Mg(OH)2↓+Ca2+
1.(2022·江苏调研)As2O3俗称砒霜,是一种两性氧化物,可用于治疗癌症。As2O5是一种酸性氧化物。水体中含有一定浓度的H3AsO3和H3AsO4时会破坏水质,需要通过一定的方法除去。下列转化在指定条件下能够实现的是( )
解析:As2O3是一种两性氧化物,和盐酸反应生成AsCl3而不是生成酸,A错误;As2O5是最高价砷元素的氧化物,次氯酸钠具有氧化性,二者不能发生氧化还原反应,B错误;H3AsO4为三元酸,可以和过量的氢氧化钠反应生成正盐Na3AsO4,C正确;As2O5是一种酸性氧化物,可以和水反应生成H3AsO4,D错误。
2.(2022·南通基地大联考)在指定条件下,下列含氯物质的转化不能实现的是( )
解析:盐酸的酸性强于碳酸,往氯化钠溶液中通入过量二氧化碳不会生成碳酸氢钠,选项A符合题目要求;浓盐酸与二氧化锰共热生成氯化锰、氯气和水,转化可以完成,选项B不符合题目要求;在氯化氢氛围中加热氯化镁晶体,可得到无水氯化镁,转化可以完成,选项C不符合题目要求;次氯酸受热分解生成HCl和氧气,转化可以完成,选项D不符合题目要求。
3.在指定条件下,下列铁及其化合物之间的转化能实现的是( )
解析:铁单质与水蒸气在高温下反应生成四氧化三铁,A正确;铁单质与盐酸反应生成氯化亚铁而不是生成氯化铁,B错误;氢氧化亚铁与足量稀硝酸反应生成硝酸铁,而不是生成硝酸亚铁,C错误;二氧化硫与水反应生成亚硫酸而不是生成硫酸,D错误。
能力点2 常见物质的实验室制法与化工生产
1.(2022·江苏卷)实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是( )A.用装置甲制取SO2气体B.用装置乙制取SO2水溶液C.用装置丙吸收尾气中的SO2D.用干燥pH试纸检验SO2水溶液的酸性
解析:60%硫酸和NaHSO3(s)可发生反应:H2SO4+2NaHSO3══Na2SO4+2SO2↑+2H2O,因此用装置甲可以制取SO2气体,A项不符合题目要求;气体通入液体时“长进短出”,用装置乙可以制取SO2水溶液,B项不符合题目要求;SO2在饱和NaHSO3溶液中溶解度很小,因此用装置丙不能吸收尾气中的SO2,C项符合题目要求;SO2水溶液显酸性,可用干燥的pH试纸检验其酸性,D项不符合题目要求;答案选C。
2.(2021·江苏卷)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是( )A.用装置甲除去废铜屑表面的油污B.用装置乙在加热的条件下溶解废铜屑C.用装置丙过滤得到CuSO4溶液D.用装置丁蒸干溶液获得CuSO4·5H2O
解析:碳酸钠溶液显碱性,在加热的条件下可以除去铜屑表面的油污,A项不符合题目要求;在酸性条件下,铜与双氧水发生氧化还原反应生成硫酸铜,B项不符合题目要求;装置丙为过滤装置,过滤可以除去难溶性杂质,得到硫酸铜溶液,C项不符合题目要求;用装置丁蒸干溶液得到的是CuSO4,而不是CuSO4·5H2O,D项符合题目要求。
3.(2020·江苏卷)实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
解析:碳酸钙盛放在锥形瓶中,盐酸盛放在分液漏斗中,打开分液漏斗活塞,盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,故A项不符合题目要求;二氧化碳密度比空气大,可以用向上排空气法收集二氧化碳气体,故B项不符合题目要求;加入的盐酸与碳酸钙反应后,部分碳酸钙未反应完,碳酸钙是难溶物,因此可以用过滤的方法分离,故C项不符合题目要求;CaCl2·6H2O易失去结晶水,因此不能通过加热蒸发得到,可冷却氯化钙的热饱和溶液析出六水氯化钙结晶水合物,故D项符合题目要求。
4.(2021·河北卷)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:下列说法错误的是( )A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度B.转化工序中加入稀HCl可抑制生成BiONO3 C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
核心知识1 常见物质的制备知识网络
核心知识2 常见物质的实验室制法
核心知识3 重要的工业生产
1.(2022·南通基地大联考)以菱镁矿(主要成分是MgCO3,含少量FeCO3)为原料制取高纯氧化镁需要经历酸浸、调pH、过滤、灼烧等操作。下列实验装置和原理能达到实验目的的是( )A.用装置甲配制稀H2SO4B.用装置乙测定溶液的pHC.用装置丙过滤悬浊液D.用装置丁灼烧Mg(OH)2固体
解析:容量瓶属于玻璃精量器,不能在容量瓶中直接稀释浓硫酸,选项A错误;测定溶液的pH时不能将pH试纸直接放进溶液中,应用玻璃棒蘸取溶液点在试纸上,再与标准比色卡对比读数,选项B错误;用装置丙过滤悬浊液,装置及操作均正确,选项C正确;灼烧固体时应选用坩埚,用试管加热固体物质时试管口应该向下倾斜,选项D错误。
2.(2022·江苏常州期末检测)铁元素的常见价态有+2、+3价,实验室可用赤血盐(K3[Fe(CN)6])溶液检验Fe2+,黄血盐(K4[Fe(CN)6])溶液检验Fe3+。Fe2O3是重要的化工原料,Au/Fe2O3可用作反应CO(g)+H2O(g)══CO2(g)+H2(g)的催化剂。硫铁矿烧渣中含有大量Fe2O3,工业上常用于制取绿矾(FeSO4·7H2O)。由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾的流程如图:下列有关说法不正确的是( )A.“酸溶”时先将烧渣粉碎并不断搅拌,可提高铁元素的浸出率B.“反应”时发生的主要反应为2Fe3++Fe══3Fe2+C.“检验”时可用K4[Fe(CN)6]溶液检验上一步“反应”是否进行完全D.将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾
解析:由题给流程可知,硫铁矿烧渣加入稀硫酸酸溶时,氧化铁、氧化铝溶于稀硫酸得到可溶性硫酸盐,二氧化硅不与稀硫酸反应,过滤得到含有二氧化硅的滤渣和含有可溶性硫酸盐的滤液;向滤液中加入适量铁粉,将铁离子完全转化为亚铁离子,取溶液少许加入K4[Fe(CN)6]溶液检验溶液中不存在铁离子后,加入氢氧化钠溶液调节溶液pH,将铝离子完全转化为氢氧化铝沉淀,过滤得到氢氧化铝滤渣和硫酸亚铁溶液;硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾。酸溶时先将烧渣粉碎并不断搅拌,可增大反应物的接触面积,使反应物充分反应,从而提高铁元素的浸出率,A项说法正确;由分析可知,反应步骤发生的反应为溶液中铁离子与铁反应生成亚铁离子,反应的离子方程式为2Fe3++Fe══3Fe2+,B项说法正确;由分析可知,检验“反应”步骤中铁离子是否完全反应,可以加入K4[Fe(CN)6]溶液检验,C项说法正确;由分析可知,将第二次过滤所得滤液硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾,D项说法错误。
能力点3 常见物质的性质与用途
1.(2022·江苏卷)我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是( )A.石墨能导电,可用作润滑剂B.单晶硅熔点高,可用作半导体材料C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑D.含铅化合物颜色丰富,可用作电极材料
解析:石墨是层状结构,层与层之间易滑动,质软,可用作润滑剂,故A错误;单晶硅可用作半导体材料与熔点高无关,故B错误;青铜是铜合金,比纯铜熔点低、硬度大,易于锻造,古代用青铜铸剑,C正确;含铅化合物可在正极得到电子发生还原反应,所以可用作电极材料,与含铅化合物颜色丰富无关,故D错误;故选C。
2.(2021·江苏卷)下列有关物质的性质与用途不具有对应关系的是( )A.铁粉能与O2反应,可用作食品保存的吸氧剂B.纳米Fe3O4能与酸反应,可用作铁磁性材料C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的CuD.聚合硫酸铁能水解并形成胶体,可用于净水
解析:因为铁粉能与O2反应,所以可用作食品保存的吸氧剂,A项不符合题目要求;纳米Fe3O4具有磁性,可用作铁磁性材料,B项符合题目要求;FeCl3与Cu反应生成FeCl2和CuCl2,主要利用其氧化性,C项不符合题目要求;聚合硫酸铁能水解并形成胶体,胶体具有吸附性,可用于净水,D项不符合题目要求。
3.(2020·江苏卷)下列有关物质的性质与用途具有对应关系的是( )A.铝的金属活泼性强,可用于制作铝金属制品B.氧化铝熔点高,可用作电解冶炼铝的原料C.氢氧化铝受热分解,可用于中和过多的胃酸D.明矾溶于水并水解形成胶体,可用于净水
解析:铝在空气中可以与氧气反应生成致密的氧化铝薄膜,致密氧化铝薄膜包裹在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A项不符合题目要求;氧化铝为离子化合物,可用作电解冶炼铝的原料,B项不符合题目要求;氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C项不符合题目要求;明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,可用于净水,D项符合题目要求。
核心知识1 常见物质的性质
核心知识2 常见物质的俗名胆矾、蓝矾:CuSO4·5H2O;钡餐、重晶石:BaSO4;烧碱、火碱、苛性钠:NaOH ;芒硝:Na2SO4·10H2O;熟石灰、消石灰:Ca(OH)2;熟石膏:2CaSO4·H2O;铜绿、孔雀石:Cu2(OH)2CO3;明矾:KAl(SO4)2·12H2O;水玻璃、泡花碱:Na2SiO3溶液;铁红:Fe2O3;碱石灰:CaO与NaOH的混合物。
1.(2022·江苏新高考基地大联考)下列有关物质的性质与用途具有对应关系的是( )A.MgO难溶于水,可用作耐火材料B.ClO2具有氧化性,可用于自来水的杀菌消毒C.浓H2SO4具有脱水性,可用于干燥气体D.NaHCO3受热易分解,可用于制抗酸药物
解析:MgO是离子化合物,熔点较高,因此可用作耐火材料,用作耐火材料与其难溶于水的性质无关,A项不符合题目要求;ClO2具有氧化性,能够使水中的细菌、病毒的蛋白质分子结构发生改变而失去其生理活性,因此可用于自来水的杀菌消毒,B项符合题目要求;由于浓H2SO4具有吸水性,故可用于干燥气体,C项不符合题目要求;NaHCO3能够与胃酸(盐酸)发生反应,从而降低胃酸的浓度,故可用作抗酸药物,这与其受热易分解的性质无关,D项不符合题目要求。
2.(2022·苏州相城陆慕中学模拟)氮、磷、砷元素广泛应用于生产、生活中。下列氮及其化合物的性质与用途的对应关系不正确的是( )A.氯化铵溶液显酸性,可用作除锈剂B.氨气易液化,可用作制冷剂C.氮气的化学性质不活泼,食品袋中充氮气来防氧化D.常温下,浓硝酸不跟铁发生化学反应,可以用铁制容器装浓硝酸
解析:氯化铵是强酸弱碱盐,在溶液中水解使溶液呈酸性,水解生成的氢离子能与铁锈的主要成分氧化铁反应达到除锈的目的,所以氯化铵溶液常用作除锈剂,故A项不符合题目要求;氨气易液化,液氨汽化时会吸收大量的热,降低周围环境的温度达到制冷的作用,所以液氨可用作制冷剂,故B项不符合题目要求;氮气的化学性质不活泼,性质稳定,可做保护气,所以食品袋中充氮气可以形成无氧环境,防止食品被氧化,故C项不符合题目要求;浓硝酸具有强氧化性,常温下能使铁钝化,阻碍反应的继续进行,所以可以用铁制容器装浓硝酸,故D项符合题目要求。
能力点4 化学与STSE
1.(2022·江苏卷)我国为人类科技发展作出巨大贡献。下列成果研究的物质属于蛋白质的是( )A.陶瓷烧制B.黑火药C.造纸术D.合成结晶牛胰岛素
解析:陶瓷的主要成分是硅酸盐,陶瓷烧制研究的物质是硅的化合物,A项不符合题目要求;黑火药研究的物质是硫、碳和硝酸钾,B项不符合题目要求;造纸术研究的物质是纤维素,C项不符合题目要求;结晶牛胰岛素的成分是蛋白质,故合成结晶牛胰岛素研究的物质是蛋白质,D项符合题目要求;答案选D。
2.(2020·江苏卷)打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是( )A.PM2.5B.O2 C.SO2D.NO
解析:PM2.5是指环境空气中空气动力学当量直径小于等于2.5微米的颗粒物,PM2.5粒径小,面积大,活性强,易附带有毒、有害物质,且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响大,其在空气中含量浓度越高,就代表空气污染越严重,PM2.5属于空气污染物,A项不符合题目要求;O2是空气的主要成分之一,是人类维持生命不可缺少的物质,不属于空气污染物,B项符合题目要求;SO2引起的典型环境问题是形成硫酸型酸雨,SO2属于空气污染物,C项不符合题目要求;NO引起的典型环境问题有:硝酸型酸雨、光化学烟雾、破坏臭氧层等,NO属于空气污染物,D项不符合题目要求。
核心知识1 化学与环境保护1.绿色化学:核心是利用化学原理从源头上减少和消除化工生产对环境的污染;原则是原子利用率为100%。
核心知识2 化学与无机材料
核心知识3 常考无机物在生活中的应用
1.(2022·江苏南通如东期末学情检测)2020年11月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度10 909 m处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是( )A.“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料B.“奋斗者”号使用的锂离子电池工作时Li+向正极移动C.未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机D.制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
解析:超高压光纤微缆的主要成分是二氧化硅,属于新型无机非金属材料,A项说法错误;原电池中,阳离子向正极移动,因此锂离子电池工作时 Li+向正极移动,B项说法正确;“可燃冰”作为一种天然气水合物,属于新能源,未来对海底“可燃冰”的开采将有助于缓解能源危机,C项说法正确;合金的硬度比纯金属的大,钛合金属于合金材料,比纯金属钛具有更高的强度,D项说法正确。
2.(2022·江苏如皋期末检测)《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。青矾加热时的反应为2(FeSO4·7H2O) Fe2O3+SO2↑+H2SO4+13H2O。下列说法正确的是( )A.产物中含有3种非金属氧化物B.所得赤色物质为FeSO4C.反应为分解反应D.铁元素发生还原反应
解析:由反应方程式可知,产物中含有SO2和H2O两种非金属氧化物,A项错误;FeSO4·7H2O为绿色固体而不是赤色,所得赤色物质应该为Fe2O3,B项错误;由反应方程式可知,一种物质生成四种物质,该反应为分解反应,C项正确;由反应方程式可知,反应中铁元素的化合价由+2价升高到+3价,失去电子,发生氧化反应,D项错误。
1.(2022·江苏南京、盐城二模)2021年12月9日,我国宇航员在中国空间站直播了泡腾片水球实验。泡腾片中含有柠檬酸(结构如图所示)和碳酸钠等,溶于水产生气泡。下列说法不正确的是( )A.柠檬酸属于有机物B.碳酸钠溶液呈碱性C.产生的气体为CO2D.碳酸钠与柠檬酸发生了氧化还原反应
解析:根据柠檬酸的结构简式可知,柠檬酸含有C、H、O元素,属于有机物,A项说法正确;碳酸钠属于强碱弱酸盐,其水溶液显碱性,B项说法正确;柠檬酸分子中含有羧基,酸性比碳酸酸性强,与碳酸钠反应生成CO2,C项说法正确;该反应中各元素的化合价没有变化,属于非氧化还原反应,其原理是用酸性强的酸制取酸性弱的酸,D项说法错误。
2.(2022·江苏泰州高三期末考试)在指定条件下,下列选项所示的物质间转化能实现的是( )
解析:钠和氧气在常温下反应生成氧化钠,不能生成过氧化钠,故物质间的转化不能实现,A项错误;氮气和氧气在放电条件下反应生成一氧化氮,一氧化氮与氧气、水反应生成硝酸,即物质间的转化能实现,B项正确;硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,即物质间的转化不能实现,C项错误;铁在高温下与水蒸气反应生成四氧化三铁和氢气,不能生成氧化铁,即物质间的转化不能实现,D项错误。
3.(2021·广东卷)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
4.(2022·湖南卷)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是 ( )A.《神农本草经》中记载的“石胆能化铁为铜”B.利用“侯氏联合制碱法”制备纯碱C.科学家成功将CO2转化为淀粉或葡萄糖D.北京冬奥会场馆使用CO2跨临界直冷制冰
解析:“石胆能化铁为铜”指的是铁可以与硫酸铜发生置换反应生成铜,发生了化学变化,A不符合题意;工业上利用“侯氏联合制碱法”制备纯碱,二氧化碳、氨气、氯化钠和水发生反应生成的碳酸氢钠晶体经加热分解生成碳酸钠(即纯碱),发生了化学变化,B不符合题意;CO2转化为淀粉或葡萄糖,有新物质生成,发生了化学变化,C不符合题意;使用CO2跨临界直冷制冰,将水直接转化为冰,没有新物质生成,只发生了物理变化,没有涉及化学变化,D符合题意;综上所述,本题选D。
5.(2022·盐城模拟)一种工业制备无水氯化镁的工艺流程如图:下列说法错误的是( )A.物质X常选用生石灰B.工业上常用电解熔融MgCl2的方法制备金属镁C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+COD.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
高考化学一轮复习考点备考课件专题八考点指导1以气体制备为主线的物质制备与性质验证 (含解析): 这是一份高考化学一轮复习考点备考课件专题八考点指导1以气体制备为主线的物质制备与性质验证 (含解析),共10页。PPT课件主要包含了典例剖析,制备Cl2,除HCl气体,主反应,尾气处理,HCl,方法指导,试题备选,液柱高度保持不变,防止倒吸等内容,欢迎下载使用。
苏教版 (2019)第二单元 金属钠及钠的化合物备课课件ppt: 这是一份苏教版 (2019)第二单元 金属钠及钠的化合物备课课件ppt,共60页。PPT课件主要包含了化合态,氯化钠,碳酸钠,硫酸钠,银白色,钠熔点低反应放热,钠的密度比水小,钠与水反应生成气体,钠与水反应生成碱,H2O等内容,欢迎下载使用。
化学选择性必修3实验活动1 乙酸乙酯的制备与性质一等奖ppt课件: 这是一份化学选择性必修3实验活动1 乙酸乙酯的制备与性质一等奖ppt课件













