






初中化学人教版 (五四制)八年级全册第四单元 自然界的水课题4 化学式与化合价教学课件ppt
展开学习目标1.能表达常见纯净物的化学式的4种意义;2.学会书写常见纯净物的化学式。
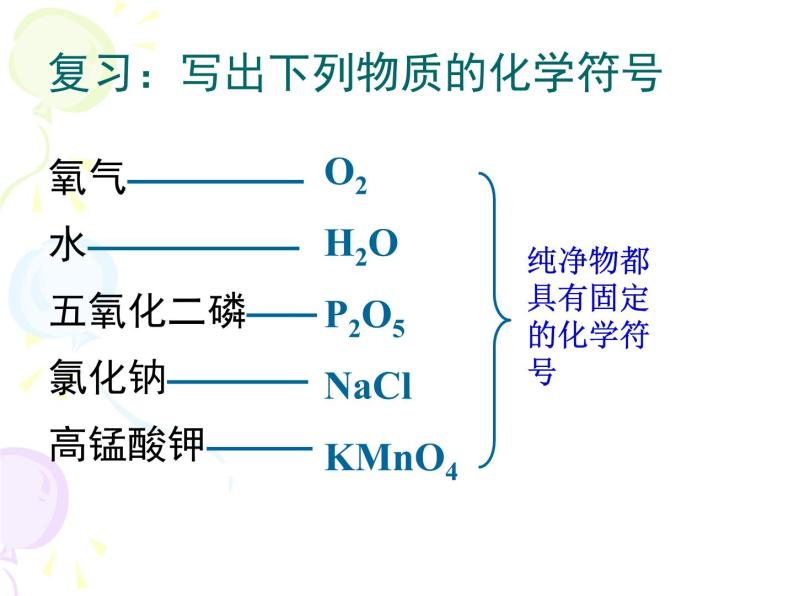
复习:写出下列物质的化学符号
氧气—————水——————五氧化二磷——氯化钠————高锰酸钾———
O2H2O P2O5NaClKMnO4
用元素符号和数字的组合表示物质组成的式子。叫做化学式。
如:CO2、SO2、H2O 、 H2、O2
以水的化学式(H2O)为例,讨论化学式的意义。
“H2O”表示的意义
1、化学式的意义表示:
(2)物质的元素组成。
(3)物质的一个分子。
(4)物质的分子构成。
(1)二氧化碳。(2)二氧化碳由碳元素和氧元素组成。(3)一个二氧化碳分子。(4)一个二氧化碳分子由一个碳原子和两个氧原子构成。
练习:写出H2O2的4种意义
符号H、2H、H2、2H2各具有什么意义?
H——氢元素、一个氢原子
H2——氢气、氢气由氢元素组成、一个氢分子、一个氢分子由两个氢原子构成
练习:下列符号各有什么意义。
N——2N——N2——2N2——
氮气, 1个氮气分子;
请正确书写下列物质的化学式,并加以分类:铜、五氧化二磷、硫、氦气、二氧化碳、氮气、磷、氖气、氧化镁、四氧化三铁、氯化钾
习惯上用元素符号表示,如氦写为He,氖写为Ne
习惯上用元素符号表示,如碳写为C ,P S Si
在右下角写上数字2,如氧气O2 , N2 H2 Cl2 F2 I2
习惯上用元素符号表示,如铁写为Fe ,Cu Hg Zn Mg Ca k Na
a 、单质:b、化合物:
由原子直接构成的——用元素符号直接表示。例如:Fe、He、C等.
由分子直接构成的气体——用“X2”表示。例如:H2、O2、F2等。
氧化物:氧在后,其它元素在前。例如:CO、SO2、H2O等。
由金属元素与非金属元素形成的化合物:金属在前,非金属在后。例如:NaCl、FeCl3等。
1.知道化合物含哪几种元素及不同元素的原子个数。
①当原子个数比是1时,1省略不写;②氧化物中,一般氧的元素符号在右,另一种元素的符号在左;③由金属元素与非金属元素组成的化合物中,一般金属元素的符号在左,非金属元素的符号在右。
从右向左读“某化某”,有些原子的个数要读出。
例如:KCl SO3 SO2
练习:请判断下列物质的化学式的书写或读法是否正确,错的请改正。
(1)P2O5 (2)氯化氢 (3)氧化铜二磷化五氧 ClH CuO(4)Fe3O4 (5)NaOH 四氧化三铁 氢氧化钠
练习:写出下列物质的化学式
硫 氧气二氧化硫 氯化钾氯化氢 氧化铜四氧化三铁 氖气
化学上用“化合价”来表示原子与原子之间相互化合的数目。
(一)化合价的一般规律:
1、化合价有正价和负价。
(1)氧元素通常显-2价。
(2)氢元素通常显+1价。
2、化合物:正负化合价的代数和为零。
3、在单质里,元素的化合价为零。
(3)一般金属元素显正价,非金属元素显负价
正化合价+负化合价=0
一些常见元素和根的化合价
一价氢氯钾钠银,二价氧镁钙钡锌,三铝四硅四七锰,正一亚铜正二铜,正二亚铁正三铁,单质零价要记清,化合价代数和为零。
金属元素皆正价,写化学式在前列,许多元素可变价,条件不同价不同,负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根,常见根价要记清。
化合价的标示方法及意义
标在元素符号(或原子团)的正上方,先写“+”号或“-"号后写数值
如:Mg
在化合物镁元素的化合价为+2价
在化合物中氯元素的化合价为-1价
水中氢元素的化合价为+1价
硫酸根的化合价为-2价
化合价与离子符号表示意义的区别与联系
表示在化合物中镁元素的化合价为+2价
表示每个镁离子带两个单位的正电荷
化合价与离子符号的区别和联系
(1)表示方法不同(2)含义不同(3)化合价中“1”不可省略,离子中“1”要省略。
同种元素:化合价=离子的电荷
不同位置上数字的含义
一个氮分子中含有两个氮原子
一个水分子中含有2个氢原子
一个镁离子带有两个单位的正电荷
一个硫离子带有两个单位的负电荷
一个硫酸根中含有4个氧原子
高锰酸钾中锰元素的化合价为+7价
铵根中氮元素的化合价为-3价
氮原子的原子核内的质子数为7氮原子的最外层有5个电子
三种微粒符号的表示方法
原子团的符号、化合价和对应的离子符号
1、根据化合价写化学式:
原则:正负化合价的代数和为零,一般原子个数比为最简整数比。
正化合价总数+负化合价总数=0
1、Al的化合价为+3,O的化合价为-2,求这种氧化物的化学式。2、 硫酸铁中Fe的化合价为+3价, SO4 的化合价为-2价,求硫酸铁的化学式。3、已知高氯酸钾中K、Cl、O的化合价分别为+1、+7、-2,则高氯酸钾的化学式为( ) A、KClO4 B、K2ClO5
总结:根据化合价写出物质的化学式常用“十字交叉法”
“一排二标三交四约五查”一排:元素符号按正价前,负价后顺序排列。二标:标出各元素的化合价,如果有根(原子团)只需标出根(原子团)的化合价。三交:将元素(或根)的化合价的绝对值交叉写在另一元 素符号(或根)的右下角,根(原子团)有2个以上的,根(原子团)要加括号,以示明确。四约:将各元素的原子数约成最简整数比。五查:查化合价代数和是否为零。
练习1:查表4-2写出下列物质的化学式。
氢氧化钾氢氧化钙氢氧化铁
Fe 2 (SO4) 3
某化某:指该物质中含两种元素某酸某:指该物质中含“某酸根”原子团氢氧化某:指该物质中含“氢氧根”原子团某化亚某:某酸亚某:氢氧化亚某:
指该物质中正价元素有两种化合价,且取该元素较低的化合价。
练习3:已知元素M的氧化物化学式为M2On,则M的氯化物的化学式为____。
练习2:判断下列化学式是否正确,错则更正。 MgO2、NaO、Ba2O2、K(OH)2、 NaCO3、 CaCl、 AgCl2
写出下列物质的化学式。
氧化钾 氧化银 氧化钡 氧化铝 氧化亚铁 氧化铁 氧化铵
氯化钾 氯化银 氯化钡 氯化铝 氯化亚铁 氯化铁 氯化铵
氢氧化钾 氢氧化钡 氢氧化铝 氢氧化亚铁 氢氧化铁 氢氧化铵
硫酸钾 硫酸银 硫酸钡 硫酸铝 硫酸亚铁 硫酸铁 硫酸铵
碳酸钾 碳酸银 碳酸钡 碳酸铝 碳酸亚铁 碳酸铁 碳酸铵
硝酸钾 硝酸银 硝酸钡 硝酸铝 硝酸亚铁 硝酸铁 硝酸铵
硫化钾 硫化银 硫化钡 硫化铝 硫化亚铁 硫化铁 硫化铵
尝试题 试确定氯酸钾中氯元素的化合价
解:设KClO3中Cl的化合价为X
列等式(正负总价和为0)
+1+X+(-2) ×3=0
原则:正负化合价的代数和为零。
根据化学式,确定元素或原子团的化合价。
练习1:指出下列各物质中氯元素的化合价: KCl、Ca(ClO)2、KClO3、HClO4、Cl2、FeCl3
-1 +1 +5 +7 0 -1
练习2:确定下列物质中原子团的化合价: Mg(NO3)2、BaSO4、Na3PO4、Ca(OH)2、 NH4NO3、KClO、、K2MnO4、Na2CO3
*练习3:某物质化学式为Hn+1RO2n+1,则R的化合价为_____。
1、说出下列物质中硫元素的化合价 H2S S H2SO3 H2SO4
2、标出下列物质中锰元素的化合价
MnO2 Mn K2MnO4 KMnO4 MnCl2
请写出下列符号的意义:
O ——2O ——O2 ——2O2 ——O2- ——2O2- ——O ——
氧气,1个氧气分子,每个氧气分子中含有2个氧原子。
带2个单位负电荷的氧离子。
氧元素的化合价为-2价。
(1)氯化银 (2)三氧化二铁 (3)五氧化二氮(4)硫酸铜 (5)氢氧化镁 (6)氯化钙 (7)碳酸镁 (8)氧化亚铁
综合应用: 某物质的化学式为HnRO2n-1,它的相对分子质量为M,则该化合物中R 元素的化合价为________,R 元素的相对原子质量为_________ (O-16 H-1)
解:(1)设R的化合价为x (+1) ·n+x+(-2) ·(2n-1)=0 x=+(3n-2) (2)M-1×n-16×(2n-1) =M-33n+16
化学式中各个原子的相对原子质量的总和。
相对分子质量的国际单位制(SI)单位为1(一般不写出)。
三、有关相对分子质量的计算
1、计算相对分子质量
[例题1]:计算下列物质的相对分子质量 。N2 的相对分子质量=H2SO4的相对分子质量= Cu(OH)2的相对分子质量= (NH4)2SO4的相对分子质量= C6H12O6的相对分子质量= HmSO2n+1的相对分子质量=
1× 2 + 32 + 16 × 4= 98
64 +(16+1)×2 = 98
(14+1× 4)× 2 + 32 + 16 × 4= 132
12× 6+ 1 ×12 + 16 × 6= 180
挑战自我: 2 H2SO4的相对分子质量总和如何计算?
2、计算组成物质的各元素的质量比。
练习1、计算NH4NO3中氮、氢、氧元素的质量比。
练习2、求硫酸(H2SO4)中各元素的质量比。
例题2:二氧化碳中碳元素和氧元素的质量比
C∶O=12∶16×2=3∶8
NH4NO3中氮元素、氢元素和氧元素的质量比 N ∶ H∶O=14×2∶1×4∶ 16×3=7:1:12
H2SO4中氢、硫、氧三种元素的质量比 H∶S∶O=1×2∶32∶16×4=1∶16∶32
3、计算物质中某元素的质量分数
[例题3]:(1)计算氮肥NH4NO3中各元素的质量分数。(2)若测得某种NH4HCO3的含氮量为18%,判断该物质是否纯净?
(1)NH4NO3中N%=
(2)NH4HCO3中N%=
×100%=17.7%
因为17.7%<18%, 所以该物质不纯净
4、计算物质中某元素的质量
[例题4]: 60千克NH4NO3中含氮元素多少千克?
[例题5]:某化合物的化学式为RO2 ,其中氧元素的质量分数为50%,求R的相对原子质量并确定R为何元素?(用多种解法)
×100% = 60Kg× 35% = 21 Kg
初中化学人教版 (五四制)八年级全册第四单元 自然界的水课题4 化学式与化合价课文内容ppt课件: 这是一份初中化学人教版 (五四制)八年级全册第四单元 自然界的水课题4 化学式与化合价课文内容ppt课件,共17页。PPT课件主要包含了议一议,化学式,再试一试,活动与探究,H2O,SO2,P2O5,Fe2O3,KCl,HgO等内容,欢迎下载使用。
人教版 (五四制)八年级全册课题4 化学式与化合价课文ppt课件: 这是一份人教版 (五四制)八年级全册课题4 化学式与化合价课文ppt课件,共17页。PPT课件主要包含了自主学习,导学提纲,化学式,互助析疑,H2O,CO2,表达意义,例如CO2,表示2个水分子,由原子构成等内容,欢迎下载使用。
初中化学人教版 (五四制)八年级全册课题4 化学式与化合价图片ppt课件: 这是一份初中化学人教版 (五四制)八年级全册课题4 化学式与化合价图片ppt课件,共9页。PPT课件主要包含了什么是化学式,H2O,1表示水这种物质,3表示一个水分子,以“H2O”为例,个水分子,如CO2,宏观意义,二氧化碳,微观意义等内容,欢迎下载使用。













