

鲁科版高中化学必修第一册微专题大素养3课件
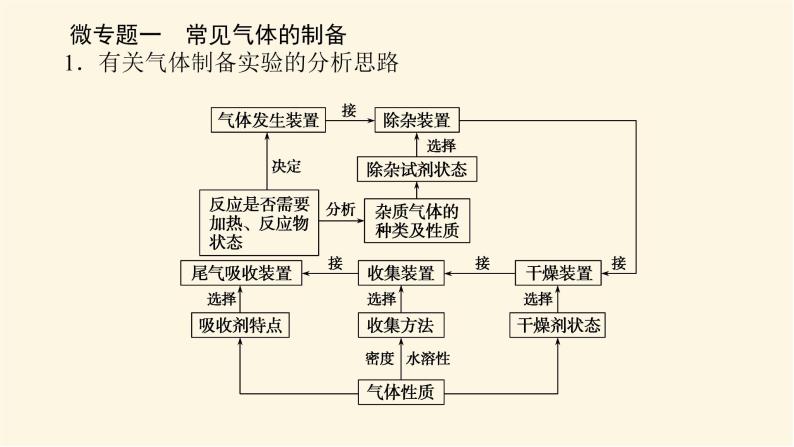
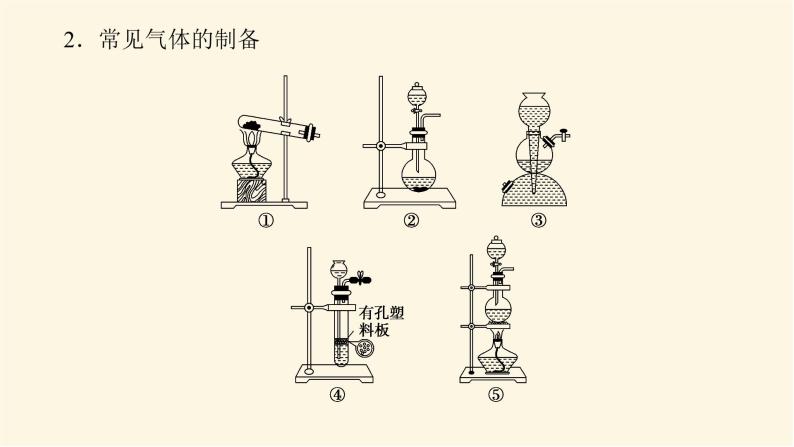
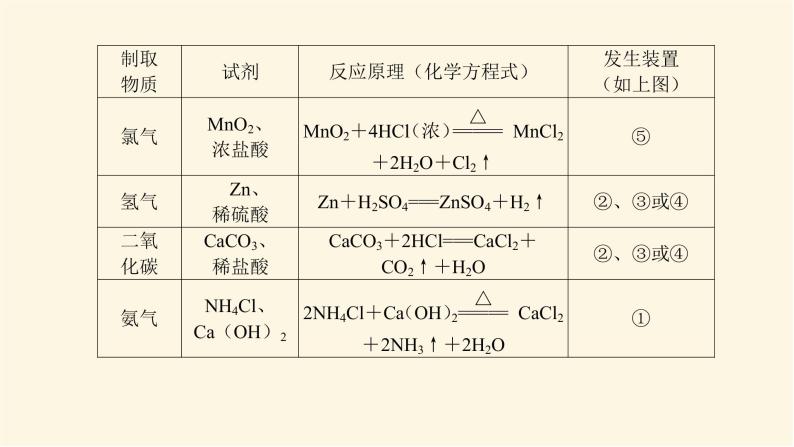
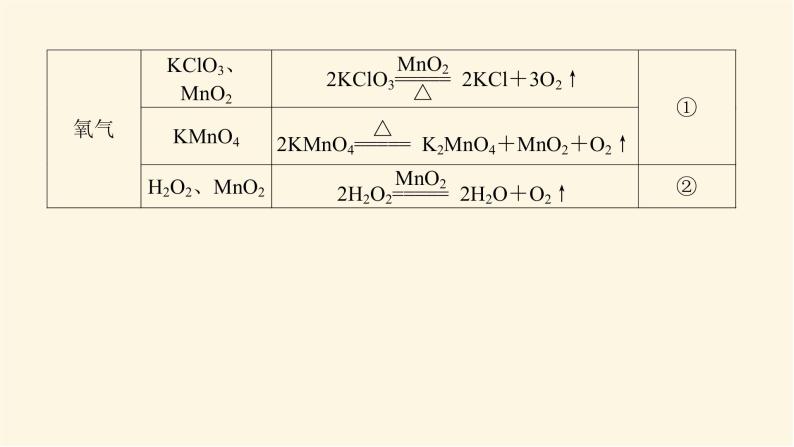
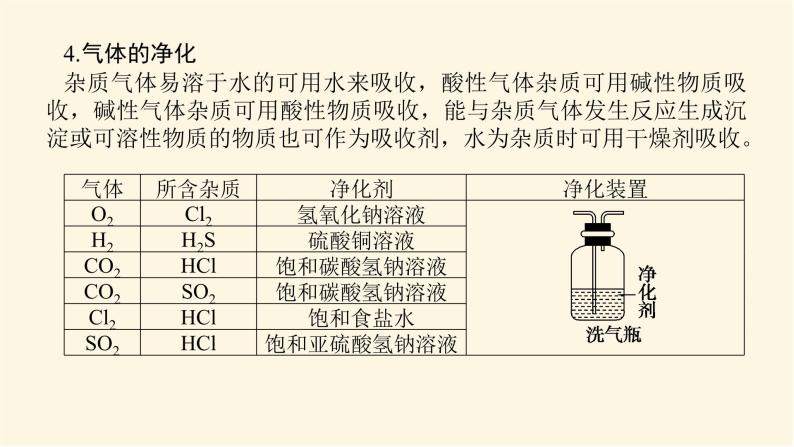
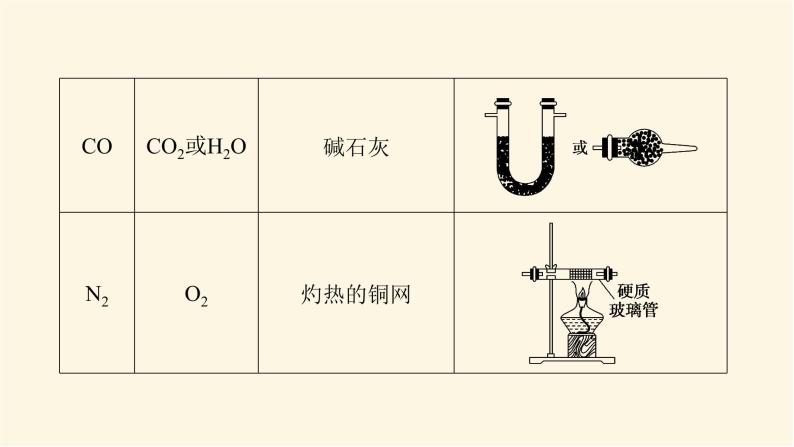
展开微专题·大素养③ 微专题一 常见气体的制备1.有关气体制备实验的分析思路2.常见气体的制备3.气体的干燥4.气体的净化杂质气体易溶于水的可用水来吸收,酸性气体杂质可用碱性物质吸收,碱性气体杂质可用酸性物质吸收,能与杂质气体发生反应生成沉淀或可溶性物质的物质也可作为吸收剂,水为杂质时可用干燥剂吸收。5.气体的收集(1)设计原则:根据气体的溶解性或密度来选择收集装置。(2)收集装置基本类型6.尾气处理装置尾气中若含有易燃、易爆、有毒或有刺激性气味的气体,需增加尾气处理装置,防止气体排入空气中污染环境。常见尾气处理装置如下:注意:对于溶解度很大的气体,吸收时应防止倒吸。常见的防倒吸装置还有如下几种改进装置(以NH3的吸收为例,未注明的液体为水)。[微训练一]1.氨及其化合物在生产、生活中有着重要的作用。题中相关的实验装置如图所示。(1)实验室利用图中的c装置制取氨气的反应方程式为_________________________________________________________。2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O解析:(1)题图所示装置c是固体加热制取气体的装置,可加热固体NH4Cl和Ca(OH)2的混合物来制取氨气,化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。(2)实验室模拟合成氨和氨催化氧化的流程如下所示。已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。①从图中选择制取气体的合适装置(填代号):氮气 、氢气 。②氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。ab干燥气体 控制氢气和氮气的流速解析: (2)①由题给条件可知,制氮气通过“液体(NaNO2溶液)+液体(NH4Cl溶液) ”来制取,故选用a装置;制氢气通过“固体(Zn)+液体(稀硫酸)―→”来制取,故选用b装置。②甲装置盛有浓硫酸,可干燥气体,由于氮气、氢气不溶于浓硫酸,又可起到控制气流速度的作用。③氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (填“会”或“不会”)发生倒吸,原因可能是___________________________________________。④用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,锥形瓶中还可观察到的现象是__________________。⑤写出乙装置中氨氧化的化学方程式: 。不会混合气体中含有大量难溶于水的氮气、氢气氨的氧化反应是一个放热反应有红棕色气体产生4NH3+5O2 4NO+6H2O解析:(2) ③合成氨的反应是可逆反应,反应后的气体含有大量未反应的难溶于水的氮气和氢气,这样会缓解氨极易溶于水导致的气压差,不会倒吸;④氨的催化氧化反应是一个放热反应,可使铂丝保持红热。反应生成的NO又与O2反应生成红棕色气体NO2(2NO+O2===2NO2)。⑤氨的催化氧化反应产物是一氧化氮和水,化学方程式为4NH3+5O2 4NO+6H2O。2.某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。(1)A中发生反应的化学方程式为 。(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:①在装置C、D中能看到的实验现象分别是 、 ;②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为 ;③装置F中球形干燥管的作用是 ;(3)储气瓶b内盛放的试剂是 。MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑溶液由无色变为蓝色溶液先变红后褪色C+2Cl2+2H2O CO2+4HCl防倒吸饱和NaCl溶液解析:(1)MnO2和浓盐酸反应的条件为加热,二氧化锰将HCl氧化为氯气,自身被还原成Mn2+,该反应的化学方程式为MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。(2)①氯气具有强氧化性,将Cl2通入淀粉KI溶液,发生氧化还原反应Cl2+2KI===I2+2KCl,生成的碘单质能够使淀粉溶液变蓝,即C中现象为溶液由无色变为蓝色;将氯气通入到紫色石蕊溶液中,氯气会和水发生反应Cl2+H2O===HCl+HClO,其中HCl会使石蕊溶液变红,但HClO具有强氧化性,使变红的溶液褪色,即D中现象为溶液先变红后褪色。②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,氯气通过碳粉能够生成HCl,说明反应物中有水参与,根据质量守恒和得失电子守恒可得该反应的化学方程式为C+2Cl2+2H2O CO2+4HCl。③氯气能与氢氧化钠发生反应,导致装置内气压减小,在大气压作用下溶液会被吸到导管中,用球形干燥管可防止该现象的发生,故其作用为防倒吸。(3)浓盐酸具有挥发性,刚制得的氯气中混有HCl和水蒸气,饱和食盐水可吸收HCl而难吸收氯气,故用饱和食盐水除去氯气中的HCl。 微专题二 常见气体的检验与除杂1.常见气体的检验2.常见混合气体的除杂方法[微训练二]1.A、B、C、D、E、F、G、H是中学常见的气体,它们均由前18号元素组成,具有如下性质:①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色;②A和H相遇产生白烟;③B和E都能使品红溶液褪色;④将红热的铜丝放入装有B的集气瓶中,集气瓶内充满棕黄色的烟;⑤将点燃的镁条放入装有F的集气瓶中,镁条剧烈燃烧,生成白色粉末,集气瓶内壁附着黑色颗粒;⑥C和D相遇生成红棕色气体;⑦G在足量的D中燃烧可以产生E和H2O。回答下列问题:(1)H的化学式是 ,A的化学式是 ,②中白烟的化学式是 ;(2)④中发生反应的化学方程式是 ;(3)⑤中发生反应的化学方程式是 ;(4)C的化学式是 ,D的化学式是 ;(5)⑦中发生反应的化学方程式是 。NH3HClNH4ClCu+Cl2 CuCl22Mg+CO2 2MgO+CNOO22H2S+3O2 2H2O+2SO2解析:由①确定H为NH3,由②确定A为HCl,由③④确定B为Cl2、E为SO2,由⑤确定F为CO2,由⑥⑦确定D为O2,C为NO,G为H2S。2.已知A、B、C、D、E、G、H、I均为气体,G可使湿润的红色石蕊试纸变蓝,J为常见的液态物质,A、B、C、I、M为单质,且M为常见金属,G和H相遇时产生白烟,它们存在如图所示的转化关系(图中部分反应物或产物已省略),请回答下列问题。(1)请写出A物质的化学式: 。(2)①写出实验室用K制取G的化学方程式:_________________________________________________________。②实验室检验气体G是否收集满的方法:_____________________________________________________________________。③G与H相遇可生成白烟K,请写出该反应的化学方程式: 。N22NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O用湿润的红色石蕊试纸靠近集气瓶口,如果红色石蕊试纸变蓝,则说明气体已收集满NH3+HCl===NH4Cl解析:已知A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,G可使湿润的红色石蕊试纸变蓝,则G为NH3,G和H相遇时产生白烟,则H为HCl,则K为NH4Cl,A和B能反应生成NH3,B和C能反应生成HCl,则C为Cl2,B为H2,A为N2,J为常见的液态物质,则J为H2O,根据转化关系可知,I为O2,D为NO,E为NO2,F为HNO3,Z为NH4NO3,M为常见金属,且M与盐酸反应的产物能与氯气反应,所以M为Fe,X为FeCl2,Y为FeCl3。由以上分析可顺利回答(1)、(2)问。(3)①F的浓溶液与木炭反应的化学方程式为__________________________________________________________。②工业F的浓溶液呈黄色,试用化学方程式解释原因:_________________________________________________________;若要消除黄色可向其中通入一定量的 。C+4HNO3(浓) CO2↑+4NO2↑+2H2O4HNO3(浓) 4NO2↑+O2↑+2H2O氧气解析: (3)②工业浓硝酸溶液呈黄色,是因为浓硝酸分解产生的二氧化氮溶于溶液中,若要消除黄色可向溶液中通入一定量的氧气。 微专题三 物质及反应中的“特殊”与推断1.物质的特殊颜色常见的有颜色的物质如下表。 (2)重要的三角转化关系除此之外,物质之间的转化关系还有:(3)归纳总结 化学推断题解题步骤一般分为四步:(1)读题——仔细读题,审清题意。读题主要是阅读求解要求。求解要求往往能给考生以重要的启示,这点不能忽略。(2)审题——即找准解题的切入点,然后联系信息及所学知识,应用多种思维方式,进行综合分析、推理。“审题”是解题的关键。(3)解答——看清要求,认真解答。“解答”是解题的落脚点。(4)检验——看推理是否符合题意。“检验”是解答正确的保证。拓展:与溶液(或水)反应产生气体的物质(1)与碱反应产生气体的化合物有铵盐,产生的气体是NH3。(2)与水反应产生气体的物质有Na、Na2O2等。(3)既能跟酸反应又能跟碱反应且生成气体的化合物有NH4HCO3、(NH4)2CO3、NH4HSO3、(NH4)2SO3、(NH4)2S、NH4HS等。[微训练三]1.A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,A是一种强碱,C为厨房中的用品,在一定条件下相互转化关系如图所示(部分反应中的水已略去)。下列有关B、C的说法正确的是( )A.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液B.分别取等质量的B、C两种固体与等体积等浓度盐酸反应,产生气体的速率一样C.取a g B、C的混合物充分加热,固体质量减重b g,由此可计算出混合物中B的质量分数D.取a g B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b g,由此可计算出混合物中B的质量分数答案:C解析:A、B、C均含有同一种元素,A是一种强碱,C为厨房中的用品,由转化关系可推知A为NaOH,D为CO2,C为NaHCO3,B为Na2CO3。A错,Ba(OH)2稀溶液与NaHCO3、Na2CO3均反应生成BaCO3白色沉淀,不能鉴别二者。B错,NaHCO3与盐酸反应比Na2CO3与盐酸反应的速率更快。C对,取a g Na2CO3、NaHCO3的混合物充分加热,固体质量减重b g,则b g为NaHCO3分解生成的CO2和H2O的质量和,结合化学方程式可计算出混合物中NaHCO3的质量,进而计算Na2CO3的质量分数。D错,取a g Na2CO3、NaHCO3的混合物与足量稀硫酸充分反应,碱石灰增重的b g为生成的CO2和逸出的水蒸气的质量和,不能计算出混合物中Na2CO3的质量分数。2.A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如图所示的转化关系。由此推断:(1)甲的化学式为 ,丙的化学式为 。(2)写出甲和D反应的化学方程式 。(3)为检验化合物甲中元素的化合价,需要用到的药品有 (填字母代号)。 a.稀硫酸 b.盐酸 c.硫氰酸钾溶液 d.高锰酸钾溶液Fe3O4Al2O33Fe3O4+8Al 9Fe+4Al2O3acd解析:A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价,则A是Fe,乙是H2O,甲是Fe3O4,B是O2,C是H2,D是Al,丙是Al2O3。(1)甲的化学式为Fe3O4,丙的化学式为Al2O3。(2)甲和D在高温条件下发生铝热反应,产生Al2O3和Fe,反应的化学方程式是3Fe3O4+8Al 9Fe+4Al2O3。(3)化合物甲是Fe3O4,要检验其中所含有的阳离子,要先用非氧化性的酸使其发生反应Fe3O4+8H+===2Fe3++Fe2++4H2O,然后再用KMnO4溶液检验Fe2+;用KSCN溶液检验Fe3+,故使用的物质是a、c、d。(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:化合物甲的质量分数为 。80.6%
人教版高中化学必修第一册微专题大素养章末导学案+课件: 这是一份人教版高中化学必修第一册微专题大素养章末导学案+课件,文件包含微专题•大素养④章末共享pptx、微专题•大素养②章末共享pptx、微专题•大素养①章末共享pptx、微专题•大素养③章末共享pptx、微专题•大素养②章末共享DOCX、微专题•大素养③章末共享DOCX、微专题•大素养④章末共享DOCX、微专题•大素养①章末共享docx等8份课件配套教学资源,其中PPT共136页, 欢迎下载使用。
鲁科版高中化学必修第一册微专题大素养2课件: 这是一份鲁科版高中化学必修第一册微专题大素养2课件,共33页。
鲁科版高中化学必修第一册微专题大素养①课件: 这是一份鲁科版高中化学必修第一册微专题大素养①课件,共30页。













