
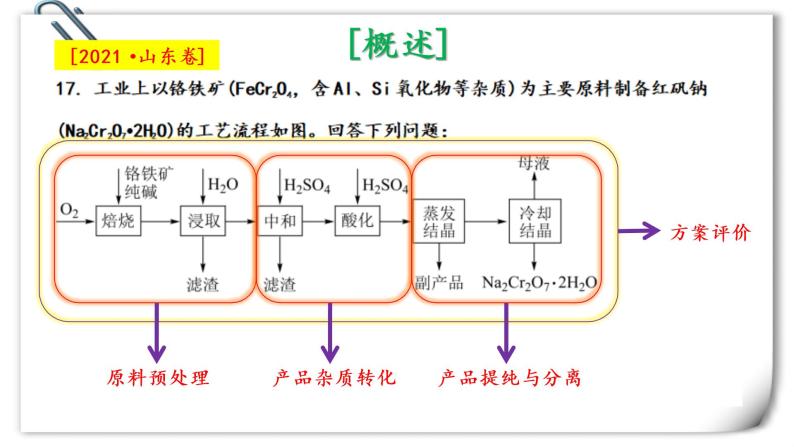


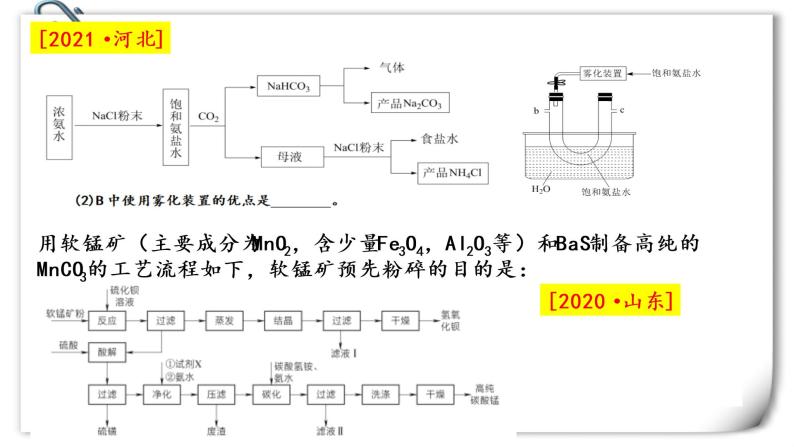
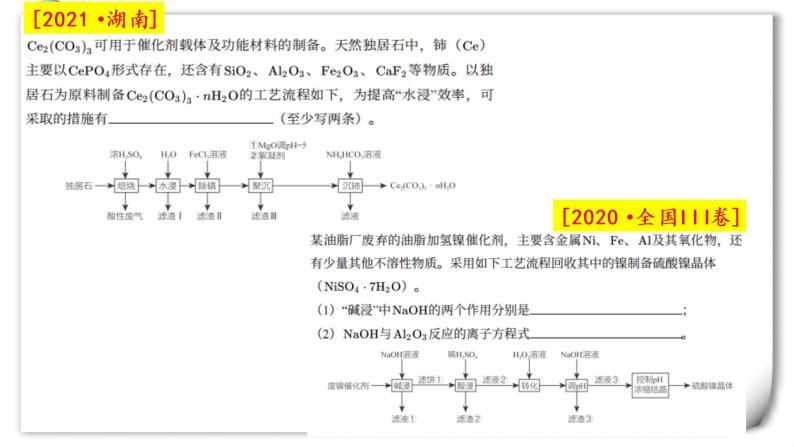
2022届高三化学二轮复习之工业流程 课件
展开Part1:原料预处理
模板是核心,需要自行变通
二、烧(灼烧,焙烧,煅烧):高温下发生化学反应,使一些物质在高温下氧化分解题型一:烧的成分分析1.MCO3→MO+CO2↑;2.M(OH)2→MO+H2O;3.MS+O2→MO+SO2;4.多变价元素产物:FeS+O2→XXX+SO2(题干)例:2018年国II:闪锌矿(ZnS,含SiO2,少量FeS,CdS,PdS等杂质),煅烧过程中主要发生的化学方程式:[题干]烧的目的?(找有机物,硫化物,碳酸盐,变价金属)[模板]①除去有机物,S元素;②将XX转化(氧化)为XX。
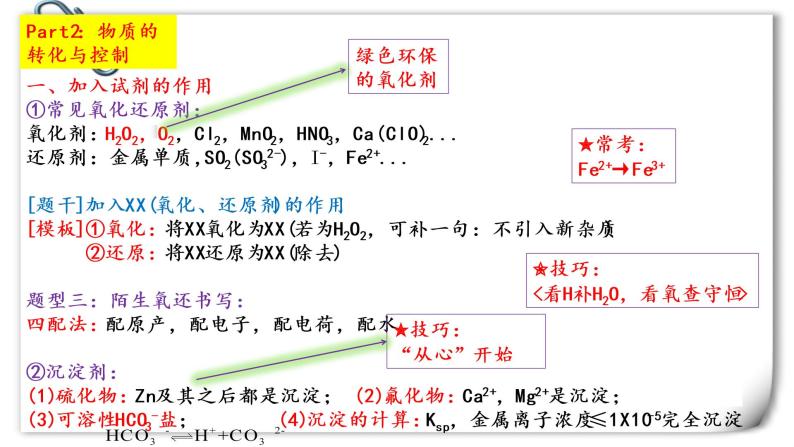
Part2:物质的转化与控制
一、加入试剂的作用①常见氧化还原剂:氧化剂:H2O2,O2,Cl2,MnO2,HNO3,Ca(ClO)2...还原剂:金属单质,SO2(SO32-),I-,Fe2+...[题干]加入XX(氧化、还原剂)的作用[模板]①氧化:将XX氧化为XX(若为H2O2,可补一句:不引入新杂质) ②还原:将XX还原为XX(除去)题型三:陌生氧还书写:四配法:配原产,配电子,配电荷,配水②沉淀剂:(1)硫化物:Zn及其之后都是沉淀; (2)氟化物:Ca2+,Mg2+是沉淀; (3)可溶性HCO3-盐; (4)沉淀的计算:Ksp,金属离子浓度≤1X10-5完全沉淀
✮常考: Fe2+→Fe3+
✬技巧:<看H补H2O,看氧查守恒>
✮技巧: “从心”开始
关于可溶性碳酸氢盐的方程式:
(2020·山东)写出加入氨水、NH4HCO3沉Mn2+的离子方程式:
(2019·新课标III)写出加入NH4HCO3沉Mn2+的离子方程式:
(2020·江苏)写出加入氨水、NH4HCO3沉Fe2+的离子方程式:
(2021·湖南)写出加入NH4HCO3沉Ce2(SO4)3·nH2O的离子方程式:
二、控制与转化:核心:平衡+速率,影响因素:浓温压催,固表面1.速率和转化率:[题干]加压的目的?[模板]增大XX的浓度,加快反应速率[题干]加快浸出率/反应速率/转化速率的措施[模板]①适当提高温度;②适当增大XX浓度/压强;③充分搅拌;④将XX粉碎、研磨(浆,泥,粉不答);⑤适当延长浸出(反应)时间;⑥减小矿粉的粒径2.与温度相关:思路:物质性质+速率因素+平衡因素(△H)
[题干]加热的原因/目的?[模板]①加快反应速率(标志:浸出/浸取);②促进XX水解,有利于生成XX沉淀/胶体[题干]控制温度在X℃~X℃的原因;控制温度在X℃的原因;温度不能过高/过低的原因[模板]①温度过低:反应速率太慢;溶解不完全;难以促进水解(三保)②温度过高:(三防)a.XX易分解(H2O2,NH4+,NH3·H2O,HNO3,HCO3-); b.XX易挥发(HCl,NH3·H2O,HNO3,易挥发有机物); c.XX易水解(Fe3+,Al3+,Ti4+/TiO2+);d.XX易升华(I2)3.与pH有关:题型四:沉淀除杂pH范围的选择前车头~后车尾(杂质完全沉淀pH~目标开始沉淀pH)题型五:调节pH试剂的选择①pH↑:加入消耗氢离子的物质:优选:M,MO,MCO3,M(OH)2,M2(OH)2CO3;其它:NH3·H2O,NaOH...②pH↓:加入消耗氢氧根离子的物质:酸,NH4+...
✮常考:先Fe2+→Fe3+,再调pH
[题干]控制pH在X~Y的原因;控制pH在X的原因;pH不能过高/低的原因[模板]①将XX转化为YY(除去/析出);②防止XX沉淀/溶解核心:三大平衡:弱质平衡,沉淀溶解平衡,重铬酸根的平衡[题干]调节pH物质作用[模板]调节溶液pH(至XX<数值>)(①将XX转化为YY(除去/析出);②防止XX沉淀/溶解)[题干]pH偏小沉淀不完全原因[模板]H+与B-结合HB,B的浓度下降,平衡向沉淀溶解方向移动,使(抄结果)例:2019国III“除杂2”的目的是生成MgF2沉淀除去Mg2+,若溶液酸度过高,Mg2+沉淀不完全,原因是?题型六:沉淀pH的计算:①表达式;②找未知;③算数值
一、结晶1.让溶剂变少→蒸发; 2.让溶解度变低→冷却(针对温度降低,溶解度降低的物质);3.物质本身的性质/需求(有无结晶水)/纯度。题型七:溶液中获得晶体的办法:“陡冷平热”(针对溶解度曲线)①溶解度随温度变化较小:蒸发结晶;②溶解度随温度变化较大:蒸,冷,过,洗,干③带结晶水,易水解,易受热分解,易氧化的晶体:同②的处理方法题型八:脱结晶水操作and原因解释M·XH2O→M[题干]由M晶体制备无水M晶体的操作[模板]将XX晶体在HCl气流中加热脱水[题干]脱结晶水过程中通入HCl气流的原因[模板]防止晶体在脱水过程中发生水解
Part3:产品的分离与提纯
[题干]粗产品,想要获得纯度更高的产品,需要进行的操作?[模板]重结晶(一种自然冷却)拓:大晶体→自然冷却;碎晶→快速冷却
二、过滤1.考法:固液分离;[题干]趁热过滤的原因[模板]防止因温度过低,XX物质析出/溶解[题干]多种溶质混合,控制分离XX晶体的操作?[模板]找差异,一般找溶解度差异最大的温度2.抽滤(减压过滤)<新仪器:布氏漏斗,抽滤瓶>[题干]抽滤的优点[模板]可加速过滤,得到较干燥的沉淀
三、洗涤与干燥洗涤剂原则:①杂质在洗涤剂中溶解度较大;②尽量减少目标的损失[题干]冰水洗涤的原因?[模板]①除去晶体表面杂质;②降低溶解度,防止晶体损耗[题干]乙醇洗涤的原因?[模板]①除去晶体表面杂质;②降低溶解度,防止晶体损耗;③可以快速带走晶体表面的水[题干]检验XX沉淀是否洗涤干净?[模板]取(最后一次洗涤液),加,若,则;反之则[题干]低温/减压干燥的目的?[模板]降低烘干温度,防止XX分解/失去结晶水/防止被氧化
[2019·全国I卷]
[2019·全国III卷]
Part4:方案评价与数据处理
方案评价:安全/高产/无污染,省时/省力/又省钱(多,快,好,省)循环物质:考法:①循环物质是哪个?②循环至哪个单元?(看进,看出)[题干]循环利用的作用/意义<投入量少,回报最多>[模板]①减少产品损失,提高产率(产品角度) ②提高原料利用率,降低成本/减少污染(原料角度)数据处理:①产率,②纯度,③结晶水个数计算,④滴定计算...[题干]滴定终点颜色变化[模板]当最后一滴标准液滴入锥形瓶时,溶液由XX色变成XX色,且半分钟内不恢复原色
[2018·全国III卷]
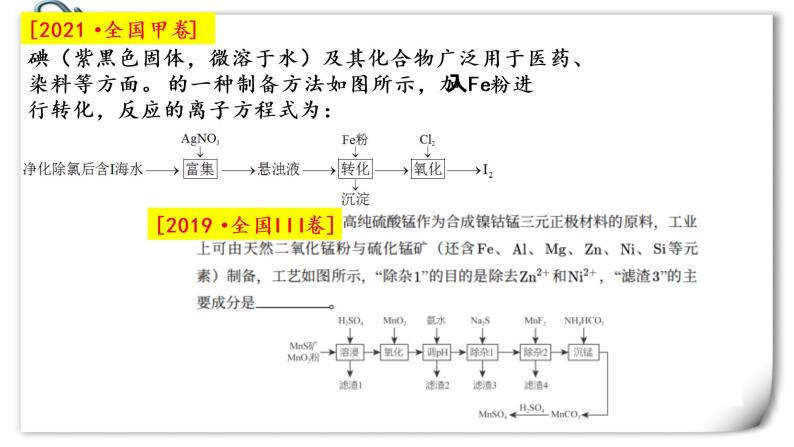
[2021·全国甲卷]
[2021·全国乙卷]
2024届高三化学二轮复习 专题十一 化学工艺流程 课件: 这是一份2024届高三化学二轮复习 专题十一 化学工艺流程 课件,共60页。PPT课件主要包含了Na2CrO4,Fe2O3,AlOH3,分子晶体,CH4,MgOH2,蒸发浓缩,趁热过滤,不稳定,Fe2+等内容,欢迎下载使用。
2024届高三化学工业流程图专题讲座课件: 这是一份2024届高三化学工业流程图专题讲座课件,共49页。PPT课件主要包含了整体意识,两种意识,局部意识,定位意识,原料的预处理措施,反馈练习,萃取分液,产率纯度的计算,产率问题等内容,欢迎下载使用。
2023届高三化学二轮复习 化学工艺流程逐空突破课件: 这是一份2023届高三化学二轮复习 化学工艺流程逐空突破课件,共60页。PPT课件主要包含了高考回眸,或增大硫酸的浓度,+MnO2↓+5H+,Fe2+,作还原剂,Na+,7≤pH<62,0×10-4,加热搅拌可,冷却结晶等内容,欢迎下载使用。












