

2022届安徽省池州市第一中学高三下学期4月联考理综化学试题含解析
展开2022届安徽省池州市第一中学高三下学期4月联考
理综化学试题
一、单选题
1.用化学用语表示2H2S+3O22SO2+2H2O中的相关微粒,其中正确的是
A.H2O的比例模型为 B.N2的电子式
C.中子数为18的硫原子为34S D.S2-的结构示意图为
2.联二没食子酸内酯(EA)是一种芳香类化合物,可用于制抗乙肝药物,其球棍模型如图。下列关于EA的说法正确的是
A.分子中有6个氧原子 B.含有2种官能团
C.不能与H2发生加成反应 D.能与NaHCO3溶液反应生成CO2
3.设NA表示阿伏加德罗常数的值。下列说法正确的是
A.1molNa和足量O2反应,生成Na2O和Na2O2的混合物,转移电子数为2NA
B.46gNO2和N2O4的混合气体中所含原子数大于3NA
C.1molH2O最多可以形成的氢键数为2NA
D.1mol·L-1的氢氧化钠溶液含有的阴离子数为NA
4.下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加少量NaOH溶液:+OH-=NH3·H2O
B.向漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=+HClO
C.向CaSO4沉淀中滴加饱和Na2CO3溶液:Ca2++=CaCO3↓
D.H2S气体通入到CuSO4溶液中:H2S+Cu2+=CuS↓+2H+
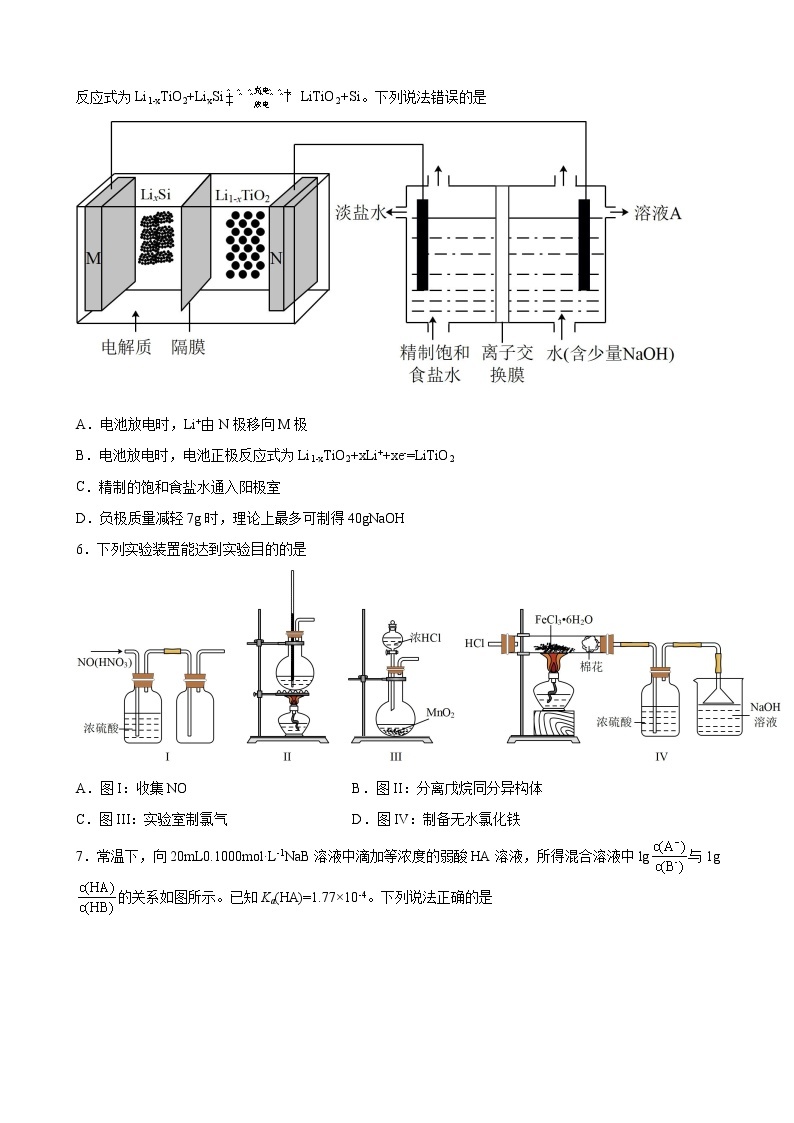
5.我国科学家最近研发出一种新型纳米硅锂电池,可反复充电3万次,电池容量只衰减了不到10%。电池反应式为Li1-xTiO2+LixSiLiTiO2+Si。下列说法错误的是
A.电池放电时,Li+由N极移向M极
B.电池放电时,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2
C.精制的饱和食盐水通入阳极室
D.负极质量减轻7g时,理论上最多可制得40gNaOH
6.下列实验装置能达到实验目的的是
A.图I:收集NO B.图II:分离戊烷同分异构体
C.图III:实验室制氯气 D.图IV:制备无水氯化铁
7.常温下,向20mL0.1000mol·L-1NaB溶液中滴加等浓度的弱酸HA溶液,所得混合溶液中lg与1g的关系如图所示。已知Ka(HA)=1.77×10-4。下列说法正确的是
A.Ka(HB)>Ka(HA)
B.pH=4时,的值比pH=3的大
C.滴入20mLHA溶液后存在关系:c(A-)>c(HB)
D.pH=7时,混合溶液中一定存在关系:c(Na+)=c(B-)
二、工业流程题
8.利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质,Co3O4具有较强氧化性)制备CoO的工艺流程如图所示。
已知:I.不同浸出剂“酸溶”结果
浸出剂
浸出液化学成分/(g·L-1)
钴浸出率/%
Co
Al
HCl
80.84
5.68
98.4
H2SO4+Na2S2O3
84.91
5.96
98.0
II.Al3+在pH为5.2时沉淀完全。
III.LiF的Ksp为1.8×10-3。
回答下列问题:
(1)“碱溶”时为提高浸出率可采取的措施是_______(写出一种即可),并写出主要的离子方程式:_______。
(2)“酸溶”时最佳的浸出剂应该选择_______,并说明理由:_______。
(3)“净化”时,加NaF目的是将Li+转化为沉淀,当滤液③中c(F-)=4.0×10-3mol·L-1时计算“净化”后残余c(Li+)=_______mol·L-1。
(4)写出滤渣②“酸溶”后与草酸铵反应的离子方程式_______。
三、实验题
9.有多种检验方法,某实验小组欲探究KSCN检验法在不同反应体系的实验条件,进行了如下实验研究(已知CuSCN为白色沉淀)。
实验一:单一溶液检验
(1)配制100 mL溶液,除了烧杯、量筒,还需用到的玻璃仪器有___________。
(2)向溶液中滴加1滴溶液,无明显现象,通入,仍无明显变化。
①该实验的目的是___________;
②用离子方程式表示II中出现浅红色的原因:___________、___________。
(3)对II中溶液为浅红色的原因,甲同学提出以下假设。
①假设1:加入氯水的量少,生成的浓度低
②假设2:氯水氧化性强,将部分氧化为
继续以下实验:
i.取I中浅红色溶液,___________(填写实验操作,下同),溶液浅红色消失,从而排除了假设1;
ii.向2mL水中滴加1滴KSCN溶液,___________,产生白色沉淀,证明假设2正确。
实验二:KSCN法检测、混合液中的
(4)溶液上层产生的白色沉淀为___________;请用平衡移动原理解释上述实验现象:___________。
四、原理综合题
10.已知:4HBr(g)+O2(g)⇌2H2O(g)+2Br2(g)ΔH。v正=k正ca(HBr)·cb(O2),v逆=k逆cc<(H2O)·cd(Br2)(v正为正反应速率,v逆为逆反应速率,k正为正反应速率常数,k逆是逆反应速率常数,只与温度和催化剂有关,与浓度和接触面积无关;a、b、c、d是反应级数,可取整数和分数)。
(1)已知几种共价键键能数据如下所示:
共价键
H-Br
O=O
H-O
Br-Br
键能(kJ·mol-1)
363
498
467
193
上述反应中,ΔH=_______kJ·mol-1。
(2)下列关于k正和k逆的说法正确的是_______(填字母)。A.增大压强,k正增大,k逆减小 B.升高温度,k正和k逆都增大
C.加入催化剂,k正和k逆都增大 D.增大接触面积,k正和k逆都减小
(3)为了测定反应级数,设计实验,测定结果如表所示:
实验序号
c(HBr)/mol·L-1
c(O2)/mol·L-1
正反应速率
1
0.1
0.1
v
2
0.1
0.2
2v
3
0.2
0.4
8v
4
0.4
x
32v
①x=_______,a=_______,b=_______。
②有人提出如下反应历程:
(I)HBr+O2→HO-OBr(慢反应)
(II)HO-OBr+HBr→H2O+BrOBr(较快反应)
(III)BrOBr+HBr→BrOH+Br2(快反应)
(IV)BrOH+HBr→Br2+H2O(快反应)
活化能最大的反应是_______(填代号)。
(4)在密闭容器中充入HBr和O2,发生上述反应,在相同时间里,测得HBr的转化率与温度、压强的关系如图。随着温度升高,三种不同压强下HBr的转化率趋向相等,其原因是_______。
(5)在一定温度下,向恒容密闭容器中充入4molHBr(g)和1molO2(g),测得起始的压强为10akPa,发生上述反应达到平衡时气体压强为起始压强的。该温度下,平衡常数Kp=_______(kPa)-1(用含a的代数式表示)。
(6)常温下,如果将上述反应设计成酸性燃料电池,负极反应式为_______。
五、结构与性质
11.我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:
(1)基态碳原子的核外电子排布图为_______。
(2)原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为_______。
(3)结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:_______。
CO
C-O
C=O
CO
键能/kJ·mol-1
357.7
798.9
1071.9
N2
N-N
N=N
N≡N
键能/kJ·mol-1
154.8
418.4
941.7
(4)CO2分子的空间构型为_______,与CO2互为等电子体,写出的结构式_______。
(5)一种新型Na-Fe3O4/HZSM-5多功能复合催化剂成功实现了CO2直接加氢制取高辛烷值汽油。该催化剂成分Fe3O4的晶胞如图所示。
①晶胞中Fe3+处于O2-围成的_______空隙(填“正四面体”“正八面体”或“正十六面体”)。
②若晶胞体对角线为anm,阿伏加德罗常数为NA,晶体的密度为_______g·cm-3(写出表达式)。
六、有机推断题
12.氯法齐明是一种抗麻风药物,可通过以下路线合成。
已知:
回答下列问题:
(1)A的名称_______,C所含的含氧官能团名称是_______。
(2)反应⑤的反应类型为_______,I的结构简式为_______。
(3)反应④的化学方程式_______。
(4)化合物M是B的芳香同分异构体,已知M和B具有相同的官能团,则M的可能结构有_______。种,其中核磁共振氢谱有2组峰,峰面积比为2:1的结构式为_______(任写一种)。
(5)请仿照题中合成流程图,设计以和乙烯为起始主要原料合成的路线(其他无机试剂任选)_______。
参考答案:
1.C
【解析】
【详解】
A.H2O的比例模型中,位于中间的氧原子的半径比位于旁边的氢原子大,A错误;
B.N2的电子式为NN,B错误;
C.硫原子的质子数为16,中子数为18,因此质量数为16+18=34,原子可表示为34S ,C正确;
D.S2-的结构示意图中核电荷数为16,D错误;
答案选C。
2.B
【解析】
【详解】
A. 分子中含有C、H、O原子个数依次是14、6、8,分子式为C14H6O8,故A错误;
B. 根据图知,该分子中含有酚羟基、酯基两种官能团,故B正确;
C. 分子中含有苯环,能与H2发生加成反应,故C错误;
D. 分子中不含-COOH,所以不能和NaHCO3溶液反应,故D错误;
故选B。
3.C
【解析】
【详解】
A. 钠由0价升高为+1价,1molNa和足量O2反应,生成Na2O和Na2O2的混合物,转移电子数为1NA,故A错误;
B. 46gN2O4所含原子数等于3NA,46gNO2和N2O4的混合气体中所含原子数等于3NA,故B错误;
C. 1个水分子可以和4个水分子形成氢键,每个氢键2个水分子共用,平均每个水分子拥有2个氢键,1molH2O最多可以形成的氢键数为2NA,故C正确;
D. 缺少溶液的体积,无法计算1mol·L-1的氢氧化钠溶液含有的阴离子数,故D错误;
故选C。
4.D
【解析】
【详解】
A. 向NH4HSO4溶液中滴加少量NaOH溶液,先与氢离子反应:H++OH-=H2O,故A错误;
B. 向漂白粉溶液中通入过量的SO2,反应生成硫酸钙沉淀、硫酸、氯化氢,正确的离子方程式为:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+SO+4H++2Cl-,故B错误;
C. 向CaSO4沉淀中滴加饱和Na2CO3溶液,转化成更难溶的碳酸钙沉淀:CaSO4+=CaCO3↓+SO,故C错误;
D. H2S气体通入到CuSO4溶液中生成难溶物质硫化铜:H2S+Cu2+=CuS↓+2H+,故D正确;
故选D。
5.A
【解析】
【分析】
电池反应式为Li1-xTiO2+LixSiLiTiO2+Si,M极为负极,电极反应式为LixSi-xe-=xLi++Si,N极为正极,电极反应式Li1-xTiO2+xLi++xe-=LiTiO2,电解池中,左侧为阳极,电极反应式为2Cl--2e-=Cl2↑,右侧电极为2H2O+2e-=H2↑+2OH-。
【详解】
A. 电池放电时,阳离子向正极N移动,故A错误;
B. 电池放电时,N极为正极,电池正极反应式为Li1-xTiO2+xLi++xe-=LiTiO2,故B正确;
C. 电解池中左侧电极为阳极,电极反应式为2Cl--2e-=Cl2↑,故阳极室通入精制的饱和食盐水,故C正确;
D. 负极质量减轻7g时,转移电子×1=1mol,电解池中转移1mol电子生成1molNaOH,即生成1mol×40g/mol=40g,故D正确;
故选:A。
6.D
【解析】
【详解】
A.NO可以与空气中的氧气反应,不能用排空气法收集NO,选项A错误;
B.蒸馏需要组分沸点之间相差30C以上,图中的装置错误,应该用蒸馏烧瓶,温度计的水银球应该是与蒸馏烧瓶的支管口平齐,选项B错误;
C.MnO2与浓盐酸反应需要加热,选项C错误;
D.通入HCl气体是为了防止Fe3+水解,倒置的漏斗是为了防止倒吸,选项D正确;
答案选D。
7.C
【解析】
【分析】
滴加过程NaB转化为HB,发生的反应为B-+HA⇌A-+HB,当lg=-1时,lg=0,即此时10c(HA)=c(HB)、c(A-)=c(B-),求出Ka(HB),根据电荷守恒可知溶液中c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-), pH=7时,c(H+)=c(OH-),求出溶液中离子浓度的关系。
【详解】
A. 当lg=-1时,lg=0,即此时10c(HA)=c(HB)、c(A-)=c(B-),所以Ka(HB)==1.77×10-5,Ka(HB)
C. 滴入20mLHA时二者恰好反应HB和NaA,A-的水解常数为Kh=
D.根据电荷守恒可知溶液中c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-), pH=7时,c(H+)=c(OH-),混合溶液中一定存在关系:c(Na+)=c(A-)+c(B-),c(Na+)=c(B-)不成立,故D错误;
故选C。
8.(1) 搅拌(加热或增大NaOH溶液的浓度等合理答案也可) 2Al+2OH-+2H2O=2+3H2↑
(2) H2SO4+Na2S2O3 两种浸出剂对钴的浸出率差别不大,但是HCl与Co3O4会发生反应产生Cl2,污染环境
(3)0.45
(4)Co2+++2H2O=CoC2O4·2H2O↓
【解析】
【分析】
废料用碱液溶解,过滤得到滤液①偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到较纯净的含有钴离子的溶液,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,加NaF除去钙离子,滤渣2为氟化锂,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,过滤得滤渣为碳酸钴沉淀,加盐酸溶解,再加草酸铵,过滤得CoC2O4•2H2O,灼烧钴得到氧化钴。
(1)
铝锂钴废料含有少量铝箔,能溶于NaOH溶液,生成可溶于水的偏铝酸钠,再过滤即可除去废料中的Al,“碱溶”时为提高浸出率可采取的措施是搅拌(加热或增大NaOH溶液的浓度等合理答案也可)(写出一种即可),并写出主要的离子方程式:2Al+2OH-+2H2O=2+3H2↑。故答案为:搅拌(加热或增大NaOH溶液的浓度等合理答案也可);2Al+2OH-+2H2O=2+3H2↑;
(2)
根据表中不同浸出剂“酸溶”实验结果可知,使用HCl或H2SO4+Na2S2O3时浸出液化学成分中Co的含量高、钴浸出率也较高,但因Co3O4有较强氧化性,在酸性条件下氧化S2O生成SO,而氧化溶液里的Cl-时,生成的氯气对环境有污染,“酸溶”时最佳的浸出剂应该选择H2SO4+Na2S2O3,理由:两种浸出剂对钴的浸出率差别不大,但是HCl与Co3O4会发生反应产生Cl2,污染环境。故答案为:H2SO4+Na2S2O3;两种浸出剂对钴的浸出率差别不大,但是HCl与Co3O4会发生反应产生Cl2,污染环境;
(3)
“净化”时,加NaF目的是将Li+转化为沉淀,当滤液③中c(F-)=4.0×10-3mol·L-1时,由KspLiF=c(F-)×(Li+)=1.8×10-3,可知c(Li+)=mol•L-1=0.45mol•L-1,净化”后残余c(Li+)=0.45mol·L-1。故答案为:0.45;
(4)
滤渣2为氟化锂,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,过滤得滤渣为碳酸钴沉淀,加盐酸溶解,再加草酸铵,过滤得CoC2O4•2H2O,滤渣②“酸溶”后与草酸铵反应的离子方程式Co2+++2H2O=CoC2O4·2H2O↓,故答案为:Co2+++2H2O=CoC2O4·2H2O↓。
9.(1)100mL容量瓶、玻璃棒、胶头滴管
(2) 排除在此条件下氧气氧化的可能性
(3) 继续滴加饱和氯水 滴加1滴饱和氯水,加入稀盐酸和氯化钡溶液
(4) ,部分与反应生成,促使平衡正向移动,增多,与反应生成红色
【解析】
(1)
配制100 mL溶液,除了烧杯、量筒,还需用到的玻璃仪器有100mL容量瓶、玻璃棒、胶头滴管。故答案为:100mL容量瓶、玻璃棒、胶头滴管;
(2)
向溶液中滴加1滴溶液,无明显现象,通入,仍无明显变化,说明该条件下O2不能将Fe2+氧化。
①该实验的目的是排除在此条件下氧气氧化的可能性;故答案为:排除在此条件下氧气氧化的可能性;
②Ⅱ中出现浅红色的原因是Fe2+与氯水中的Cl2反应生成Fe3+,Fe3+与KSCN反应生成红色物质Fe(SCN)3,用离子方程式表示II中出现浅红色的原因:、。故答案为:;;
(3)
i.假设1:加入氯水的量少,生成的Fe3+浓度低;取I中浅红色溶液,继续滴加饱和氯水(填写实验操作,下同),溶液浅红色消失,从而排除了假设1;故答案为:继续滴加饱和氯水;
ii.假设2:氯水氧化性强,将部分SCN-氧化为;证明的存在即可,向2mL水中滴加1滴KSCN溶液,滴加1滴饱和氯水,加入稀盐酸和氯化钡溶液,产生白色沉淀,证明假设2正确。故答案为:滴加1滴饱和氯水,加入稀盐酸和氯化钡溶液;
(4)
实验二:KSCN法检测、混合液中的:加入CuSO4溶液后,上层局部有少量Fe2+被氧化成Fe3+,Fe3+与KSCN反应生成红色物质Fe(SCN)3;由题意的信息可知,白色沉淀可能为CuSCN,是因为Cu2++4SCN-=2CuSCN↓+(SCN)2而生成白色沉淀CuSCN,(SCN)2把溶液中的Fe2+氧化为Fe3+,自身被还原成SCN-,使溶液中Fe3+与SCN-反应的平衡正向移动,红色物质Fe(SCN)3浓度逐渐增大,溶液全部变为红色,用平衡移动原理解释上述实验现象:,部分与反应生成,促使平衡正向移动,增多,与反应生成红色,故答案为:;,部分与反应生成,促使平衡正向移动,增多,与反应生成红色。
10.(1)-304
(2)BC
(3) 0.8 1 1 I
(4)随着温度升高,压强对平衡的影响逐渐减弱
(5)
(6)2Br--2e-=Br2
【解析】
(1)
反应4HBr(g)+O2(g)⇌2H2O(g)+2Br2(g)中,ΔH=363kJ/mol×4+498kJ/mol-(467kJ/mol×4+193kJ/mol×2)=-304kJ·mol-1。故答案为:-304;
(2)
A. k正为正反应速率常数,k逆是逆反应速率常数,只与温度和催化剂有关,增大压强k正、k逆均不变,故A错误;B. 升高温度,正逆反应速率均增大,k正和k逆都增大,故B正确;C. 加入催化剂,正逆反应速率均增大,k正和k逆都增大,故C正确;D. k正为正反应速率常数,k逆是逆反应速率常数,只与温度和催化剂有关,增大接触面积,k正和k逆都不变,故答案为:BC;
(3)
①结合实验1、2,v正=k正ca(HBr)·cb(O2),b=1,再对比实验1和3,得a=1,结合实验3、4,得x=0.8,a=1,b=1。故答案为:0.8;1;1;
②决定反应O2(g)+4HBr(g)⇌2Br2(g)+2H2O(g)速率快慢的基元反应是反应Ⅰ,反应Ⅰ的活化能最大,活化能最大的反应是I(填代号)。故答案为:I;
(4)
根据HBr的转化率与温度、压强的关系图,随着温度升高,三种不同压强下HBr的转化率趋向相等,其原因是随着温度升高,压强对平衡的影响逐渐减弱。故答案为:随着温度升高,压强对平衡的影响逐渐减弱;
(5)
在一定温度下,向恒容密闭容器中充入4molHBr(g)和1molO2(g), ,测得起始的压强为10akPa,发生上述反应达到平衡时气体压强为起始压强的, ,x=0.5。该温度下,平衡常数Kp= == (kPa)-1(用含a的代数式表示)。故答案为:;
(6)
常温下,如果将上述反应设计成酸性燃料电池,负极溴离子放电,失电子发生氧化反应生成溴单质,反应式为2Br--2e-=Br2,故答案为:2Br--2e-=Br2。
11.(1)
(2)+1或-1
(3)断开CO分子的第一个化学键所需要的能量(1071.9kJ/mol-798.9kJ/mol=273.0kJ/mol)比断开N2分子的第一个化学键所需的能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小,可知CO相对活泼
(4) 直线形 [O=N=O]+
(5) 正八面体
【解析】
(1)
碳是6号元素,基态碳原子的核外电子排布图为 。故答案为:;
(2)
对于基态碳原子,有两个末成对电子,其价电子自旋量子数的代数和为±(2×)=+1或-1。故答案为:+1或-1;
(3)
CO和N2相对活泼性并说明原因:断开CO分子的第一个化学键所需要的能量(1071.9kJ/mol-798.9kJ/mol=273.0kJ/mol)比断开N2分子的第一个化学键所需的能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小,可知CO相对活泼。故答案为:断开CO分子的第一个化学键所需要的能量(1071.9kJ/mol-798.9kJ/mol=273.0kJ/mol)比断开N2分子的第一个化学键所需的能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小,可知CO相对活泼;
(4)
CO2分子的中心原子C原子价层电子对数为2+=2,空间构型为直线形,与CO2互为等电子体,的结构式[O=N=O]+。故答案为:直线形;[O=N=O]+;
(5)
①晶胞中Fe3+处于O2-围成的正八面体空隙(填“正四面体”“正八面体”或“正十六面体”)。故答案为:正八面体;
②若晶胞的体对角线长为 a nm,则晶胞棱长=nm=×10-7 cm,晶胞体积=(×10-7 cm)3,晶胞中亚铁离子个数1,铁离子个数4×+3×=2,氧离子个数=12×+1=4,则 Fe3O4晶体的密度=g/cm3=g·cm-3,故答案为:。
12.(1) 对氯苯胺(或4-氯苯胺) 硝基
(2) 取代反应
(3)2+2KNO3+H2SO4→2+K2SO4+2H2O
(4) 5 (或)
(5)
【解析】
【分析】
A的分子式为C6H6NCl,结合B、C的结构简式,推知A为,A与B发生取代反应生成C和HF,对比C、E的结构,结合反应条件,可知C中硝基还原为氨基生成D,D中氨基与乙二酸形成酰胺基得到E,故D为,D发生硝化反应生成F,F与A发生取代反应生成G和HF,推知F为,G中硝基还原为氨基生成H,对比H、氯法齐明的结构简式,可知H与2-丙醇发生取代反应生成I,故I结构简式为。
(1)
A的结构简式为,A的名称对氯苯胺(或4-氯苯胺),C为,C所含的含氧官能团名称是硝基。故答案为:对氯苯胺(或4-氯苯胺);硝基;
(2)
反应⑤是与反应生成G和HF,反应类型为取代反应,对比H、氯法齐明的结构简式,可知H与2-丙醇发生取代反应生成I,I的结构简式为。故答案为:取代反应;;
(3)
反应④的化学方程式2+2KNO3+H2SO4→2+K2SO4+2H2O。故答案为:2+2KNO3+H2SO4→2+K2SO4+2H2O;
(4)
化合物M是B的芳香同分异构体,已知M和B具有相同的官能团,2个氟原子还有邻、间2种位置关系,对应的硝基分别有2种()、3种(),则M的可能结构有5种,其中核磁共振氢谱有2组峰,峰面积比为2∶1的结构式为(或)(任写一种)。故答案为:5;(或);
(5)
仿照题中合成流程图,HOCH2CH2OH与反应生成,乙烯与溴发生加成反应生成BrCH2CH2Br,然后在碱性条件下水解生成HOCH2CH2OH,以和乙烯为起始主要原料合成的路线(其他无机试剂任选),故答案为:。
安徽省合肥市第六中学2023届高三下学期最后一卷理综化学试题(含解析): 这是一份安徽省合肥市第六中学2023届高三下学期最后一卷理综化学试题(含解析),共16页。试卷主要包含了单选题,工业流程题,实验题,填空题,有机推断题等内容,欢迎下载使用。
安徽省皖南八校2023届高三下学期第三次大联考理综化学试题(含解析): 这是一份安徽省皖南八校2023届高三下学期第三次大联考理综化学试题(含解析),共17页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
安徽省淮南2023届市高三第一次模拟考试理综化学试题(含解析): 这是一份安徽省淮南2023届市高三第一次模拟考试理综化学试题(含解析),共17页。试卷主要包含了单选题,实验题,工业流程题,结构与性质,有机推断题等内容,欢迎下载使用。












