安徽省淮南2023届市高三第一次模拟考试理综化学试题(含解析)
展开安徽省淮南2023届市高三第一次模拟考试理综化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学在人类社会的可持续发展中发挥着重要作用。下列说法错误的是
A.我国研制的“超级钢”强度很大,在应用时实现了钢板的轻量化,这不仅节约材料,还可以降低能耗和减少环境污染等
B.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响,甚至还可以补充某些必要的营养成分
C.环境保护工程师的主要工作是预防和治理环境污染
D.绿色化学也称环境友好化学,其核心思想就是“先污染后治理”,利用化学原理和技术,消除有害化学物质
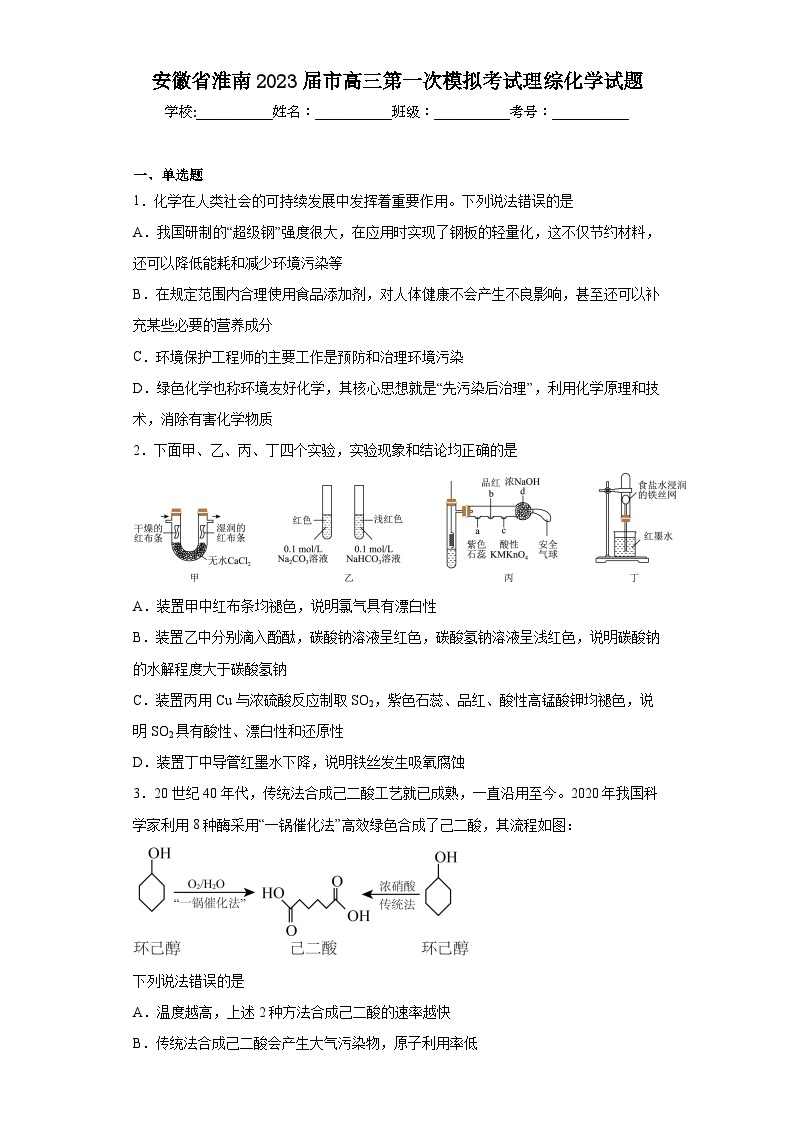
2.下面甲、乙、丙、丁四个实验,实验现象和结论均正确的是
A.装置甲中红布条均褪色,说明氯气具有漂白性
B.装置乙中分别滴入酚酞,碳酸钠溶液呈红色,碳酸氢钠溶液呈浅红色,说明碳酸钠的水解程度大于碳酸氢钠
C.装置丙用Cu与浓硫酸反应制取SO2,紫色石蕊、品红、酸性高锰酸钾均褪色,说明SO2具有酸性、漂白性和还原性
D.装置丁中导管红墨水下降,说明铁丝发生吸氧腐蚀
3.20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图:
下列说法错误的是
A.温度越高,上述2种方法合成己二酸的速率越快
B.传统法合成己二酸会产生大气污染物,原子利用率低
C.“一锅催化法”属于绿色化学工艺
D.1mol己二酸与足量NaHCO3反应生成88gCO2
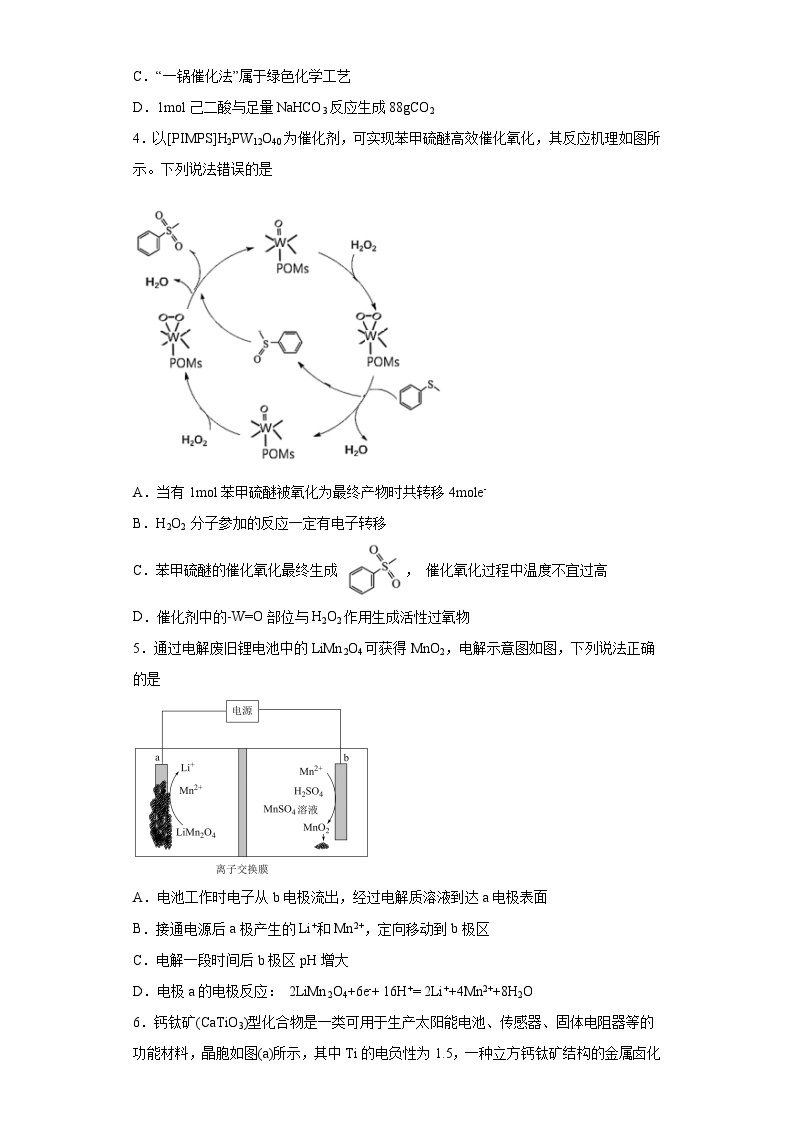
4.以[PIMPS]H2PW12O40为催化剂,可实现苯甲硫醚高效催化氧化,其反应机理如图所示。下列说法错误的是
A.当有1mol苯甲硫醚被氧化为最终产物时共转移4mole-
B.H2O2 分子参加的反应一定有电子转移
C.苯甲硫醚的催化氧化最终生成 , 催化氧化过程中温度不宜过高
D.催化剂中的-W=O部位与H2O2作用生成活性过氧物
5.通过电解废旧锂电池中的LiMn2O4可获得MnO2,电解示意图如图,下列说法正确的是
A.电池工作时电子从b电极流出,经过电解质溶液到达a电极表面
B.接通电源后a极产生的Li+和Mn2+,定向移动到b极区
C.电解一段时间后b极区pH增大
D.电极a的电极反应: 2LiMn2O4+6e-+ 16H+= 2Li++4Mn2++8H2O
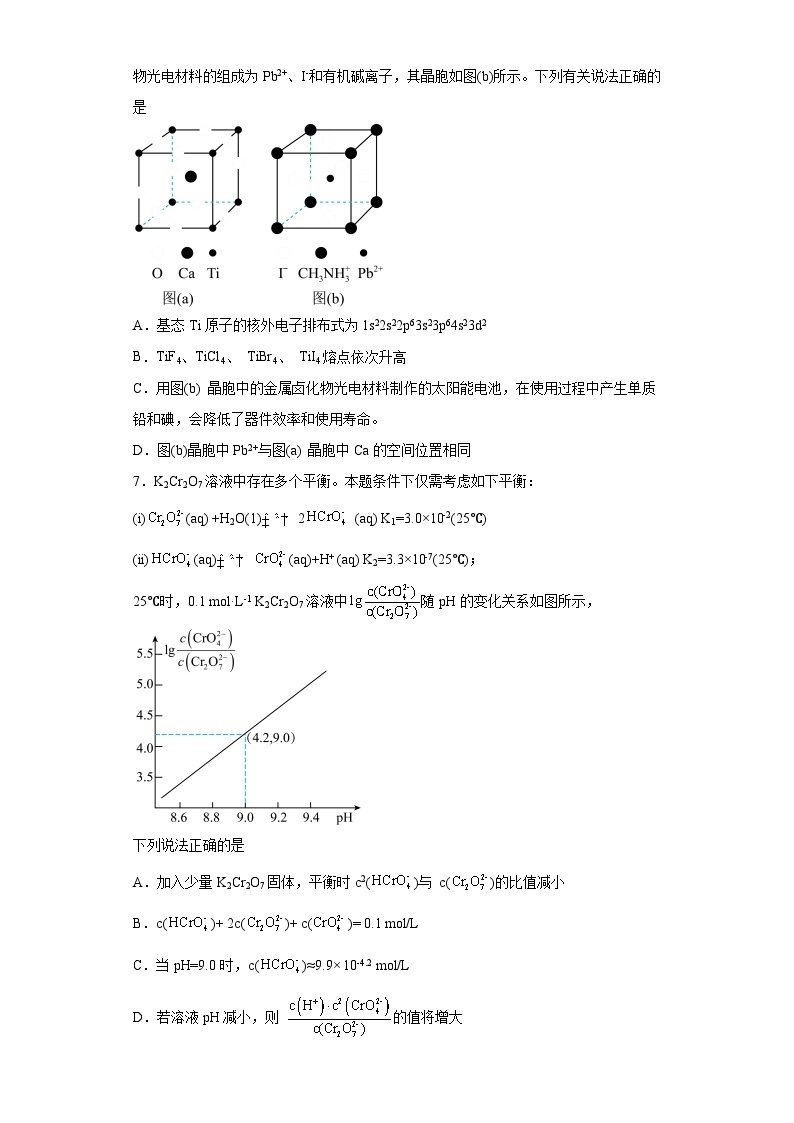
6.钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,晶胞如图(a)所示,其中Ti的电负性为1.5,一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子,其晶胞如图(b)所示。下列有关说法正确的是
A.基态Ti原子的核外电子排布式为1s22s22p63s23p64s23d2
B.TiF4、TiCl4、 TiBr4、 TiI4熔点依次升高
C.用图(b) 晶胞中的金属卤化物光电材料制作的太阳能电池,在使用过程中产生单质铅和碘,会降低了器件效率和使用寿命。
D.图(b)晶胞中Pb2+与图(a) 晶胞中Ca的空间位置相同
7.K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)(aq) +H2O(1)2 (aq) K1=3.0×10-2(25℃)
(ii)(aq)(aq)+H+ (aq) K2=3.3×10-7(25℃);
25℃时,0.1 mol·L-1 K2Cr2O7溶液中随pH的变化关系如图所示,
下列说法正确的是
A.加入少量K2Cr2O7固体,平衡时c2()与 c()的比值减小
B.c()+ 2c()+ c()= 0.1 mol/L
C.当pH=9.0时,c()≈9.9× 10-4.2 mol/L
D.若溶液pH减小,则 的值将增大
二、实验题
8.某化学实验小组为了探究氨气的性质设计了如下实验方案。
实验一:探究氨气的溶解性
氨气具有强刺激性气味,会污染空气。实验小组经过多次尝试,最终将氨气的制备、收集、检验和喷泉实验于一体,设计出如图装置。
(1)写出气体发生装置仪器A中产生氨气的方程式___________。
(2)仪器B的名称___________,为了保证喷泉实验的良好效果,B中可以放入的试剂___________。
(3)实验时,打开K2,关闭K3,打开K1,将注射器中的浓氨水注入A中开始制备和收集氨气。已知仪器C中放入的是滴有酚酞溶液的湿棉花,则仪器C的作用___________。在不拆除装置的前提下,引发喷泉的操作是___________。
实验二:探究氨气的还原性
已知: Cu2O 呈红色固体,在酸性溶液中不稳定: Cu2O+ H2SO4=Cu+CuSO4+ H2O。
(4)装置G用于制备氨气,仪器的链接顺序为e,f接___________、___________、___________、___________ 、___________ 、___________接i,________,装置H的作用___________。实验开始前应先通一段时间的N2,其目的是___________。
(5)反应结束后装置F中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:取15.6g红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体9.6g,则红色固体的成分及其物质的量为___________。
三、工业流程题
9.锌的用途广泛,主要用于镀锌板及精密铸造等行业。以粗氧化锌(主要成分为ZnO及少量Fe2O3、CuO、MnO、SiO2)为原料制备锌的工艺流程如图所示:
已知:①“浸取”时。ZnO、 CuO转化为[ Zn(NH3)4]2+、[Cu(NH3)4]2+进入溶液:
②25℃时,Ksp(CuS)=6.4×10-36, Ksp(ZnS)=1.6 ×10-24;
③沉淀除铜标准:溶液中≤2.0×10-6
回答下列问题:
(1)“滤渣1”的主要成分为Fe(OH)3、Mn(OH)2和___________(填化学式),“ 操作3”的名称为___________。
(2)“氧化除锰”时,H2O2将Mn2+转化为难溶的MnO2,该反应的离子方程式为___________。
(3)“沉淀除铜”时,锌的最终回收率、除铜效果[除铜效果以反应后溶液中铜锌比表示] 与“(NH4)2 S加入量”[以表示]的关系曲线如图所示。
①当(NH4)2S加入量≥100%时,锌的最终回收率下降的原因是___________(用离子方程式表示),该反应的平衡常数为___________。(已知) [ Zn(NH3)4]2+的=2. 9 ×109]
②“沉淀除铜”时(NH4 )2S加入量最好应选___________。
a.100% b.110% c.120% d.130%
(4)电解后溶液中的溶质主要成分是___________, 可用于循环使用。
四、结构与性质
10.甲烷既是一种清洁能源,又是基础化工原料,在生产生活和科学研究中具有极其重要的作用。
(1)通过以下反应可获得新型能源二甲醚(CH3OCH3)
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1 = a kJ·mol -1
②CO2(g)+3H2(g)=CH3OH(g)+ H2O(g) ΔH2 = b kJ·mol -1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=c kJ·mol -1
反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的ΔH=___________ kJ·mol -1 (用含a、b、c的式子表示)
(2)已知: 2H2O(g)+CH4(g) CO2(g)+4H2(g)的平衡常数()与反应温度(t)之间的关系如图所示。
某研究小组,在温度t下,向容积为2L的抽空的密闭容器中通入0.02 mol CO2和0.08 mol H2,10 min后反应平衡,测得容器中c(H2O)=0.01 mol/L。
①则0~10 min内CH4的反应速率v=___________H2的转化率α=___________。
②反应温度t约为___________℃。
③在该条件下测定平衡体系的压强为 300 kPa,则该反应的标准平衡常数 =___________。(已知:对于反应dD(g)+eE(g) gG(g)+hH(g),,其中 =100kPa, PG、PH、PD、PE为各组分的平衡分压)。
(3)科学家们已经用甲烷制出了金刚石,人造金刚石在硬度上与天然金刚石几乎没有差别,请根据下图金刚石结构模型及晶胞,回答问题:
①1个金刚石晶胞中所含碳原子数为___________, 已知原子a、b的分数坐标为(0,0,0)和(0,, ), 原子c的分数坐标为___________。
②若碳原子半径为r nm,则金刚石晶胞的密度为___________g/cm3(用含r的计算式表示)。
五、有机推断题
11.瑞替加滨(K)具有潜在的神经保护作用,它可以永久性减少大脑中动脉闭塞的梗死面积,可以逆转单侧颈动脉闭塞导致的功能缺失,可以治疗癫痫病。以下是K的两条合成路线图:
(1)A→B的反应类型为___________。
(2)ClCOOCH2CH3的化学名称是___________。
(3)K的结构简式___________。
(4)写出G→H的反应方程式___________。
(5)I分子中氮原子的杂化轨道类型为___________。
(6)J中的含氧官能团的名称是___________。
(7)路线图中设计F→G和H→I的目的是___________。
(8)请写出满足下列条件的F的所有同分异构体___________。
①能与新制的氢氧化铜悬浊液反应产生砖红色沉淀
②碱性条件下能水解,酸化后得产物之一遇FeCl3溶液显色
③核磁共振氢谱显示的峰面积之比为:1:2:2:3:4。
参考答案:
1.D
【详解】A.“超级钢”强度很大,在应用时实现了钢板的轻量化,且钢板性能优良,这不仅节约材料,还可以降低能耗和减少环境污染等,A正确;
B.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响,甚至还可以补充某些必要的营养成分,促进人体健康,B正确;
C.环境保护工程师的主要工作是预防和治理环境污染,减少对环境的影响,C正确;
D.绿色化学也称环境友好化学,其核心思想就是从源头上消除污染,D错误;
故选D。
2.B
【详解】A.氯气不具有漂白性,次氯酸具有漂白性,氯气遇到水生成次氯酸,所以可以观察到左侧红色布条不褪色,右侧有色布条褪色,故A错误;
B.装置乙中分别滴入酚酞,碳酸钠溶液呈红色,碳酸氢钠溶液呈浅红色,说明碳酸钠的溶液碱性强,水解程度大于碳酸氢钠,故B正确;
C.Cu与浓硫酸反应制取SO2需要加热,SO2遇到紫色石蕊溶液变红、SO2遇到品红溶液使其褪色、SO2遇到酸性高锰酸钾使其褪色,说明SO2具有酸性、漂白性和还原性,故C错误;
D.铁丝发生吸氧腐蚀导致试管中压强减小,导管中红墨水液面上升,说明铁丝发生吸氧腐蚀,故D错误;
故选B。
3.A
【详解】A.温度升高,催化剂-酶会失活,反应速率会减慢,故A错误;
B.传统法合成己二酸过程中浓硝酸被还原生成了二氧化氮气体,为大气污染物,且原子利用率低,故B正确;
C.一锅催化法”没有副产物生成,属于绿色化学工艺,故C正确;
D.羧基和碳酸氢钠反应生成二氧化碳,且羧基和二氧化碳的物质的量之比为1:1,则1mol己二酸与足量饱和碳酸氢钠溶液反应生成2mol二氧化碳,生成二氧化碳的质量为88g,故D正确;
故选A。
4.B
【详解】A.根据图示,当有1mol苯甲硫醚被氧化为最终产物,消耗2molH2O2,H2O2中O元素化合价由-1降低为-2,共转移4mole-,故A正确;
B.与H2O2 反应生成,元素化合价不变,没有有电子转移,故B错误;
C.双氧水加热易分解,所以催化氧化过程中温度不宜过高,故C正确;
D.催化剂中的-W=O部位与H2O2作用生成活性过氧物,故D正确;
选B。
5.D
【分析】由图可知,b极Mn元素价态升高失电子,故b极为阳极,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,a极为阴极,电极反应式为2LiMn2O4+6e-+16H+=2Li++4Mn2++8H2O,据此作答。
【详解】A.由分析可知,电池工作时电子从阳极b电极流出,经导线流向电源的正极,再由电源的负极流出,经导线流向阴极s极,电子不能经过电解质溶液,A错误;
B.由分析可知,a为阴极,b为阳极,电解池的电解质溶液中阳离子从阳极区流向阴极区,故接通电源后b电极产生的H+定向移动到a极区参与a电极反应,而a极产生的Li+和Mn2+,不会定向移动到b极区,B错误;
C.由分析可知,b电极为阳极,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故电解一段时间后b极区pH减小,C错误;
D.由分析可知,电极a为阴极,其电极反应为: 2LiMn2O4+6e-+ 16H+= 2Li++4Mn2++8H2O,D正确;
故答案为:D。
6.C
【详解】A.Ti是22号元素,故基态Ti原子的核外电子排布式为1s22s22p63s23p63d24s2,A错误;
B.由于F的电负性大于Cl、Br、I,Ti与F的电负性差值为2.5>1.7,TiF4为离子化合物,熔点最高,而Cl、Br、I的电负性与Ti的差值均小于1.7,即其它三种均为共价化合物,为分子晶体,对于组成和结构相似的分子晶体,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高,且一般晶体的熔沸点:离子晶体大于分子晶体,故TiCl4、 TiBr4、 TiI4、TiF4熔点依次升高,B错误;
C.用图(b) 晶胞中的金属卤化物光电材料制作的太阳能电池,在使用过程中产生单质铅和碘,导致光电材料损坏,会降低了器件效率和使用寿命,C正确;
D.距离Pb2+最近的是处于面心的6个I-,Pb2+的配位数为6,图(a)中Ti的配位数也是6,图(a)和图(b)可以看出Pb2+和Ti空间位置相同,D错误;
故答案为:C。
7.C
【详解】A.K2Cr2O7溶液中K1=,平衡常数只与温度有关,加入少量K2Cr2O7固体,c2()与 c()的比值不变,故A错误;
B.根据Cr元素守恒,0.1 mol·L-1 K2Cr2O7溶液中,c()+ 2c()+ c()> 0.1 mol/L,故B错误;
C.K1==,K2=,,根据图示,当pH=9.0时,,所以c()≈9.9× 10-4.2 mol/L,故C正确;
D.若溶液pH减小,则 =,若溶液pH减小,平衡ii逆向移动,增大,所以减小,故D错误;
选C。
8.(1)CaO+NH3·H2O=Ca(OH)2+NH3↑(或CaO+H2O=Ca(OH)2、NH3·H2O= NH3↑+H2O)
(2) 球形干燥管 碱石灰
(3) 吸收并检验氨气,防止氨气直接排入空气 关闭K1和K2,打开K3
(4) abcdgh(或abcdhg) 安全瓶,防倒吸 排尽装置内空气或氧气 (合理即可)
(5)Cu2O和Cu各0.075mol 或Cu2O 0.075mol、Cu 0.075mol
【详解】(1)A中产生氨气的方程式CaO+NH3·H2O=Ca(OH)2+NH3↑(或CaO+H2O=Ca(OH)2、NH3·H2O= NH3↑+H2O);
(2)仪器B的名称为球形干燥管,为了保证喷泉实验的良好效果,B中可以放入的试剂为碱石灰,对氨气进行干燥;
(3)C中放入滴有酚酞溶液的湿棉花,作用为吸收并检验氨气,防止氨气直接排入空气,污染大气。在不拆除装置的前提下,引发喷泉的操作是关闭K1和K2,打开K3;
(4)分析实验装置,装置G用于制备氨气,然后E用于干燥氨气,氨气和CuO在F中发生反应,然后接H,起到安全瓶的作用,最后用I进行尾气吸收,则仪器的链接顺序为e,f接a-b-c-d-g-h (或a-b-c-d-h-g)接i,装置H的作用是安全瓶,防倒吸。实验开始前应先通一段时间的N2,其目的是排尽装置内空气或氧气 (合理即可),防止空气中氧气等的干扰。
(5)所得固体为Cu,物质的量为;过程中发生反应为Cu2O+ H2SO4=Cu+CuSO4+ H2O,每摩尔Cu2O与酸反应前后质量损失为80g,根据反应前后质量损失为15.6g-9.6g=6g,则参加反应的Cu2O为,则生成Cu的物质的量为0.075mol,所以原固体中Cu2O的物质的量为0.075mol,Cu物质的量为,故Cu2O和Cu各0.075mol 或Cu2O 0.075mol、Cu 0.075mol。
9.(1) SiO2 分液
(2)Mn2++H2O2+2NH3·H2O=MnO2+2H2O+2
(3) [Zn(NH3)4]2++S2-+4H2O= ZnS↓+4NH3·H2O或者[Zn(NH3)4]2++S2-=ZnS↓+4NH3 2.16×1014 c
(4)硫酸
【分析】粗氧化锌主要成分为ZnO及少量Fe2O3、CuO、MnO、SiO2,加入NH3-NH4Cl的混合溶液,生成[Zn(NH3)4]2+、[Cu(NH3)4]2+,同时生成Fe(OH)3、Mn(OH)2等,SiO2不溶解,进行操作1即过滤一起除去,得滤渣1为Fe(OH)3、Mn(OH)2和SiO2,再向滤液中加入H2O2,进行氧化除锰,反应的方程式为H2O2+Mn2++2NH3•H2O=MnO2↓+2H2O+2,再加入(NH4)2S,进行沉淀除铜,反应的方程式为[Cu(NH3)4]2++S2-=CuS↓+4NH3,进行操作2即过滤,除去MnO2和CuS,即滤渣2为MnO2和CuS,向滤液中加入萃取剂,使锌进入有机萃取剂中,进行操作3即分液后,再向有机萃取剂中加入硫酸,进行反萃取,得到硫酸锌溶液,然后进行电解,得到锌,据此分析作答。
【详解】(1)由分析可知,“滤渣1”的主要成分为Fe(OH)3、Mn(OH)2和SiO2,“ 操作3” 分离有机层和无机层,名称为分液,故答案为:SiO2;分液;
(2)由分析可知,“氧化除锰”时,H2O2 将Mn2+转化为难溶的MnO2,该反应的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2+2H2O+2,故答案为:Mn2++H2O2+2NH3·H2O=MnO2+2H2O+2;
(3)①当(NH4)2S加入量≥100%时,锌的回收率下降的可能原因锌离子与硫离子结合生成了硫化锌,离子方程式为[Zn(NH3)4]2++S2-=ZnS↓+4NH3或者[Zn(NH3)4]2++S2-+4H2O= ZnS↓+4NH3·H2O,该反应的平衡常数为K=====2.16×1014,故答案为:[Zn(NH3)4]2++S2-=ZnS↓+4NH3或者[Zn(NH3)4]2++S2-+4H2O= ZnS↓+4NH3·H2O;2.16×1014;
②由题干图示信息可知,当(NH4)2S加入量为120%时,铜锌比为2.0×106,达到沉淀除铜标准,继续加大(NH4)2S加入量会导致锌回收率下降且不经济,故答案为:c;
(4)由分析可知,电解硫酸锌溶液制备锌,方程式为:2ZnSO4+2H2O2Zn+O2↑+2H2SO4,故电解后溶液中的溶质主要成分是硫酸,可用于“反萃取”步骤中循环使用,故答案为:硫酸。
10.(1)2a+2b+c
(2) 0.0005 mol/L 50% 660.2 9
(3) 8 (,,)
【详解】(1)根据①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1 = a kJ·mol -1
②CO2(g)+3H2(g)=CH3OH(g)+ H2O(g) ΔH2 = b kJ·mol -1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=c kJ·mol -1
由盖斯定律,反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)可由2×①+2×②+③得到,则ΔH=(2a+2b+c)kJ·mol -1;
(2)①根据2H2O(g)+CH4(g) CO2(g)+4H2(g),c(H2O)=0.01 mol/L,则c(CH4)=0.005 mol/L,则0~10 min内CH4的反应速率v==0.0005 mol/L,c(H2O)=0.01 mol/L,则生成水为0.02mol,反应的H2为0.04mol,H2转化率α=;
②根据各物质浓度列出三段式为:
K=;,反应温度t约为660.2℃。
③在该条件下测定平衡体系的压强为 300 kPa,则该反应的标准平衡常数 =9;
(3)①1个金刚石晶胞中所含碳原子数为, 已知原子a、b的分数坐标为(0,0,0)和(0,, ), 原子c的分数坐标为(,,)。
②1个金刚石晶胞中所含碳原子数为,金刚石体对角线上的四个原子紧密相连,设晶胞棱长为a,则a=r,晶胞体积=a3,则金刚石晶胞的密度为=g/cm3。
11.(1)取代反应
(2)氯甲酸乙酯
(3)
(4)
(5)sp2 和sp3
(6)硝基、酯基
(7)保护-NH2, 防止被氧化
(8)、、
【分析】A和发生取代反应生成B,B和H2发生还原反应生成C,C和ClCOOCH2CH3发生取代反应生成K为;D和ClCOOCH2CH3发生取代反应生成E为,E发生还原反应生成F为,F和反应生成G,G发生硝化反应生成H为,H和NH2NH2发生取代反应生成I为,I和发生加成反应生成J为,J发生还原反应生成K。
【详解】(1)A→B的反应类型为取代反应;
(2)ClCOOCH2CH3的化学名称是氯甲酸乙酯;
(3)根据分析,K的结构简式;
(4)G→H的反应方程式;
(5)I为,分子中氮原子的杂化轨道类型为sp2和sp3;
(6)J为,含氧官能团的名称是硝基、酯基;
(7)结合反应过程中最终又生成氨基,则路线图中设计F→G和H→I的目的是保护-NH2, 防止被氧化;
(8)F为,同分异构体满足:
①能与新制的氢氧化铜悬浊液反应产生砖红色沉淀,则含有醛基;
②碱性条件下能水解,酸化后得产物之一遇FeCl3溶液显色,则含有酚羟基形成的酯基;
③核磁共振氢谱显示的峰面积之比为:1:2:2:3:4;符合条件的同分异构体为、、。
陕西省西安市长安区2023届高三第一次模拟考试理综化学试题(含解析): 这是一份陕西省西安市长安区2023届高三第一次模拟考试理综化学试题(含解析),共18页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
2023届山西省临汾市高三第一次模拟考试理综化学试题含解析: 这是一份2023届山西省临汾市高三第一次模拟考试理综化学试题含解析,共18页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
2023届安徽省淮南市高三第一次模拟考试理综化学试题(原卷+解析版): 这是一份2023届安徽省淮南市高三第一次模拟考试理综化学试题(原卷+解析版),文件包含安徽省淮南2023届市高三第一次模拟考试理综化学试题Word版含解析docx、安徽省淮南2023届市高三第一次模拟考试理综化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。