

- 苏教版高中化学必修第一册专题4硫与环境保护第2单元硫及其化合物的相互转化学案 学案 0 次下载
- 苏教版高中化学必修第一册专题4硫与环境保护第3单元防治二氧化硫对环境的污染学案 学案 0 次下载
- 苏教版高中化学必修第一册专题4硫与环境保护第3单元微专题5利用比较法全面认识物质的性质学案 学案 0 次下载
- 苏教版高中化学必修第一册专题5微观结构与物质的多样性第1单元第1课时元素周期律学案 学案 0 次下载
- 苏教版高中化学必修第一册专题5微观结构与物质的多样性第1单元第2课时元素周期表元素周期表的应用学案 学案 0 次下载
- 苏教版高中化学必修第一册专题5微观结构与物质的多样性第2单元第1课时离子键学案 学案 0 次下载
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时学案设计
展开第2课时 硫酸的工业制备 浓硫酸的性质
发 展 目 标 | 体 系 构 建 |
1.能对物质性质和变化作出解释与预测。 2.能运用化学变化规律分析其在生产、生活中的应用。 3.认识化学工业与人类生活、社会发展的关系,能辨证地分析化学品的影响。 |
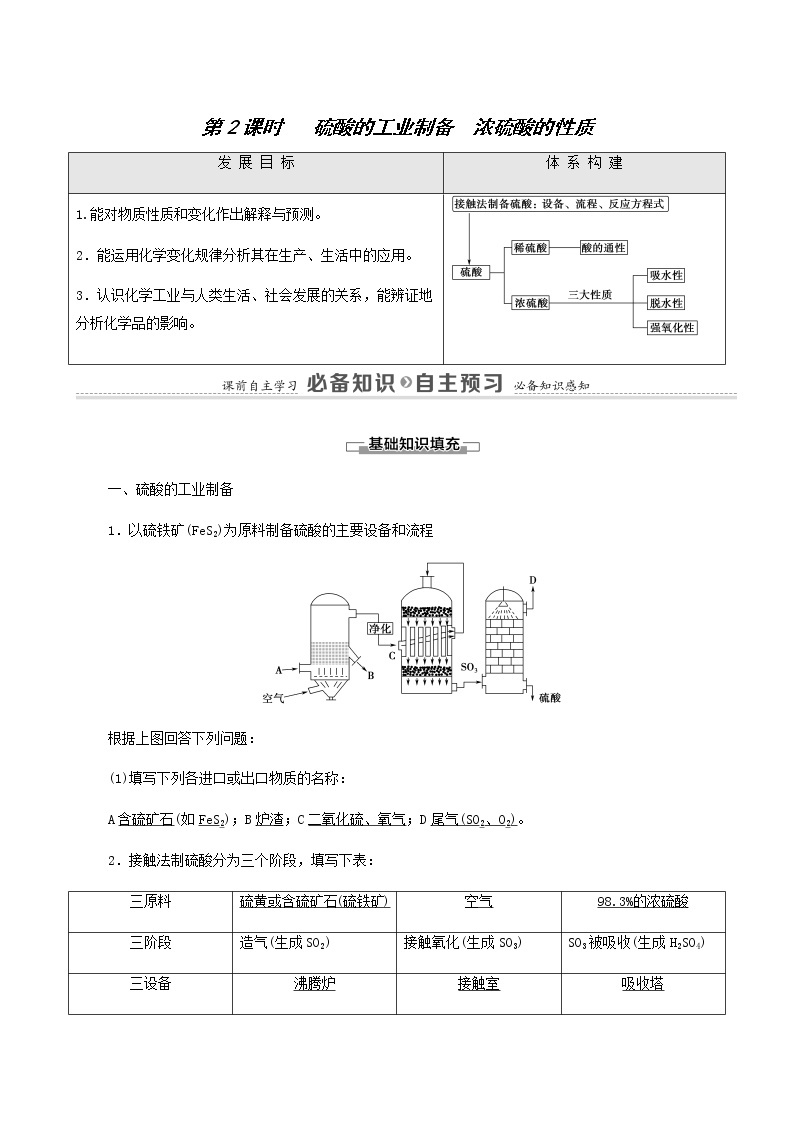
一、硫酸的工业制备
1.以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程
根据上图回答下列问题:
(1)填写下列各进口或出口物质的名称:
A含硫矿石(如FeS2);B炉渣;C二氧化硫、氧气;D尾气(SO2、O2)。
2.接触法制硫酸分为三个阶段,填写下表:
三原料 | 硫黄或含硫矿石(硫铁矿) | 空气 | 98.3%的浓硫酸 |
三阶段 | 造气(生成SO2) | 接触氧化(生成SO3) | SO3被吸收(生成H2SO4) |
三设备 | 沸腾炉 | 接触室 | 吸收塔 |
三反应(均放热) | S+O2SO2;4FeS2+11O22Fe2O3+8SO2 | 2SO2+O2 | SO3+H2O===H2SO4 |
微点拨:用98.3%的浓硫酸吸收SO3,可以避免形成酸雾,并能提高吸收效率。
二、浓硫酸的性质
1.吸水性
(1)浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。
(2)常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如H2S等)。
2.脱水性
(1)浓硫酸能把有机物中的氢、氧元素按水的组成比脱去,剩余黑色的炭。
(2)实验探究。
现象1:蔗糖逐渐变黑。原因是浓硫酸具有脱水性:
C12H22O1112C+11H2O
现象2:蔗糖体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出有刺激性气味的气体。原因是浓硫酸具有强氧化性,把炭氧化成CO2,并有SO2气体放出。
微点拨:浓硫酸的脱水作用一般适用于含C、H元素的有机物,这些有机物本身没有H2O,但有H、O元素,浓硫酸能把有机物中的H、O元素按H2O的组成比(H∶O=2∶1)脱出来,使这些有机物发生化学变化。
3.强氧化性
(1)与金属铜的反应
实验装置 | |
实验现象 | a试管中铜丝表面变黑,有气泡逸出; b试管中的品红溶液逐渐变为无色; c试管中的紫色石蕊溶液逐渐变为红色; 冷却后,将a试管里的溶液慢慢倒入水中,溶液变为蓝色。 |
实验结论 | 铜与浓硫酸在加热条件下发生反应,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。 |
(2)与非金属的反应
浓硫酸与木炭反应的化学方程式: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
C、Cu分别与浓硫酸反应时,浓硫酸各表现出什么性质?
[提示] 与碳反应时体现浓硫酸的强氧化性;与Cu反应时体现浓硫酸的酸性和强氧化性。
1.判断正误(正确的打“√”,错误的打“×”。)
(1)在接触法制硫酸中,矿石粉碎的目的是为了增大反应物的接触面积,使反应更充分。 (√)
(2)在吸收塔内,是用浓硫酸吸收SO3而不是用水,目的是为了防止形成酸雾,腐蚀设备。 (√)
(3)浓硫酸具有吸水性,所以浓硫酸可以干燥H2、CO、NH3、H2S、HI、HBr等气体。 (×)
(4)将浓硫酸滴到湿的蔗糖表面,固体变黑膨胀并有刺激性气味气体生成,说明浓硫酸有脱水性、吸水性和强氧化性。 (√)
2.下列关于浓硫酸和稀硫酸的叙述中正确的是( )
A.常温时都能与铁发生反应,放出气体
B.加热时都能与铜发生反应
C.都能作为气体干燥剂
D.硫元素的化合价都是+6价
D [常温时浓硫酸使铁钝化;铜与稀硫酸常温和加热时都不反应;浓硫酸有吸水性可以作干燥剂,稀硫酸不能作干燥剂。]
3.某报刊曾报道下面一段新闻“某日凌晨,一辆载有浓硫酸的罐车在某境内侧翻。从车中流出的硫酸使路边杂草等被腐蚀成黑色,上面泛起黑色的泡沫,空气中到处弥漫着刺鼻的气味。”请用化学知识解释下列问题:
(1)“路边杂草被腐蚀成黑色”其原因是 。
(2)浓硫酸为不挥发性强酸,为什么说“到处弥漫着刺鼻的气味”? 。
[答案] (1)浓硫酸使草炭化 (2)炭化后的碳与浓硫酸反应生成SO2
理解掌握浓硫酸的特性 (素养养成——宏观辨识与微观探析) |
化学兴趣小组的同学设计改进了蔗糖与浓硫酸反应的“黑面包”实验,并验证反应过程中的产物,实验装置如下所示:
[问题1] 猜想品红1溶液褪色的原因吗?高锰酸钾溶液褪色起怎样的作用?为什么要用品红2溶液?
[提示] 用品红1溶液褪色验证二氧化硫,再用高锰酸钾吸收多余的二氧化硫,接着再次验证二氧化硫是否全部被吸收,最后才验证二氧化碳。
[问题2] 实验中为什么要加水?
[提示] 浓硫酸与碳的反应需要加热,加水的作用是产生热量,引发反应。
[问题3] 该实验主要体现了浓硫酸的哪些特性?
[提示] 脱水性和强氧化性。
1.浓硫酸吸水性和脱水性的区别
由此看出:二者的根本区别在于物质本身是否存在水分子。
2.浓硫酸的强氧化性
(1)本质:浓硫酸具有强氧化性,是因为H2SO4分子中+6价的硫元素具有很强的得电子能力。
(2)反应规律:
①常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸变稀后,生成的气体为H2。
②与不活泼金属和非金属反应的规律
a.反应需要加热,否则不反应。
b.还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
c.浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
d.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止。
③与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
1.硫元素常见化合价及其物质类别关系如图,下列说法错误的是( )
A.X是H2S
B.Y既有氧化性又有还原性
C.将X与Y混合,不能生成硫
D.工业上制Z的主要原料是硫铁矿
C [-2价硫的氢化物,为硫化氢, X是H2S, A正确;处于中间价态的元素具有氧化性和还原性,+4价的硫处于中间价态,所以Y既有氧化性又有还原性,B正确;将X是硫化氢、Y是二氧化硫,两者混合,发生归中反应,能生成硫, C错误;工业上制硫酸用煅烧硫铁矿来造气,则工业上制Z的主要原料是硫铁矿, D正确。]
2.将浓硫酸表现的性质填入括号内。
A.酸性 B.强氧化性
C.脱水性 D.吸水性
(1)用磷矿粉[主要成分Ca3(PO4)2]和硫酸反应制磷酸( )
(2)热的浓硫酸与铜片反应( )
(3)浓硫酸不能干燥NH3、H2S、HI等气体( )
(4)浓硫酸能吸收H2或SO2气体中的水分( )
(5)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑( )
(6)锌和稀硫酸反应( )
[解析] 硫酸与Ca3(PO4)2反应制磷酸利用了硫酸的强酸性;热的浓硫酸与铜片反应生成CuSO4和SO2,表现了浓硫酸的强氧化性和酸性;NH3为碱性气体,不能用浓硫酸干燥;H2S、HI为还原性气体,浓硫酸氧化这两种气体;浓硫酸可用来干燥气体,表现了其吸水性;浓硫酸使湿润的蓝色石蕊试纸变红,表现其酸性,后变黑,表现其脱水性;金属与稀硫酸的反应,是H+表现出来的酸的通性,利用了硫酸的酸性。
[答案] (1)A (2)AB (3)AB (4)D (5)AC (6)A
1.在硫酸的工业制法中,下列说法正确的是( )
A.黄铁矿煅烧前要粉碎,因为大块硫铁矿不能燃烧
B.从沸腾炉出来的气体只有SO2
C.SO2氧化成SO3,SO2能全部转化为SO3
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
D [将黄铁矿粉碎是使其增大与空气的接触面积,使燃烧更快、更充分,并不是大块黄铁矿不能燃烧。从沸腾炉出来的气体除SO2外,还有SO3、O2等。SO2转化为SO3为可逆反应,正、逆反应同时进行,故SO2不可能全部转化为SO3。SO3转化为硫酸,若直接用水吸收,会形成大量酸雾,导致SO3吸收不完全,工业生产中用98.3%的浓硫酸作为吸收剂,则不会出现酸雾,吸收SO3更充分。]
2.下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.蓝色胆矾晶体滴加浓硫酸时变为白色固体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸与铜片共热的反应中,浓硫酸只表现强氧化性
B [浓硫酸具有脱水性,使蔗糖中氢、氧元素以水的形式脱出,而使蔗糖炭化变黑,与吸水性无关,A错误;浓硫酸具有吸水性,能吸收胆矾晶体中的结晶水,可以使蓝色的胆矾晶体失水变为白色晶体,B正确;浓硫酸是一种酸,能和氨气反应,故不能干燥氨气,C错误;浓硫酸与铜片共热的反应中,浓硫酸既表现出强氧化性,又表现出酸性,D错误。]
3.浓硫酸在实现下列物质的转化过程中,既表现出氧化性,又表现出酸性的是( )
①Cu―→CuSO4 ②C―→CO2 ③FeO―→Fe2(SO4)3 ④Fe2O3―→Fe2(SO4)3
A.①③ B.②④
C.①④ D.②③
A [①正确,浓硫酸表现出强氧化性,将Cu氧化为Cu2+,自身还原为SO2,同时生成了盐(CuSO4),体现了浓硫酸的酸性;②只体现了浓硫酸的强氧化性;③既体现了浓硫酸的强氧化性,将+2价Fe氧化为+3价Fe,同时又生成了盐[Fe2(SO4)3],体现了浓硫酸的酸性;④只体现了浓硫酸的酸性。]
4.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片,加热使之反应。则充分反应后,被还原的H2SO4的物质的量( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
A [根据反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。若50 mL 18 mol·L-1的H2SO4与铜完全反应,被还原的H2SO4的物质的量为0.45 mol,而实际上,随着反应的进行,H2SO4的浓度逐渐变稀,铜与稀H2SO4不反应,故被还原的H2SO4的物质的量小于0.45 mol。]
5.如图为浓硫酸与铜片反应的装置。请回答下列问题:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法,不正确的是 (选填字母)。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04 mol溶质的浓硫酸与足量的铜片反应,能收集到448 mL的SO2(标准状况)
[解析] (1)浓硫酸与铜片反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)反应中生成的SO2具有漂白性,能使品红溶液褪色或红色变浅。(3)A项,该反应中浓硫酸被还原为SO2,同时生成CuSO4,则浓硫酸体现了酸性和强氧化性,错误;B项,SO2是酸性有毒的气体,用含有碱液的棉花吸收过量的SO2,防止环境污染,正确;C项,因有CuSO4生成,其水溶液显蓝色,正确;D项,随着反应的进行,浓硫酸的浓度减小,而稀硫酸与铜不反应,所以含0.04 mol溶质的浓硫酸不可能完全反应,则收集到的SO2气体的体积小于448 mL (标准状况),错误;答案选AD。
[答案] (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (2)品红溶液褪色或红色变浅 (3)AD
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质导学案: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质导学案,共18页。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第二课时学案: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第二课时学案,共12页。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时导学案: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第2课时导学案,共12页。学案主要包含了硫酸的工业制备,浓硫酸的性质 硫酸盐等内容,欢迎下载使用。













