
【最新版】初中升高高中化学衔接课程讲义专题14 物质的量在化学方程式计算中的应用
展开专题14 物质的量在化学方程式计算中的应用
【知识回放】
初中阶段有关方程式的计算,用到的物理量为质量,例如以下相关计算:
6.5g的锌粒与足量的稀盐酸反应,产生的氢气为多少克?
【新知精讲】
一、物质的量在化学方程式计算中的应用
以钠和水反应的化学方程式为例:
2Na + 2H2O===2NaOH+H2↑
化学计量数 2 2 2 1
扩大NA倍 2×NA 2×NA 2×NA 1×NA
物质的量 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中各物质的化学计量数之比=参加反应的物质的微粒个数之比=参加反应的物质的物质的量之比=参加反应的物质的气体体积(相同状况)之比。
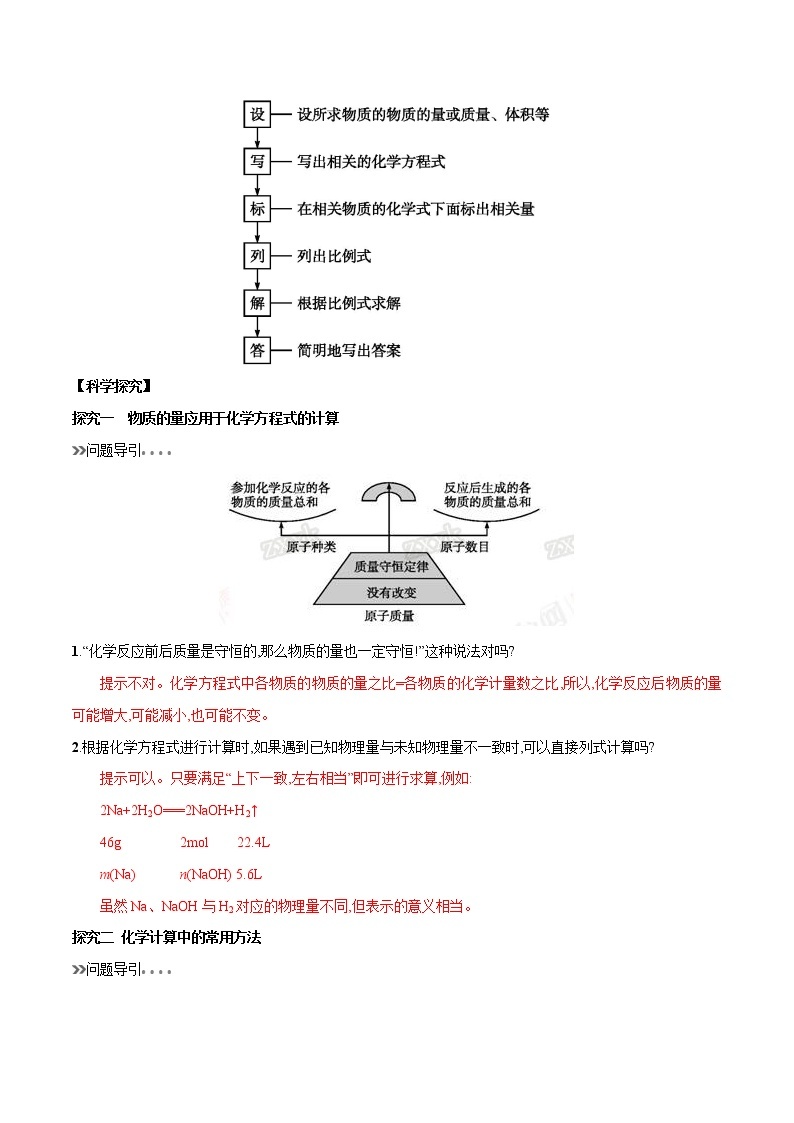
二、根据化学方程式进行计算的基本步骤
【科学探究】
探究一 物质的量应用于化学方程式的计算
问题导引
1.“化学反应前后质量是守恒的,那么物质的量也一定守恒!”这种说法对吗?
提示不对。化学方程式中各物质的物质的量之比=各物质的化学计量数之比,所以,化学反应后物质的量可能增大,可能减小,也可能不变。
2.根据化学方程式进行计算时,如果遇到已知物理量与未知物理量不一致时,可以直接列式计算吗?
提示可以。只要满足“上下一致,左右相当”即可进行求算,例如:
2Na+2H2O===2NaOH+H2↑
46g 2mol 22.4L
m(Na) n(NaOH) 5.6L
虽然Na、NaOH与H2对应的物理量不同,但表示的意义相当。
探究二 化学计算中的常用方法
问题导引
1.工业制备硫酸的反应是:4FeS2+11O2===2Fe2O3+8SO2,2SO2+O2===2SO3,SO3+H2O===H2SO4,找出FeS2与H2SO4的关系式。
提示方法一:根据化学方程式4FeS2~8SO2~8SO3~8H2SO4,即FeS2~2H2SO4。
方法二:由硫元素守恒得,FeS2~2H2SO4。
2.将质量为100 g的铁棒插入1 L 0.5 mol·L-1的CuSO4溶液中,足够长的时间后,铁棒的质量将变为多少?
提示 可以采用差量法。
设铁棒增重m,则
Fe+CuSO4===FeSO4+Cu Δm
56g 1mol 64g 8g
1L×0.5mol·L-1 m
m==4g[来源:学科网]
故铁棒质量变为100g+4g=104g
【重点突破】
1.有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。
(2)符号规范:
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量时就写成:m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
2.物质的量在化学方程式计算中应用的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积表示,但要注意物质的量与其他各物理量之间的换算关系;只要做到“上下一致,左右相当”即可。
3.化学计算常用的方法
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
①根据化学方程式确定关系式:写出发生反应的化学方程式,根据量的关系写出关系式。
如:把CO还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量。
发生反应的化学方程式:3CO+Fe2O32Fe+3CO2,CO2+Ca(OH)2===CaCO3↓+H2O。
则关系式为3CO~3CO2~3CaCO3,即CO~CaCO3。
②根据原子守恒确定关系式:上述例子中也可直接根据碳原子守恒得出CO~CaCO3。
(2)守恒法[来源:学科网ZXXK]
(3)差量法
根据反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,该差量的大小与反应物的有关量成正比关系。差量法就是借助这种比例关系,解决一定量变的计算方法。
如Fe+CuSO4===Cu+FeSO4 固体质量增加
56 g 64 g 64 g-56 g=8 g
x m g
则 56g/8g=x/mg x=7m g。
【典题探究】
典例1
把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后溶液中c(HCl)变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
变式训练1-1
在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液中NaOH的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1
C.1.5 mol·L-1 D.3 mol·L-1
变式训练1-2
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
变式训练1-3 (双选)
标准状况下,3.25 g锌与足量的盐酸反应生成a L氢气,下列比例式正确的是( )
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g a L
B.Zn+2HCl===ZnCl2+H2↑
65 g 1 L[来源:学§科§网Z§X§X§K]
3.25 g a L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 22.4 L
0.05 mol a L
D.Zn+2HCl===ZnCl2+H2↑
65 g 22.4 L
3.25 g a L
变式训练1-4
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)Al的物质的量;
(2)参加反应的NaOH的物质的量和溶液中NaOH的物质的量浓度;
(3)在标准状况下生成H2的体积。
典例2
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1 C.3∶4 D.4∶3
变式训练2-1
若18 g某金属与足量盐酸充分反应,放出22.4 L(标准状况)H2,则该金属是( )
A.Al B.Mg C.Fe D.Zn
变式训练2-2
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol[来源:学科网]
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol H2
变式训练2-3
1 L混合溶液中含有SO42-0.25 mol,Cl- 0.75 mol,Na+ 0.25 mol,其余为H+,则H+的物质的量浓度为( )
A.2.5 mol·L-1 B.5 mol·L-1 [来源:学+科+网]
C.0.1 mol·L-1 D.1 mol·L-1
【最新版】初中升高高中化学衔接课程讲义专题25 硝酸的氧化性: 这是一份【最新版】初中升高高中化学衔接课程讲义专题25 硝酸的氧化性,文件包含专题25硝酸的氧化性-初升高化学衔接精品专题解析版doc、专题25硝酸的氧化性-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共12页, 欢迎下载使用。
【最新版】初中升高高中化学衔接课程讲义专题24 浓硫酸的特性: 这是一份【最新版】初中升高高中化学衔接课程讲义专题24 浓硫酸的特性,文件包含专题24浓硫酸的特性-初升高化学衔接精品专题解析版doc、专题24浓硫酸的特性-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共13页, 欢迎下载使用。
【最新版】初中升高高中化学衔接课程讲义专题23 氨: 这是一份【最新版】初中升高高中化学衔接课程讲义专题23 氨,文件包含专题23氨-初升高化学衔接精品专题解析版doc、专题23氨-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。