




【最新版】初中升高高中化学衔接课程讲义专题11 氧化剂和还原剂
展开【知识回放】
1.指出下列反应的还原剂、氧化剂、氧化产物和还原产物。
(1)MnO2 + 4HCl=MnCl2 + Cl2↑+ 2H2O
(2)2H2S + SO2 =3S ↓ + 2H2O
(3) 2KClO3 =2KCl +3O2 ↑
2.化合价规则:
(1)在化合物中,各元素正、负化合价的代数和为 ;在单质中,元素的化合价为 。
(2)金属元素没有 ,非金属元素可以显正价,也可以显负价。
3.判断:
(1)非金属单质只具有氧化性( )
(2)金属阳离子只具有氧化性,不具有还原性( )[来源:Zxxk.Com]
(3)金属元素的原子失去电子的数目越多,该金属的还原性越强( )
(4)元素的价态越高,物质的氧化性越强( )
(5)某元素从化合态到游离态,则该元素一定被氧化( )
4.在一个反应中,氧化剂和还原剂的物质的量一定相等吗?
5.金属阳离子一定只有氧化性吗?
6.Fe2+具有较强的还原性,Fe3+具有较强的氧化性,二者之间能反应吗?为什么?
【答案】1、(1)氧化剂:MnO2 还原剂:HCl 还原产物:MnCl2 氧化产物:Cl2
(2)还原剂:H2S 氧化剂:SO2 S既是氧化产物又是还原产物
(3)KClO3 既是氧化剂又是还原剂 还原产物:KCl 氧化产物:O2
2.化合价规则:
(1)零 零
(2)负价
3.判断:
(1)× (2)× (3) × (4) × (5)×
4、在一个反应中氧化剂得电子数与还原剂失电子数相等,但氧化剂和还原剂的物质的量不一定相等。
5、金属阳离子可能有还原性,如Fe2+
6、Fe2+ 具有还原性,Fe3+具有氧化性,但二者无中间价态,无法发生氧化还原反应。
【新知精讲】
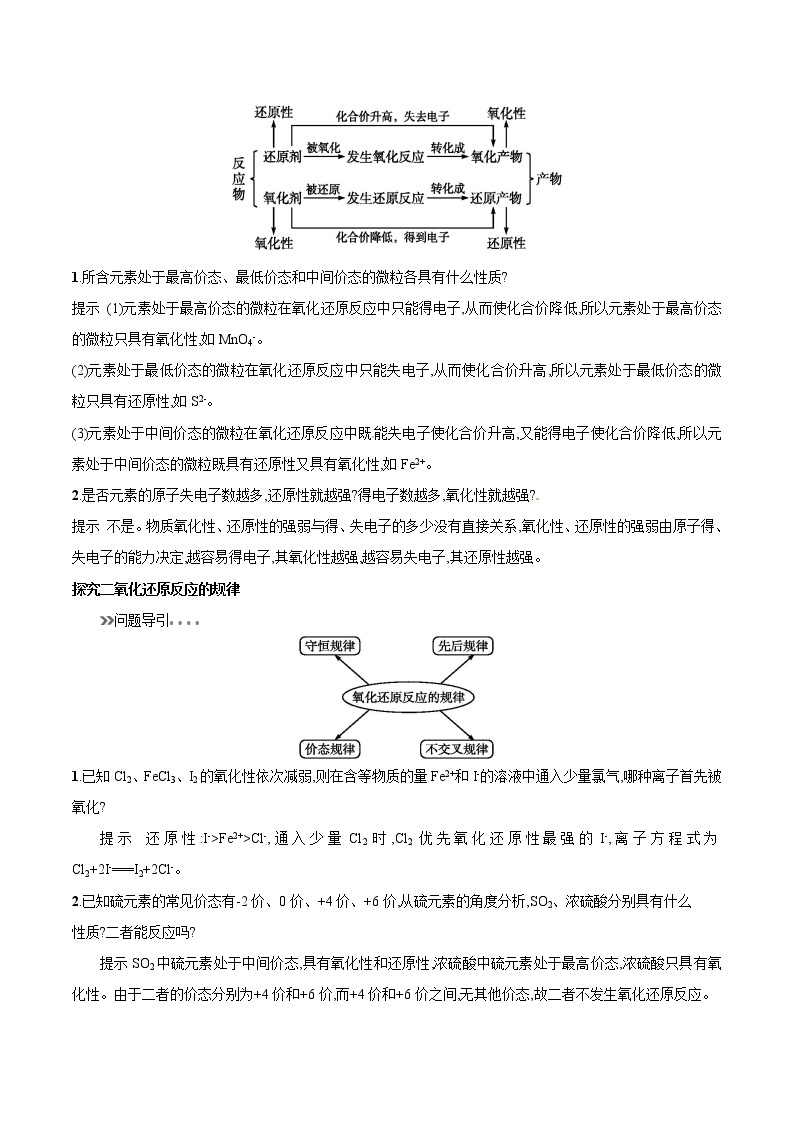
一、氧化剂和还原剂
1.氧化剂。
(1)定义:氧化还原反应中得到电子(或电子对偏向)的物质叫作氧化剂。
(2)发生的变化:氧化还原反应中氧化剂所含元素的化合价降低,发生还原反应,表现氧化性。
2.还原剂。
(1)定义:氧化还原反应中失去电子(或电子对偏离)的物质叫作还原剂。
(2)发生的变化:氧化还原反应中还原剂所含元素的化合价升高,发生氧化反应,表现还原性。
3.常见的氧化剂和还原剂
常见的还原剂 | 常见的氧化剂 |
1.活泼金属单质:Na、Mg、Al、Ca等 | 1.活泼非金属单质:Cl2、O2等 |
2.易使电子对偏离的物质如H2、C、CO等 | 2.含高价态元素的化合物,如H2SO4(浓)、KMnO4、HNO3、MnO2等 |
3.非金属离子(含较低价态元素的化合物),如S2-、I-、Br-等 | 3.某些高价态的金属离子,如Fe3+、Cu2+、Ag+等 |
4.低价态的阳离子:Fe2+、Sn2+等 |
|
二、氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出得电子的性质;
(2)还原性:还原剂所表现出失电子的性质。
2.氧化性、还原性和元素化合价之间的关系
三、氧化还原反应的影响
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利:易燃物的自燃、食物的腐败、钢铁的锈蚀等。
【科学探究】
探究一物质氧化性、还原性强弱的判断
问题导引
1.所含元素处于最高价态、最低价态和中间价态的微粒各具有什么性质?
提示 (1)元素处于最高价态的微粒在氧化还原反应中只能得电子,从而使化合价降低,所以元素处于最高价态的微粒只具有氧化性,如MnO4-。
(2)元素处于最低价态的微粒在氧化还原反应中只能失电子,从而使化合价升高,所以元素处于最低价态的微粒只具有还原性,如S2-。
(3)元素处于中间价态的微粒在氧化还原反应中既能失电子使化合价升高,又能得电子使化合价降低,所以元素处于中间价态的微粒既具有还原性又具有氧化性,如Fe2+。
2.是否元素的原子失电子数越多,还原性就越强?得电子数越多,氧化性就越强?
提示 不是。物质氧化性、还原性的强弱与得、失电子的多少没有直接关系,氧化性、还原性的强弱由原子得、失电子的能力决定,越容易得电子,其氧化性越强,越容易失电子,其还原性越强。
探究二氧化还原反应的规律
问题导引
[来源:学科网ZXXK]
1.已知Cl2、FeCl3、I2的氧化性依次减弱,则在含等物质的量Fe2+和I-的溶液中通入少量氯气,哪种离子首先被氧化?
提示 还原性:I->Fe2+>Cl-,通入少量Cl2时,Cl2优先氧化还原性最强的I-,离子方程式为Cl2+2I-===I2+2Cl-。
2.已知硫元素的常见价态有-2价、0价、+4价、+6价,从硫元素的角度分析,SO2、浓硫酸分别具有什么
性质?二者能反应吗?
提示SO2中硫元素处于中间价态,具有氧化性和还原性,浓硫酸中硫元素处于最高价态,浓硫酸只具有氧化性。由于二者的价态分别为+4价和+6价,而+4价和+6价之间,无其他价态,故二者不发生氧化还原反应。
【重点突破】
1. 物质氧化性、还原性强弱的比较方法
(1)根据氧化还原反应方程式比较。
(2)根据元素的活动性顺序。
特点:上左下右可反应,隔之愈远愈易行。
(3)根据氧化还原反应的程度比较。
不同氧化剂与相同还原剂作用时,还原剂被氧化的程度越大,氧化剂的氧化性越强。
例如:[来源:学科网ZXXK]
(4)根据反应的条件及反应的剧烈程度比较。
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。例如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O、
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O,氧化性:KMnO4>MnO2。
2. 氧化还原反应的基本规律
(1)守恒规律。
氧化还原反应中,氧化剂和还原剂得失电子总数相等,元素化合价升降总数相等,反应前后电荷总数相等(离子反应)。
(2)强弱规律。
应用:物质间氧化性(或还原性)的强弱比较或判断氧化剂与有还原性的物质在一定条件下能否发生反应。
(3)先后规律。
①同一氧化剂与多种还原剂混合,还原性强的先被氧化。②同一还原剂与多种氧化剂混合,氧化性强的先被还原。[来源:学_科_网Z_X_X_K]
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
(4)价态规律。
①高低规律: 元素最高价态:只有氧化性。
元素中间价态:既有氧化性又有还原性。
元素最低价态:只有还原性。
应用:判断元素或物质的氧化性、还原性。
②归中规律:
同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”,如:
3.应用电子守恒规律进行计算的一般步骤
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物; (2)找准一个原子或离子得失电子数(注意化学式中该种粒子的个数);
(3)根据题中物质的量和得失电子守恒列出等式:
n(氧化剂)×变价原子个数×化合价变化值(高价-低价)=n(还原剂)×变价原子个数×化合价变化值(高价-低价)。
【典例探究】
典例1
下列叙述正确的是( )
A.在氧化还原反应中,非金属单质一定是氧化剂
B.某元素从化合态变为游离态,该元素一定被还原
C.金属阳离子被还原不一定得到单质
D.氧化剂得到电子,发生了氧化反应
【答案】C
变式训练1-1
交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车。其原理是红色的重铬酸钾遇酒精后生成蓝绿色物质(Cr3+)。
下列说法正确的是( )
A.该变化为非氧化还原反应
B.重铬酸钾中铬元素的化合价为+3价
C.该反应的氧化剂为酒精
D.重铬酸钾在反应中为氧化剂
【答案】D
【解析】由题中信息可知:铬元素从+6价降为+3价,得到电子,故重铬酸钾是氧化剂,被还原成Cr3+,酒精是还原剂,所以D正确。
变式训练1-2
从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中, 的还原性最强,在Cu2+、Fe2+、Ag+中, 的氧化性最强。
(2)铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中, 具有氧化性, 的氧化性最强。
【答案】(1)Fe Ag+ (2)Cl2、H+ Cl2
(2)发生反应的两个化学方程式为
①2Fe+3Cl2===2FeCl3;②Fe+2HCl===FeCl2+H2↑
可知Cl2将Fe氧化为Fe3+,而HCl将Fe氧化为Fe2+,所以Cl2、H+有氧化性,且Cl2氧化性强。
变式训练1-3
根据下面两个离子方程式:
①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
【答案】B
【解析】反应①中还原剂是I-,还原产物是Fe2+,故还原性:I->Fe2+;反应②中还原剂是Fe2+,还原产物是Br-,故还原性:Fe2+>Br-,所以还原性强弱顺序为I->Fe2+>Br-。
典例2
24 mL 0.05 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2价 B.+3价
C.+4价 D.+5价
【答案】B
变式训练2-1
现有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓)===2KCl+2MnCl2
+5Cl2↑+8H2O
针对上述两个反应回答:
(1)氧化剂的氧化性强弱顺序为 ,还原剂的还原性强弱顺序为 。
(2)反应①中氧化产物和还原产物质量之比为 。
(3)反应②中氯化氢表现出的性质是 。
A.还原性 B.酸性 C.氧化性
【答案】(1)KMnO4>Cl2 SO2>Cl- (2)98∶73 (3)AB
【解析】(1)由反应①知氧化性:Cl2>H2SO4,还原性:SO2>Cl-,由反应②知氧化性:KMnO4>Cl2,还原性:Cl->Mn2+。
(2)在反应①中氧化产物为H2SO4,还原产物为HCl,其质量之比为98∶73。
(3)在反应②中HCl被氧化为Cl2,表现了还原性,同时还生成了盐和水,表现了酸性。
变式训练2-2
已知下列三个化学反应:
①Fe+CuSO4=FeSO4+Cu
②Cl2+2NaBr=2NaCl+Br2 ③2FeCl3+Fe=3FeCl2
则下列说法不正确的是( )
A.氧化性:Cl2>Br2
B.氧化性:Fe2+>Cu2+
C.还原性:Fe>Fe2+
D.氧化性:Fe3+>Fe2+
【答案】B
变式训练2-3
已知:
①2NaA+B2===2NaB+A2;②2NaA+C2===2NaC+A2;③2NaB+C2===2NaC+B2;④2NaC+D2===2NaD+C2。
则氧化性由强到弱的顺序是( )
A.A2>B2>C2>D2
B.B2>A2>C2>D2
C.C2>B2>A2>D2
D.D2>C2>B2>A2
【答案】D
【解析】本题考查的是氧化还原反应中氧化性的强弱规律,即氧化剂的氧化性强于氧化产物的氧化性。比较各物质氧化性强弱,由①可知:B2>A2,由②可知:C2>A2,由③可知:C2>B2,由④可知:D2>C2,综上所述,D选项正确。
变式训练2-4
按要求填空。
(1)在S2-、Fe2+、Mg2+、S、I-、H+中,[来源:学§科§网]
①只有氧化性的是 , ②只有还原性的是 , ③既有氧化性又有还原性的是 。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3N2O3+H2O ②NH3+NOHNO2+H2O ③N2O4+H2OHNO3+HNO2
其中你认为一定不可能实现的是 。
【答案】(1)①Mg2+、H+ ②S2-、I- ③Fe2+、S (2)②
【最新版】初中升高高中化学衔接课程讲义专题25 硝酸的氧化性: 这是一份【最新版】初中升高高中化学衔接课程讲义专题25 硝酸的氧化性,文件包含专题25硝酸的氧化性-初升高化学衔接精品专题解析版doc、专题25硝酸的氧化性-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共12页, 欢迎下载使用。
【最新版】初中升高高中化学衔接课程讲义专题24 浓硫酸的特性: 这是一份【最新版】初中升高高中化学衔接课程讲义专题24 浓硫酸的特性,文件包含专题24浓硫酸的特性-初升高化学衔接精品专题解析版doc、专题24浓硫酸的特性-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共13页, 欢迎下载使用。
【最新版】初中升高高中化学衔接课程讲义专题23 氨: 这是一份【最新版】初中升高高中化学衔接课程讲义专题23 氨,文件包含专题23氨-初升高化学衔接精品专题解析版doc、专题23氨-初升高化学衔接精品专题原卷版doc等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。












