





2020-2021学年到实验室去:氧气的实验室制取与性质课前预习课件ppt
展开电解水液态空气的分离(工业上)上述方法不适合在实验室制取氧气,因为:要消耗电能;操作复杂,条件高不易控制
下列哪些物质可能产生氧气? 依据是什么?
1、食盐(主要成分为NaCl)2、过氧化氢( H2O2)3、氧化汞 ( HgO )4、高锰酸钾(KMnO4)5、氯酸钾(KClO3)6、甲烷(CH4)7、水 ( H2O )
一.实验室制取气体物质的思路
1.选择反应物(经济易得,价格低廉)2.如何控制反应条件(简单,易控制)3.确定反应装置(简单易组装,省药品)4.确定收集装置(由气体性质决定)5.看整个反应是否环保、安全
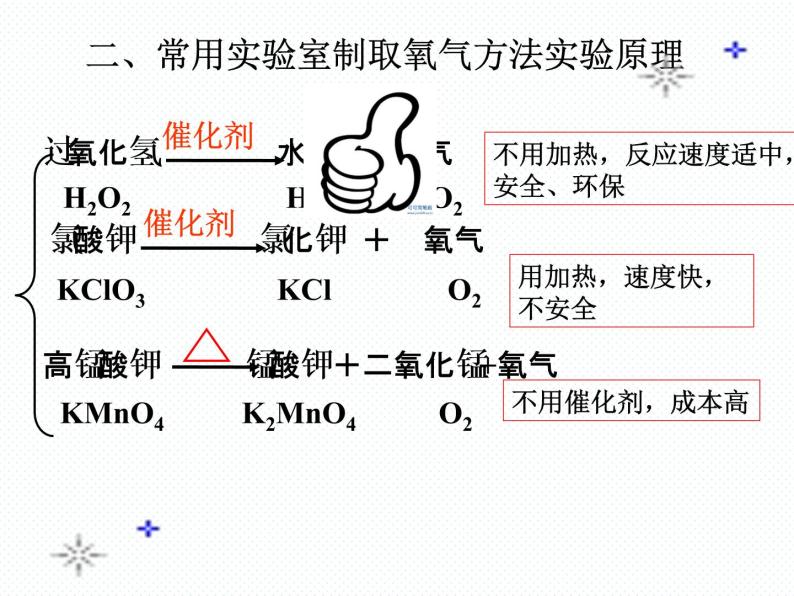
(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,成本较高。(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。(3)H2O2过氧化氢又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。 (4)HgO氧化汞是一种红色粉末,加热时能产生氧气,同时产生有毒的物质汞。(5)H2O水在通电的条件下能产生氧气,成本高,反应速度太慢。
二、常用实验室制取氧气方法实验原理
过氧化氢 水 + 氧气
H2O2 H2O O2
氯酸钾 氯化钾 + 氧气
KClO3 KCl O2
高锰酸钾 锰酸钾 +二氧化锰+氧气
KMnO4 K2MnO4 O2
用加热,速度快,不安全
不用加热,反应速度适中,安全、环保
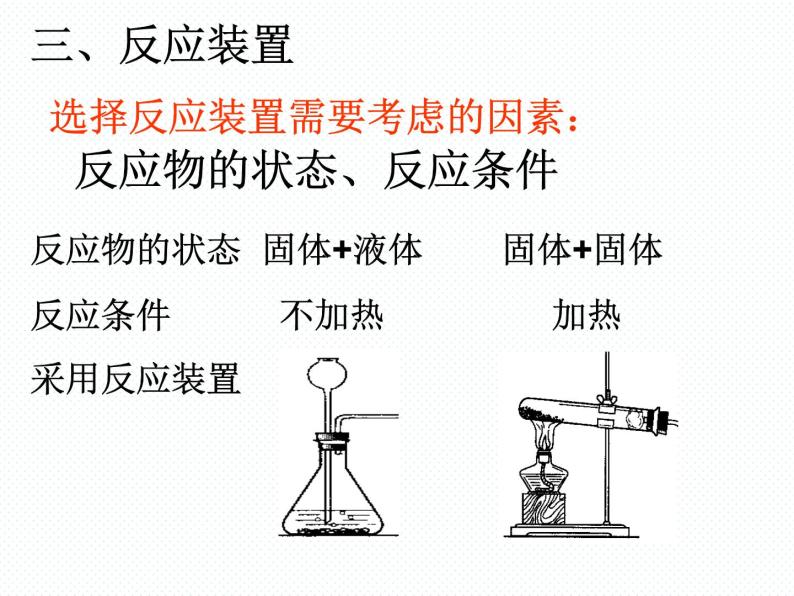
选择反应装置需要考虑的因素:
反应物的状态 固体+液体 固体+固体反应条件 不加热 加热采用反应装置
反应物的状态、反应条件
选择收集装置需要考虑的因素:
气体的水溶性、气体的密度
观察: 向三支试管中分别倒入过氧化氢溶液,仔细观察是否有气泡产生以及产生的速率,将带火星的木条伸入三支试管的试管口,观察哪个能够复燃。
二氧化锰 碎瓷片
获得结论:最适合在实验室制取氧气的方法是
小资料1、将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变2、将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
能够改变其他物质的化学反应速率,本身的质量和化学性质在反应前后不变的物质叫做催化剂。
过氧化氢 水 + 氧气
H2O2 H2O O2
实验室制取氧气的发生装置
小资料 通常状况下,氧气不易溶于水,且不与水反应;在 0℃,1个标准大气压下,其密度为1.429g/L,空气的密度为1.293g/L。
排水法 向上排空气法
动手实验:亲自动手组装仪器,并收集一瓶气体,感受一下亲自动手的乐趣,操作步骤如下:
组装并检查装置的气密性
实验中的注意事项1、实验前应首先检查装置的气密性;2、长颈漏斗应没入液面以下,导管刚露出橡皮塞即可;3、当导管口有连续均匀的气泡产生时,再收集气体;4、取出后的集气瓶应正放。
讨论交流:1.如何检验一瓶气体就是氧气呢?2.如何验满呢?
检验方法: 将带火星的木条放在集气瓶内,如果木条复燃,则说明该气体就是氧气。
验满方法: 将带火星的木条放在集气瓶口,如果木条复燃,则说明氧气已经满了。
实验室也可以用加热高锰酸钾,或加热氯酸钾与二氧化锰(催化剂)的方法制取氧气。
氯化钾 + 氧气
根据反应原理,我们应该怎样组装仪器?
1、 下列关于催化剂的说法正确的是( ) A.二氧化锰是催化剂。 B.催化剂能加快化学反应速率,增加生成物的质量。 C.没有催化剂,过氧化氢就不能产生氧气。 D.在过氧化氢制氧气的反应中,二氧化锰起催化作用
2、一氧化氮在常温下是一种难溶于水的气体,密度比空气略大;它在空气中能跟氧气迅速反应生成二氧化氮。现要收集一氧化氮气体可采用的方法是( )A.向上排空气法。 B.排水法。C.排水法或向上排空气法。D.排水法或向下排空气法。
实验室制取氧气的实验步骤:(1)连接装置,检查____________;(2)向锥形瓶中加入__________;(3)塞好带有长颈漏斗和导气管的橡皮塞;(4)向长颈漏斗中加入___________; (5)等导管口有___________产生时,再收集一瓶氧气。
通过本节课的学习,你有什么和同学们交流的吗?
初中鲁教版 (五四制)到实验室去:氧气的实验室制取与性质教课ppt课件: 这是一份初中鲁教版 (五四制)<a href="/hx/tb_c77245_t3/?tag_id=26" target="_blank">到实验室去:氧气的实验室制取与性质教课ppt课件</a>,共10页。PPT课件主要包含了内容提要,氧气的化学性质,氧气的制取,二氧化锰,实验原理,连接装置,实验步骤,盛装药品,收集气体,发红2放热等内容,欢迎下载使用。
初中化学鲁教版 (五四制)八年级全册到实验室去:氧气的实验室制取与性质教课内容课件ppt: 这是一份初中化学鲁教版 (五四制)八年级全册<a href="/hx/tb_c77245_t3/?tag_id=26" target="_blank">到实验室去:氧气的实验室制取与性质教课内容课件ppt</a>,共13页。PPT课件主要包含了本课内容,实验探究,实验结论,MnO2,二氧化锰,练习强化等内容,欢迎下载使用。
初中化学鲁教版 (五四制)八年级全册到实验室去:氧气的实验室制取与性质教学演示ppt课件: 这是一份初中化学鲁教版 (五四制)八年级全册<a href="/hx/tb_c77245_t3/?tag_id=26" target="_blank">到实验室去:氧气的实验室制取与性质教学演示ppt课件</a>,共15页。PPT课件主要包含了发生装置,反应物状态和反应条件,固液常温型,收集装置,动脑想一想,淄博市怎样出题,怎样出题等内容,欢迎下载使用。













