初中化学北京课改版九年级下册第二节 金属的化学性质教案设计
展开课题2 金属的化学性质
教学目标
(一)知识与技能
1、知道铁、铝、铜等常见金属与氧气的反应。
2、初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
3、能用金属活动性顺序对有关的置换反应进行简单判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
(二)过程与方法
1、 认识科学探究的基本过程,能进行初步的探究活动。
2、 课堂中,教师组织、引导和点拔,学生通过实验探究和讨论交流,认识金属的化学性质及其活动性顺序。
3、 初步学会运用观察、实验等方法获取信息,并能用图表和化学语言表达有关的信息。
4、初步学会运用比较、归纳、概括等方法对获取的信息进行加工,使学生逐步形成良好学习习惯和方法。
(三)情感态度与价值观
1、 通过对五彩纷呈的化学现象的观察,激发学生的好奇心和求知欲,发展学习化学的兴趣。
2、培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
3、了解化学与日常生活和生产的密切关系,提高学生解决实际问题的能力。
4、在有趣的实验与老师的点拨中轻松掌握化学知识,体验到学习的快乐。
教学重点
金属活动性顺序。
教学难点
对金属活动性顺序的初步探究及利用金属活动性顺序对置换反应的判断。
教学方法
问题情景→实验探究→得出结论→练习巩固→联系实际。
教学准备
教师:制作多媒体课件
学生用具:镁条、铝片、铜片、酒精灯、坩埚钳、火柴、砂纸、稀HCl、稀H2SO4、硝酸银溶液、硫酸铜溶液、硫酸铝溶液、铝丝、铜丝、镁条、锌粒、铜片、铁钉、砂纸、火柴、试管(若干)。
课时安排 2课时
教学过程
教师活动 | 学生活动 | ||||||||||||||||||||||||||||||||||||||||||
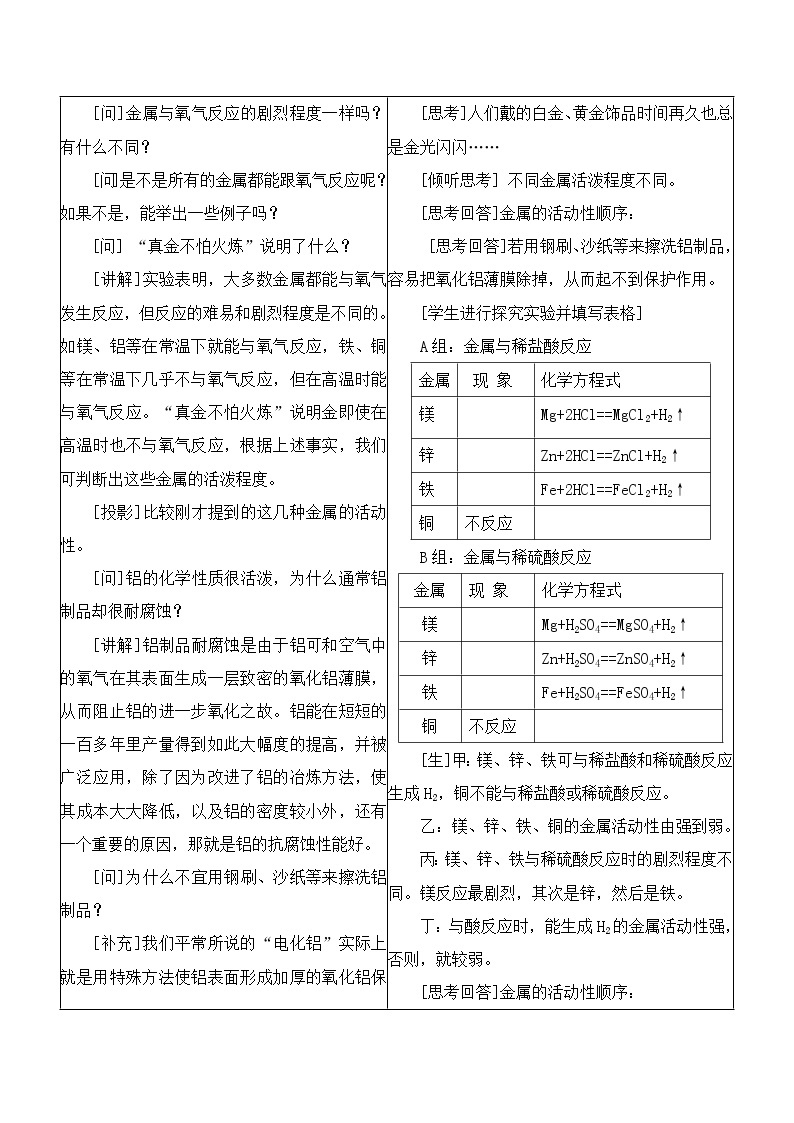
[引言]要想更好地使用金属,就需了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。 [问]大家观察桌面上的镁条、铝片、铜片分别是什么颜色的? [问]把这些金属分别在空气中加热,会有什么现象发生?大家动手做这个实验。 请大家写出以上反应的化学方程式 请一个同学到黑板上来写 [板书]一、金属与氧气的反应 [问]铁在纯氧中点燃能反应吗?若能,写出反应的化学方程式。 [问]根据上面的反应,我们可得出金属具有什么样的化学性质? [小结] 金属与氧气发生化学反应,生成相应的金属氧化物。 [板书]金属+氧气→金属氧化物 [问]金属与氧气反应的剧烈程度一样吗?有什么不同? [问]是不是所有的金属都能跟氧气反应呢?如果不是,能举出一些例子吗? [问] “真金不怕火炼”说明了什么? [讲解]实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。“真金不怕火炼”说明金即使在高温时也不与氧气反应,根据上述事实,我们可判断出这些金属的活泼程度。 [投影]比较刚才提到的这几种金属的活动性。 [问]铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀? [讲解]铝制品耐腐蚀是由于铝可和空气中的氧气在其表面生成一层致密的氧化铝薄膜,从而阻止铝的进一步氧化之故。铝能在短短的一百多年里产量得到如此大幅度的提高,并被广泛应用,除了因为改进了铝的冶炼方法,使其成本大大降低,以及铝的密度较小外,还有一个重要的原因,那就是铝的抗腐蚀性能好。 [问]为什么不宜用钢刷、沙纸等来擦洗铝制品? [补充]我们平常所说的“电化铝”实际上就是用特殊方法使铝表面形成加厚的氧化铝保护层的铝制品。 [过渡]很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度。下面,我们就通过实验来比较镁、锌、铁、铜与稀酸的反应。 二、金属与盐酸、稀硫酸的反应 [投影展示活动与探究内容] 在试管里放入两小块镁,加入5mL稀盐酸,用燃着的小木条放在试管中,观察现象,并判断反应后生成了什么气体。 参照上述实验步骤,分别在放有两小块锌、铁、铜的试管中加入稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断生成的是什么气体。 用稀硫酸代替稀盐酸进行实验,并比较发生的现象。 [安排]第一组和第三组做金属与稀盐酸反应,第二组和第四组做金属与稀硫酸反应 [请一位同学上黑板写出反应的化学方程式,现象可由学生口述] [问]通过以上实验,你得出的结论是什么? [评价]大家回答得都很好。 [指导阅读]欣赏课本图金属与盐酸反应的比较 [小结] 金属与酸发生化学反应,生成金属化合物和氢气。 [板书]金属+酸→金属化合物+氢气 [投影]比较刚才实验中用到的这几种金属的活动性 [过渡]大家观察这几个化学方程式 [投影] Mg+2HCl==MgCl2+H2↑ Zn+H2SO4==ZnSO4+H2↑ Fe+H2SO4==FeSO4+H2↑ [问]请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?它与我们学过的化合反应和分解反应的特点是否相同? [师]回答得很好。化学上,我们把具有这一特点的反应叫做置换反应。 [板书]置换反应 [讲解]由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。 [过渡]我们还有没有其他的办法来证明不同金属活动性的相对强弱呢? [问]大家还记得铁钉与硫酸铜溶液的反应吗?能不能写出反应的化学方程式? [讲解]铁比铜活泼,所以铁可以把铜从硫酸铜溶液中置换出来。 [投影]活动性强的金属能把活动性弱的金属从它们的化合物中置换出来。 [过渡]下面,我们通过此结论来探究铝、铜、银三种金属的活动性顺序。 [投影展示活动与探究的内容] 1.把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会儿取出,观察,有什么现象发生? 2.把一根洁净的铜丝浸入硝酸银溶液中,过一会儿取出,观察,有什么现象发生? 3.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会儿取出,观察,有什么现象发生? [问]通过这几个实验你可分别得出什么结论?能否据此得出铝、铜、银的金属活动性顺序? [小结] 金属与金属化合物溶液发生化学反应,生成新的金属化合物和新金属。 [板书]金属+金属化合物→新金属化合物+新金属 [投影]比较刚才实验中用到的这三种金属的活动性 [讲解]经过了许多类似上述实验的探究过程,人们进行了认真的去伪存真,由表及里的分析,归纳和总结出了常见金属在溶液中的活动性顺序: [板书]三、金属活动性顺序 [投影并讲解]金属活动性顺序在工农业生产和科学研究中有重要应用,它可以给你以下一些判断的依据: 1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。 2、 在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3、 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。 [投影练习]下列物质能否发生反应?写出能发生反应的化学方程式并判断它们是否为置换反应。 (1)银与稀盐酸 (2)锌与硫酸铜溶液 (3)铜与硫酸锌溶液 (4)铝与硝酸银溶液 思考题1:波尔多液是一种农业上常用的杀菌剂,它是由硫酸铜、石灰加水配制而成,为什么不能用铁制容器来配制波尔多液? 思考题2:黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜冒充黄金进行欺诈活动。黄铜(铜锌合金)与黄金的外观很相似,我们可用什么办法来鉴别它们呢? [小结]通过本课题的学习,我们知道了多数金属能与氧气反应,且不同金属的活动性各不相同。根据金属与酸或金属与另一种金属化合物的反应,可判断出金属活动性的相对强弱。我们也了解了几种常见金属的活动性顺序。同时,我们也认识了一种新的反应类型──置换反应。
| [学生观察] 镁条、铝片具有银白色的金属光泽,铜片具有紫红色的金属光泽。 [实验]分别把镁条、铝片、铜片用砂纸打磨后在空气中加热。 [观察]镁条在空气中剧烈燃烧;铝片表面失去光泽;铜片表面变黑。 [板演]2Mg+O22MgO 4Al+3O22Al2O3 2Cu+O22CuO [书写]3Fe+2O2Fe3O4 [思考回答]金属可与氧气发生化学反应。 [思考回答]不一样,镁在空气中可以燃烧,而铝、铜要在纯氧中才能燃烧;常温下,镁、铝等能与空气中的氧气反应,铁、铜要在高温下才能与氧气反应…… [思考]人们戴的白金、黄金饰品时间再久也总是金光闪闪…… [倾听思考] 不同金属活泼程度不同。 [思考回答]金属的活动性顺序: [思考回答]若用钢刷、沙纸等来擦洗铝制品,容易把氧化铝薄膜除掉,从而起不到保护作用。 [学生进行探究实验并填写表格] A组:金属与稀盐酸反应
B组:金属与稀硫酸反应
[生]甲:镁、锌、铁可与稀盐酸和稀硫酸反应生成H2,铜不能与稀盐酸或稀硫酸反应。 乙:镁、锌、铁、铜的金属活动性由强到弱。 丙:镁、锌、铁与稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。 丁:与酸反应时,能生成H2的金属活动性强,否则,就较弱。 [思考回答]金属的活动性顺序: Mg>Zn>Fe>Cu [观察思考]这几个反应不属于化合反应,也不是分解反应,它们属于那种基本反应类型呢? [学生讨论后回答]这些反应的特点是:一种单质和一种化合物反应,生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 [回忆并写化学方程式] Fe+CuSO4=FeSO4+Cu [学生进行探究实验并填写表格]
[答]实验1说明铝的活动性强于铜。 实验2说明铜的活动性强于银。 实验3说明铜的活动性弱于铝。 [思考回答]金属的活动性顺序: Al>Cu>Ag [答案](1)(3)不反应;(2)(4)反应,且均为置换反应,化学方程式略。 [思考题答案]:因波尔多液中的硫酸铜要与铁反应:CuSO4+Fe==FeSO4+Cu,从而腐蚀铁制容器; [思考题2答案]:1、“真金不怕火炼”,用火烧一下,变黑的为黄铜,不变色的为黄金。2、能跟稀盐酸、稀硫酸反应的为黄铜,不反应的为黄金3、黄铜与黄金的密度不同,测一下它们的密度即可区别。4、黄铜与黄金的硬度不同,把它们互相刻画,硬度大的为黄铜,小的为黄金…… |
初中化学人教版九年级下册课题 2 金属的化学性质教案: 这是一份初中化学人教版九年级下册课题 2 金属的化学性质教案,共5页。教案主要包含了实验探究,课堂小结,板书设计等内容,欢迎下载使用。
北京课改版九年级下册第二节 金属的化学性质教案及反思: 这是一份北京课改版九年级下册第二节 金属的化学性质教案及反思,共4页。教案主要包含了考点例题分析,作业等内容,欢迎下载使用。
2020-2021学年第10章 金属第二节 金属的化学性质教学设计: 这是一份2020-2021学年第10章 金属第二节 金属的化学性质教学设计,共7页。教案主要包含了教学目标,教学重点,教学难点,合作交流,精讲点拨,有效训练等内容,欢迎下载使用。