




初中化学北京课改版九年级下册第10章 金属综合与测试复习ppt课件
展开1、知道常见的金属与氧气反应2、掌握金属与酸、盐溶液反应的规律,能判断金属与酸、盐溶液的置换反应;3、能根据实验的现象判断金属的活动性顺序或设计实验检验金属的活动性强弱。4、掌握金属冶炼的常用方法5、金属的腐蚀条件和保护措施
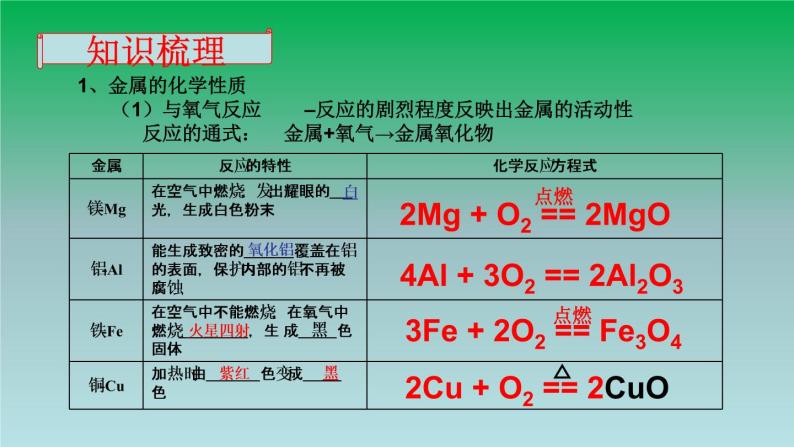
金 属 的 化 学 性 质
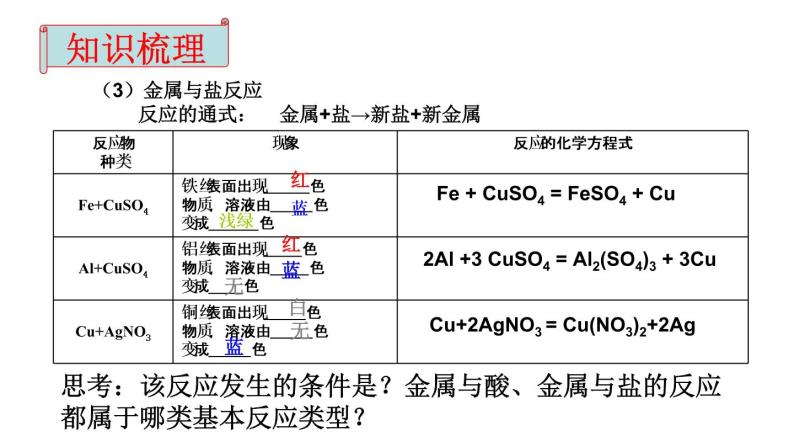
金属与金属化合物溶液反应
–反应的剧烈程度反映出金属的活动性
金属+氧气→金属氧化物
2Mg + O2 == 2MgO
4Al + 3O2 == 2Al2O3
3Fe + 2O2 == Fe3O4
2Cu + O2 == 2CuO
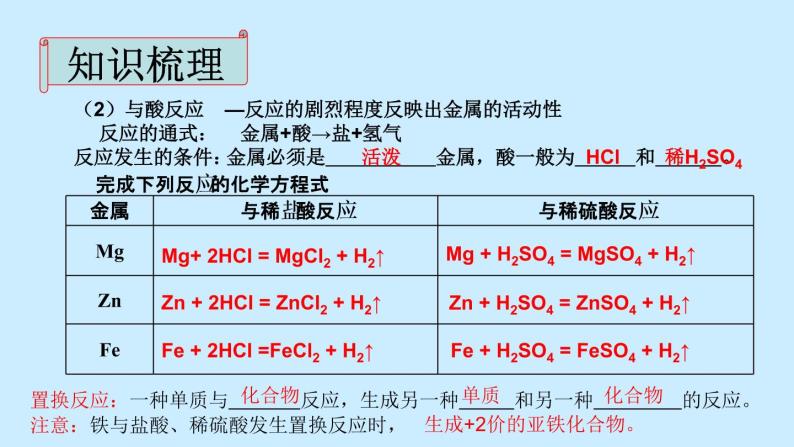
—反应的剧烈程度反映出金属的活动性
金属必须是 金属,酸一般为 和 。
完成下列反应的化学方程式
Zn + H2SO4 = ZnSO4 + H2↑
置换反应:一种单质与 反应,生成另一种 和另一种 的反应。注意:铁与盐酸、稀硫酸发生置换反应时,
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Mg+ 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl =FeCl2 + H2↑
生成+2价的亚铁化合物。
金属+盐→新盐+新金属
思考:该反应发生的条件是?金属与酸、金属与盐的反应都属于哪类基本反应类型?
Fe + CuSO4 = FeSO4 + Cu
2Al +3 CuSO4 = Al2(SO4)3 + 3Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
K Ca Na Sn Pb (H) Hg Pt Au
规律:a.在金属活动顺序里,金属位置 ,活动性越 ;b.在金属活动顺序里,位于 前面的金属能置换出 、 中的氢;c.在金属活动顺序里,位于 的金属能把位于 的金属从他们化合物溶液(该金属的盐溶液)中置换出来(其中K、Ca、Na除外)
金属活动性由强逐渐减弱
Mg Al Zn Fe
盐酸 稀硫酸
验证2种金属活动性的方法有:
①如都是氢前金属可比较与同种、等量、等浓度的酸反应时的剧烈程度; 如一种H前金属,另一种是H后金属,比较哪种金属能与酸反应。
②如金属能与盐溶液反应,证明该金属比盐中的金属活泼。
③如金属能与氧气反应,可比较反应的难易程度和剧烈程度。
讨论:如何设计实验验证金属活动性。
验证3种金属活动性的方法有:
1.先把三种金属按照活动性顺序由强到弱排列
2.选取① 中间金属,放入两边金属的盐溶液 或 ②两边金属,放入中间金属的盐溶液 进行实验
设计一个方案,判断三种金属Fe、Cu、Ag的活动性顺序
活动性: Fe>Cu>Ag
Fe、CuSO4溶液、Ag
FeCl2溶液、Cu、AgNO3溶液
金属的冶炼方法 大多数金属均用化学法提取,这些金属冶炼的本质是用还原剂使矿石发生还原反应(或加热使金属元素还原)。 具体有以下三种: (1)电解法 :适合冶炼金属活动性很强的金属,因为这类金属不能用一般的还原剂使其从化合物中还原出来,只能用通电分解其熔融盐或氧化物的方法来冶炼。 (2)热还原法 :该法可冶炼较活泼的金属,碳、一氧化碳、氢气、活泼金属等是常用的还原剂。 (3)热分解法 :该法可冶炼某些不活泼金属,仅用加热的方法就可以从矿石中得到。
实验室模拟铁的冶炼 整体装置图
回忆:金属的腐蚀与防护
铁既与水接触,又与氧气接触
铁生锈的条件:铁与氧气、水同时接触发生反应
讨论:防止金属腐蚀的方法
1.保持铁制品表面干燥和洁净 2.形成保护层 刷漆、涂油、烧制搪瓷、烤蓝、电镀(镀铬、锌、锡) 3.改变金属的内部结构,制成合金
1、下列物质与氧气反应的说法正确的是( )A、常温下,镁、铝能在空气中与氧气发生反应,故镁、铝在空气中极易被腐蚀B、铁在空气中燃烧火星四射,生成黑色固体C、铜在空气中加热会有黑色物质生成D、镁在空气中燃烧生成大量的白烟,发出黄色的光。
2、金属单质家庭四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示,则它们的活动性由强到弱的顺序是( ) X>W>Z>Y B. Z>X>W>Y C. W>X>Y>Z D. Y>Z>X>W
3、下列各组物质不能发生反应的是( ) A、镁与稀硫酸 B、锌与硫酸铜溶液 C、铝与硝酸银溶液 D、银与氯化铜溶液
4、下列各组物质能直接由酸反应得到的是( )A.氯化银【AgCl】 B.硫酸铜【CuSO4】C.氯化铁【FeCl3】 D.硫酸铝【Al2(SO4)3】
5、有甲、乙、丙、丁四种金属,将他们分别投入稀硫酸中,只有丙、丁的表面产生气泡,且丙产生的气泡比丁快;再将乙投入到甲的盐溶液中,乙的表面有甲析出。则四种金属的活动性顺序正确的是( )A、甲>乙>丙>丁 B、丙>丁>乙>甲 C、丙>丁>甲>乙 D、无法判断
6、下列可用于验证Fe、Cu、Ag三种金属活动性顺序的是( ) A Fe、Cu、H2SO4溶液 B Cu、Ag、FeSO4溶液 C Fe、Ag、CuSO4溶液 D Ag、FeSO4溶液、CuSO4溶液
7、实验探究题 某同学在实验室里发现一种外观为银白色的金属M,他产生了探究这种金属活动性的兴趣。在老师的指导下,对M、锌和铜三种金属的活动性顺序进行了探究。【查找资料】金属M的硫酸盐溶液是无色的。【提出猜想】猜想1:锌>铜>M猜想2:锌>M>铜猜想3: 。【实验探究】(1)实验前,要先将金属M用砂纸打磨表面,理由是: 。(2)将打磨后的金属M放入硫酸铜溶液中,现象是: 。说明金属活动性:M>铜(3)将打磨后的金属M和锌分别放入稀硫酸中,稀硫酸与金属M反应比与锌反应剧烈,说明金属活动性: 。【实验结论】猜想 是正确的
8、除杂题:填写下列表格(混合物栏中括号内为杂质)
Fe+2HCl = FeCl2+H2↑
Fe+CuCl2 = FeCl2+Cu
加适量盐酸至无气泡产生,过滤,洗涤,干燥
加适量无锈铁钉或铁粉,过滤
加适量氯化铜充分反应后,过滤,洗涤,干燥
思考:若加入CuSO4溶液或Cu(NO3)2溶液如何?
9、在AgNO3、Zn(NO3)2和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。根据上述现象,下列结论正确的是( )A.滤渣中一定有Zn B.滤渣中可能有Cu、AgC.滤液中一定有Zn(NO3)2、Fe(NO3)2 D.滤液中可能有AgNO3、 Cu(NO3)2
10、 已知:A、B、C、D、E、F是六种初中化学中常见的物质,其中A是黑色固体,B是无色无味的剧毒气体,C是紫红色金属单质。它们之间的转化关系如图,请回答:(1)写出B的化学式:______,C的一种用途______;(2)反应②的化学方程为: 。 (3)基本反应类型是: 。
化学北京课改版第9章 溶液综合与测试复习课件ppt: 这是一份化学北京课改版第9章 溶液综合与测试复习课件ppt,共25页。PPT课件主要包含了针对训练,有关溶液的计算,溶质的质量分数,溶质质量等内容,欢迎下载使用。
化学北京课改版第9章 溶液综合与测试复习ppt课件: 这是一份化学北京课改版第9章 溶液综合与测试复习ppt课件,共24页。PPT课件主要包含了学习目标,快速抢答,有关溶液的计算,心灵手巧,实验室之旅,第一站溶液的配制,知识小结一,知识小结二,第三站溶解度与结晶,思维导图等内容,欢迎下载使用。
北京课改版九年级下册第10章 金属综合与测试复习课件ppt: 这是一份北京课改版九年级下册第10章 金属综合与测试复习课件ppt,共13页。PPT课件主要包含了知识模块一金属材料,知识点一,金属的物理性质,活动合作探究,活动五生锈之谜等内容,欢迎下载使用。













