高中化学人教版 (2019)选择性必修2第一节 共价键第1课时导学案及答案
展开[核心素养发展目标] 1.能从微观角度理解共价键的极性和分子极性的关系。2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
一、键的极性和分子的极性
1.共价键的极性
2.分子的极性
(1)极性分子与非极性分子
(2)共价键的极性与分子极性的关系
1.回答下列问题
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN ⑨H2O ⑩NH3
⑪BF3 ⑫CH4 ⑬SO3 ⑭CH3Cl ⑮Ar ⑯H2O2
(1)只含非极性键的是________;只含极性键的是______,既含极性键又含非极性键的是________。
(2)属于非极性分子的是__________,属于极性分子的是________。
答案 (1)①②④⑤ ③⑥⑧⑨⑩⑪⑫⑬⑭ ⑦⑯
(2)①②④⑤⑥⑦⑪⑫⑬⑮ ③⑧⑨⑩⑭⑯
2.(2019·河北唐山一中高二月考)有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
答案 C
解析
3.简要回答表面活性剂的去污原理。
答案 表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
1.键的极性判断
(1)从组成元素判断
①同种元素:A—A型为非极性共价键;
②不同种元素:A—B型为极性共价键。
(2)从电子对偏移判断
①有电子对偏移为极性共价键;
②无电子对偏移为非极性共价键。
(3)从电负性判断
①电负性相同为非极性共价键;
②电负性不同为极性共价键。
2.键的极性和分子极性的关系
(1)极性分子中一定含有极性键,可能含有非极性键(如H2O2)。
(2)非极性分子中有的只含非极性键(如O2),有的只含极性键(如BF3等),有的既含极性键又含非极性键(如CH2==CH2等)。
特别提醒:①稀有气体分子是非极性分子,不含共价键;②臭氧是极性分子。
二、键的极性对化学性质的影响
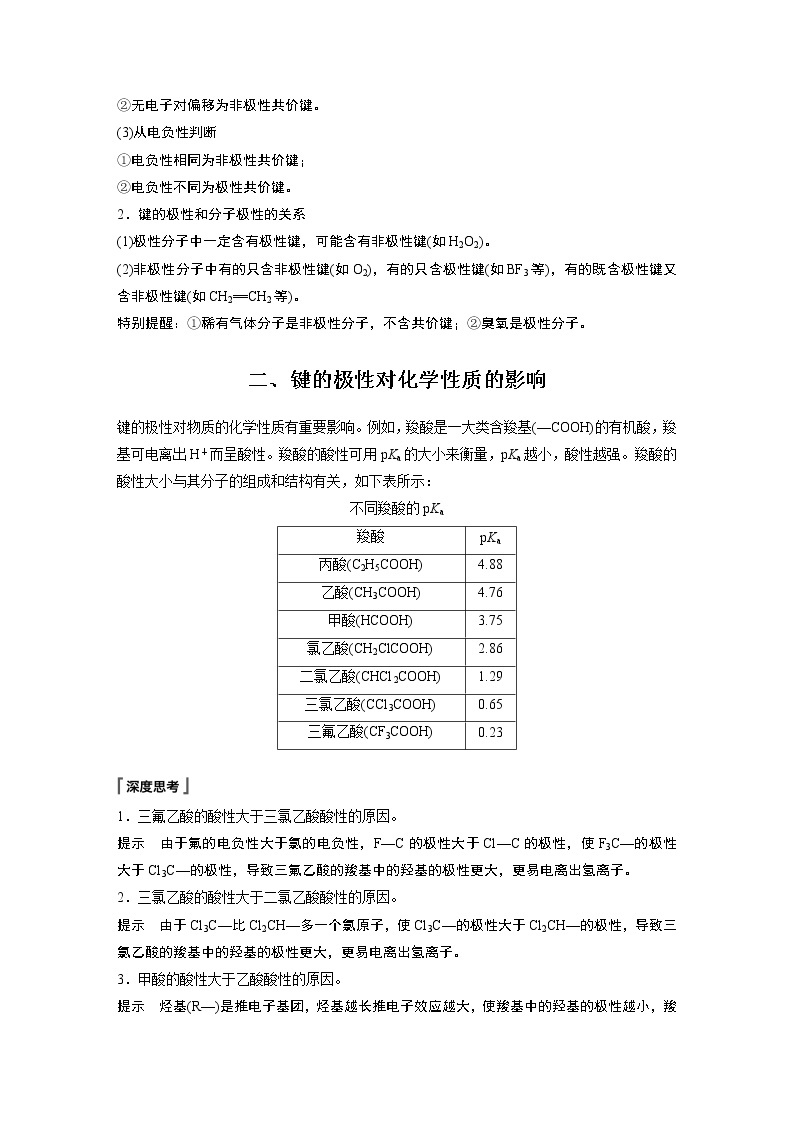
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。羧酸的酸性大小与其分子的组成和结构有关,如下表所示:
不同羧酸的pKa
1.三氟乙酸的酸性大于三氯乙酸酸性的原因。
提示 由于氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
2.三氯乙酸的酸性大于二氯乙酸酸性的原因。
提示 由于Cl3C—比Cl2CH—多一个氯原子,使Cl3C—的极性大于Cl2CH—的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
3.甲酸的酸性大于乙酸酸性的原因。
提示 烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
4.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH ④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
答案 ①>②>③>④>⑤>⑥
1.下列叙述正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
答案 B
解析 A项,稀有气体单质分子均为单原子分子,没有共价键;B项,NH4Cl为离子化合物;C、D两项,如Na2O2、H2O2等分子中含有非极性键。
2.下列叙述中正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性也越强
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键
D.非极性分子中,各原子间都应以非极性键结合
答案 A
解析 卤素中非金属性越强,键的极性越大,A项正确;以极性键结合的双原子分子一定是极性分子,但以极性键结合形成的多原子分子,也可能是非极性分子,如CO2,B项错误;A2B型如H2O、H2S等,AB2型如CO2、CS2等,判断其是否是极性分子的依据是看分子中是否含有极性键及分子的空间结构是否对称。如CO2、CS2为直线形,分子的空间结构对称,为非极性分子;如H2O,有极性键,分子的空间结构不对称,为极性分子,C项错误;多原子分子,其分子的空间结构对称,这样的非极性分子中可能含有极性键,D项错误。
3.下列中心原子采取sp2杂化且为非极性分子的是( )
A.CS2 B.H2S C.SO2 D.SO3
答案 D
4.下列叙述正确的是( )
A.NO、N2O、NO2、NH3都是非极性分子
B.CO2、SO3、BCl3、NF5都是非极性分子
C.H2O、NH3是极性分子,分子中的H—O比N—H的极性弱
D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
答案 B
解析 根据ABn型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,若不相等则为极性分子,可判断:A项中中心原子N原子价电子数为5,四种化合物中没有一种氮元素的化合价为+5,故A项错误;B项中心原子C、S、B、N的化合价等于其价电子数,CO2、SO3、BCl3、NF5均为非极性分子,故B项正确;O的电负性比N的电负性强,对成键电子对的吸引力也强,形成O—H比N—H的极性强,C项错误;NCl3分子中N原子化合价与其价电子数不等,故D项错误。
5.①PH3分子的空间结构为三角锥形,②BeCl2分子的空间结构为直线形,③CH4分子的空间结构为正四面体形,④CO2为直线形分子,⑤BF3分子的空间结构为平面三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
答案 A
解析 非极性键只能由相同种类的原子之间形成,极性分子只能由不同种类的原子之间形成。但在形成分子的时候,主要取决于分子的结构,当分子中的电子云能均匀分布的时候,分子则无极性,否则分子有极性。④CO2分子为直线形,极性抵消,为非极性分子;③CH4为正四面体,故极性也可抵消,为非极性分子;②BeCl2分子为直线形分子,故极性可抵消,为非极性分子;⑤BF3分子为平面三角形,极性抵消,故为非极性分子;⑥NF3中由于N原子的孤电子对对F原子的排斥作用,使电子不能均匀分布,故为极性分子;①PH3中P原子的孤电子对对H原子的排斥作用,使电子不能均匀分布,故为极性分子。
6.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是________。
(2)以极性键相结合,具有直线形结构的非极性分子是________。
(3)以极性键相结合,具有三角锥形结构的极性分子是________。
(4)以极性键相结合,具有正四面体结构的非极性分子是________。
(5)以极性键相结合,具有V形结构的极性分子是____。
(6)以极性键相结合,而且分子极性最大的是________。
答案 (1)N2 (2)CS2 (3)NH3 (4)CH4 (5)H2O (6)HF
解析 不同元素间形成的共价键均为极性键,以极性键形成的分子,正负电荷中心重合的为非极性分子,不重合的为极性分子。
题组一 化学键的类型
1.下列各组物质中,化学键类型都相同的是( )
A.CaCl2和NaOH B.Na2O和Na2O2
C.CO2和CS2 D.HCl和NaOH
答案 C
解析 CaCl2只有离子键,NaOH含离子键和极性共价键,化学键类型不相同,选项A不选;Na2O只有离子键,Na2O2有离子键和非极性共价键,化学键类型不相同,选项B不选;CO2和CS2都含极性共价键,化学键类型相同,选项C选;HCl含极性键,NaOH含离子键和极性共价键,化学键类型不相同,选项D不选。
2.下列物质中,既有离子键又有共价键的是( )
A.CaCl2 B.KBr
C.H2O D.NH4F
答案 D
解析 一般活泼的金属元素和活泼的非金属元素容易形成离子键,非金属元素的原子间容易形成共价键,据此可知选项A中只有离子键,B中只有离子键,C中含有共价键,D中含有离子键和极性键。
3.下列物质中含有非极性键且为盐的是( )
A.CH3COONa B.NH4Cl
C.CaCl2 D.H2O2
答案 A
解析 CH3COONa属于醋酸盐,含有离子键、极性键和非极性键,A正确;NH4Cl属于铵盐,含有离子键和极性键,B错误;CaCl2属于钙盐,只含有离子键,C错误;H2O2属于过氧化物,含有极性键和非极性键,D错误。
4.下列各组分子中,按共价键极性由强到弱排序正确的是( )
A.HF H2O NH3 CH4
B.CH4 NH3 H2O HF
C.H2O HF CH4 NH3
D.HF H2O CH4 NH3
答案 A
解析 共价键极性的强弱取决于形成共价键的两原子的电负性,其电负性相差越大,形成的共价键极性越强。
题组二 键的极性与分子极性
5.X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是( )
A.XY4 B.XY3
C.XY2 D.XY
答案 D
解析 XY为直线形分子,不同种元素对电子对吸引能力不同,分子必有极性。
6.下列各组物质中,都是由极性键构成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HCl
答案 B
解析 CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S、HCl都是由极性键形成的极性分子。
7.以极性键结合的多原子分子,分子是否有极性取决于分子的空间结构。下列分子都属于含极性键的非极性分子的是( )
A.CO2 H2O B.NH3 BCl3
C.PCl3 CH4 D.CS2 BF3
答案 D
解析 二氧化碳结构为O==C==O,结构对称,正负电荷的中心重合,属于非极性分子,H2O为V形分子,结构不对称,正负电荷的中心不重合,属于极性分子,A不符合题意;NH3为三角锥形,结构不对称,正负电荷的中心不重合,属于极性分子,BCl3分子为平面三角形,结构对称,正负电荷的中心重合,属于非极性分子,B不符合题意;PCl3为三角锥形,结构不对称,正负电荷的中心不重合,属于极性分子,CH4为正四面体结构,结构对称,正负电荷的中心重合,属于非极性分子,C不符合题意;CS2是直线形分子,正负电荷的中心重合,属于非极性分子,BF3分子为平面三角形,结构对称,正负电荷的中心重合,属于非极性分子,D符合题意。
8.下列物质:①MgCl2 ②SiO2 ③白磷 ④BF3 ⑤NH3 ⑥四氯化碳,其中含极性键的非极性分子是( )
A.①②③④⑥ B.①④⑤⑥
C.③④⑥ D.④⑥
答案 D
解析 ①MgCl2只有离子键,不存在共价键,故错误;②SiO2中不存在分子,故错误;③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;④BF3中含有极性键,为平面三角形分子,正负电荷中心重合,为非极性分子,故正确;⑤NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,为极性分子,故错误;⑥四氯化碳中含有极性键,空间结构为正四面体形,正负电荷中心重合,为非极性分子,故正确。
题组三 极性分子、非极性分子的判断
9.下列叙述正确的是( )
A.NH3是极性分子,分子中氮原子是在3个氢原子所组成的三角形的中心
B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的中心
C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央
D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中央
答案 C
10.下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的热稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
答案 B
解析 选项A,CO2是非极性分子;选项B,CH4、CCl4都是正四面体结构,分子中的正负电荷中心重合,且C—H、C—Cl为极性键,故它们都是含有极性键的非极性分子;选项C,根据同主族元素性质递变规律可知热稳定性:HF>HCl>HBr>HI;选项D,H2O不是直线形分子而是V形分子。
11.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子空间结构是三角锥形。以下关于PH3的叙述正确的是( )
A.PH3分子中有未成键的孤电子对
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P—H是非极性键
答案 A
解析 A项正确,P原子最外层有5个电子,只有3个电子参与成键,另有2个电子形成一对孤电子对;B项错误,与NH3类似,PH3是极性分子;C项错误,PH3中P处于最低价态,不可能具有强氧化性(+1价氢的氧化性极弱);D项错误,由于P和H的电负性明显不同,故P—H是极性键。
12.微波炉加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应。在高频改变方向的电场中水分子会迅速摆动的原因是( )
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两种元素组成
D.水分子是极性分子
答案 D
解析 水分子空间结构为V形,正负电荷中心不重合,是极性分子,极性分子在电场中会发生偏转,当电场方向改变时,分子运动方向改变,因此在高频改变方向的电场中水分子会迅速摆动。
13.二氯化二硫(S2Cl2),非平面结构,常温下是一种黄红色液体,有刺激性恶臭,熔点80 ℃,沸点135.6 ℃,对于二氯化二硫叙述正确的是( )
A.二氯化二硫的电子式为
B.分子中既有极性键又有非极性键
C.二氯化二硫属于非极性分子
D.分子中S—Cl键能小于S—S键能
答案 B
解析 S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,结合分子结构可知S2Cl2的结构式为Cl—S—S—Cl,电子式为,故A错误;S2Cl2中Cl—S属于极性键,S—S键属于非极性键,不对称的结构,为极性分子,故B正确;分子的结构不对称,为极性分子,而不是非极性分子,故C错误;同周期元素从左到右原子半径逐渐减小,所以氯原子半径小于硫原子半径,键长越短,键能越大,所以分子中S—Cl键能大于S—S键能,故D错误。
14.地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有_____________________________________(填化学式,下同)。
(2)由极性键构成的非极性分子有______________________________________________。
(3)分子中不含孤电子对的分子(稀有气体除外)有________,它的空间结构为________。
(4)CO的结构可表示为O≡C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”)。
答案 (1)H2O、Ne、CH4、NH3 (2)CH4、CO2 (3)CH4 正四面体形 (4)N2 不相同
15.已知,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构____________。
(2)请在以下横线上画出这两种固体分子的几何构型图:淡黄色固体________,黄绿色固体________。
(3)淡黄色固体物质由________组成,黄绿色固体物质由________组成(填“极性分子”或“非极性分子”)。
答案 (1)平面正方形 (2) (3)非极性分子 极性分子
解析 (1)由于PtCl2(NH3)2存在两种同分异构体,所以是平面正方形结构。
(2)因为水是极性分子,所以根据相似相溶原理可知淡黄色固体是非极性分子,黄绿色是极性分子,因此几何构型图分别是、。
(3)由两者的构型可知,前者分子空间对称,为非极性分子,后者分子空间不对称,为极性分子。极性键
非极性键
定义
由不同原子形成的共价键,电子对发生偏移
电子对不发生偏移的共价键
原子吸引电子能力
不同
相同
共用电子对
共用电子对偏向吸引电子能力强的原子
共用电子对不发生偏移
成键原子电性
显电性
电中性
成键元素
一般是不同种非金属元素
同种非金属元素
举例
Cl—Cl、H—H
羧酸
pKa
丙酸(C2H5COOH)
4.88
乙酸(CH3COOH)
4.76
甲酸(HCOOH)
3.75
氯乙酸(CH2ClCOOH)
2.86
二氯乙酸(CHCl2COOH)
1.29
三氯乙酸(CCl3COOH)
0.65
三氟乙酸(CF3COOH)
0.23
目前空气的成分
N2、O2、CO2、水蒸气及稀有气体(如He、Ne等)
原始大气的主要成分
CH4、NH3、CO、CO2等
高中化学鲁科版 (2019)选择性必修2第1节 共价键模型导学案: 这是一份高中化学鲁科版 (2019)选择性必修2第1节 共价键模型导学案,共13页。学案主要包含了共价键的形成与特征,共价键的类型,键参数等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第一单元 分子的空间结构第3课时学案设计: 这是一份苏教版 (2019)选择性必修2第一单元 分子的空间结构第3课时学案设计,共10页。学案主要包含了分子的极性,手性分子等内容,欢迎下载使用。
化学选择性必修2第三单元 共价键 共价晶体第1课时学案: 这是一份化学选择性必修2第三单元 共价键 共价晶体第1课时学案,共12页。学案主要包含了共价键的形成,共价键的类型等内容,欢迎下载使用。