





高中化学人教版 (新课标)必修1第一节 无机非金属材料的主角--硅备课课件ppt
展开1.回顾初中所学原子结构知识,结合电子层模型示意图,了解核外电子能量高低与分层排布的关系。依据稀有气体元素原子的电子层排布,思考并总结出核外电子排布规律,并学会书写常见简单原子的原子结构示意图。培养微观探析、证据推理与模型认知的意识和习惯。2.结合原子结构示意图,讨论归纳出元素周期表的编排原则及结构,并能根据原子序数确定元素在周期表中的位置。培养证据推理与模型认知的能力。3.通过阅读“科学史话”,了解“原子结构模型的演变”“元素周期表的发展”,培养创新意识,增强科学探究意识和社会责任感。
【知识铺垫】1.元素是具有相同核电荷数(即质子数)的同一类原子的总称。2.化学变化中最小的粒子是原子;保持物质化学性质的最小粒子是分子。3.原子由原子核和核外电子构成,原子中的质子数=核电荷数=核外电子数。4.镁、铝、硫、氯的原子结构示意图分别为5.什么样的核外电子排布结构是稳定的结构?提示 最外层达到8电子(只有1层电子时是2电子)结构。
【必备知识】一、原子结构1.原子的构成
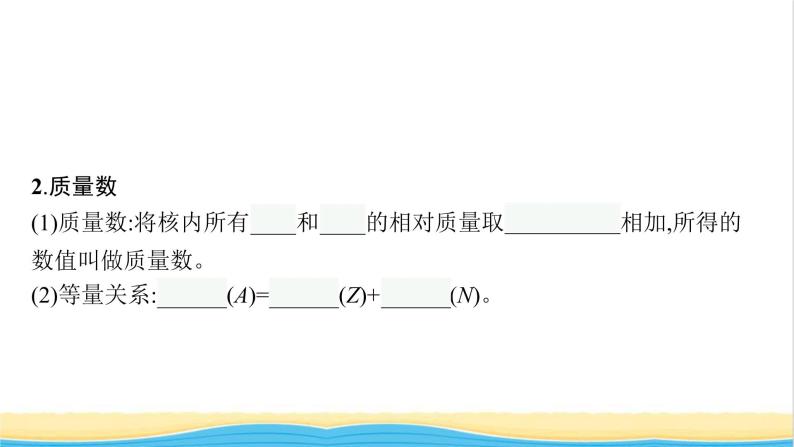
2.质量数(1)质量数:将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。(2)等量关系:质量数(A)=质子数(Z)+中子数(N)。
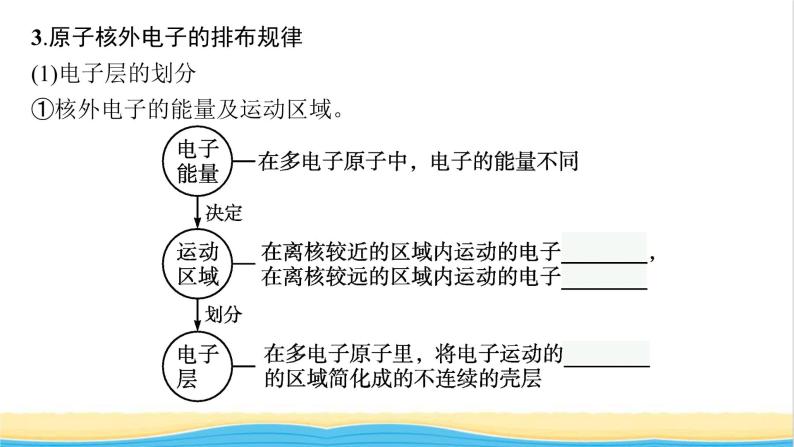
3.原子核外电子的排布规律(1)电子层的划分①核外电子的能量及运动区域。
②电子层及其与能量的关系。
(2)核外电子的排布规律①电子总是尽可能先从内层排起,当一层充满后再填充下一层。②原子核外各电子层最多容纳2n2个电子。③原子最外层电子数不能超过8(K层为最外层时不能超过2),次外层电子数不能超过18,倒数第三层电子数不能超过32。
【微思考1】当M层上有电子时,L层上的电子是否已排满?提示 由于L电子层能量比M层低,故电子先排满L层后再排M层;因此,当M层上有电子时,L层上电子已排满。【微思考2】核外电子排布相同的微粒化学性质一定相同吗?提示 核外电子排布相同的微粒化学性质不一定相同,如同位素之间化学性质几乎完全相同,而Na+与Ne、F-与Mg2+化学性质不同。
4.原子结构模型的演变
二、元素周期表1.元素周期表的发展历程
2.原子序数(1)含义:按照元素在元素周期表中的顺序给元素编号,得到原子序数。(2)原子序数与原子结构的关系原子序数=核电荷数=质子数=核外电子数3.编排原则
4.元素周期表的结构(1)周期(横行)①个数:元素周期表中有 7 个周期。②特点:每一周期中元素的电子层数相同。③分类(3短4长)短周期:包括一、二、三周期(3短)。长周期:包括四、五、六、七周期(4长)。
(2)族(纵列)①个数:元素周期表中有18个纵列,但只有16个族。②特点:元素周期表中主族元素的族序数等于其原子的最外层电子数。③分类
④常见族的特别名称第ⅠA族(除H外):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
【情境链接】1869年,俄国化学家门捷列夫给元素设计并建造了个新家——元素周期表,具有相同电子层数的元素被分在了同一个楼层上(同周期),具有相似性质的一个家族(同族)的元素被分在了同一个单元。你瞧,元素们正在忙忙碌碌、高高兴兴地搬进新家呢!
(1)形成化合物的种类最多的元素是哪一族?提示 第ⅣA族。第ⅣA族中的碳元素形成的化合物的种类最多。(2)Fe最外层有2个电子,一定位于第ⅡA族吗?提示 第ⅡA族的元素最外层一定有2个电子,但最外层有2个电子的元素不一定位于第ⅡA族。Fe属于过渡元素。
【自我小测】1.判断正误:(1)核外电子的能量不同,能量高的在离核近的区域运动。( )(2)第ⅠA族元素全部是金属元素。( )(3)原子及离子的核外电子层数等于该元素所在的周期数。( )(4)原子的最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素。( )(5)原子最外层电子数比次外层电子数多的元素一定位于第二周期。( )答案 (1)× (2)× (3)× (4)√ (5)√
2.下列电子层上的电子能量一定最低的是( )A.K层B.最外层C.次外层D.L层答案 A解析 在多电子原子中,电子总是尽可能地先从内层排起,当一层充满后再填充下一层,在离核较近的区域内电子能量较低,离核远的区域内电子能量较高,故K层能量最低。
【问题探究】在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,也称为电子层,有人把这种电子层模型比拟为洋葱式结构:
(1)M层最多可容纳18个电子,为什么钾原子的核外电子排布不是提示 核外电子排布规律是相互联系的,不能孤立地应用其中的一项。如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
(2)钙的原子结构示意图可表示为 ,对吗?提示 不对,最外层电子数不超过8个,所以应为
【深化拓展】1.原子的构成微粒间的数目关系(1)电中性原子
(2)带电原子——离子的电子数目计算
2.原子核外电子排布规律——“四最”(1)“一个最低”核外电子总是先排布在能量最低的电子层,然后由内向外从能量较低的电子层逐步向能量较高的电子层排布,即排满K层再排L层,排满L层再排M层,依此类推。(2)“三个最多”①各电子层最多容纳的电子数是2n2。如K、L、M、N层最多容纳的电子数分别为2、8、18、32。②最外层电子数最多是8(K层是最外层时,最多是2)。③次外层电子数最多是18。
3.原子或离子核外电子排布的表示方法(1)原子结构示意图:表示原子的核电荷数和核外电子在原子核外各电子层排布的图示。如Na原子的原子结构示意图为
(2)离子结构示意图
【素能应用】典例1核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,则下列有关X的说法中不正确的是( )A.最高正价为+3价B.其最低负价可能为-1价C.氢化物易溶于水D.是活泼的非金属元素
答案 A解析 根据核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,符合题意;n=3时,最外层电子数为7,质子数为17,符合题意。由于元素X可能为氮元素或氯元素,最高正价不可能为+3价,A项错误;若元素X为氯元素,其最低负价为-1价,B项正确;元素X可能为氮元素或氯元素,其氢化物为氨气或氯化氢,二者均易溶于水,C项正确;元素X可能为氮元素或氯元素,二者均为活泼的非金属元素,D项正确。
变式训练1原子是由居于原子中心的原子核和核外电子构成的。下列有关原子核外电子排布的说法中错误的是( )A.电子总是先排布在能量最低的电子层里B.每个电子层最多能容纳的电子数为2n2C.最外层电子数不超过8个(K层为最外层时不超过2个)D.S2-的M层电子数是K层电子数的3倍答案 D解析 根据能量最低原理,电子总是先排布在能量最低的电子层里,A正确;根据电子排布的数量规律,每个电子层最多能容纳的电子数为2n2,最外层电子数不超过8个(K层为最外层时不超过2个),B、C正确;S2-的M层电子数是K层电子数的4倍,D错误。
1.门捷列夫发现元素周期表也是几易其稿,现行元素周期表共有多少个周期,多少个族?提示 共有7个周期,16个族。2.元素种类最多的族是第Ⅷ族吗?提示 不是,是第ⅢB族,共32种元素。3.主族元素是由长周期和短周期元素共同构成的,所以由长周期和短周期元素共同构成的族一定是主族,对吗?提示 不对,由长周期和短周期元素共同构成的族是主族和0族。4.同一主族的元素具有相同的 ,从上而下电子层数逐渐 ,原子半径逐渐 。 提示 最外层电子数 增多 增大
【深化拓展】1.周期的分类及各周期元素种数
2.强化记忆元素周期表的结构
(1)记忆口诀横行叫周期,现有一至七,四长三个短,第七已排满。纵列称为族,共有十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
(2)列序数与族序数的关系①列序数<8,主族和副族的族序数=列序数;②列序数=8或9或10,为第Ⅷ族;③列序数>10,主族和副族的族序数=列序数-10(0族除外)。(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了全部副族元素,全部为金属元素,统称为过渡元素。
【素能应用】典例2无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是( )A.第15列元素的最高价氧化物的化学式是R2O3B.第1列和第17列元素单质熔、沸点变化趋势不相同C.第11列中肯定没有非金属元素D.在18列元素中,第3列的元素种类最多
答案 A解析 根据元素周期表的结构可知,第15列元素是第ⅤA族元素,最高正化合价是+5价,所以最高价氧化物的化学式为R2O5,A不正确。第1列除H外都是金属元素,自上而下单质熔、沸点逐渐降低,第17列元素都是非金属元素,自上而下单质熔、沸点逐渐升高,B正确。第11列是第ⅠB族元素,全部是金属元素,C正确。第3列包括镧系和锕系元素,所以元素种类最多。
变式训练2(2020吉林长春高一检测)下列说法正确的是( )A.同一主族相邻两个周期的元素的原子序数差一定等于上一周期所含元素种数B.11号元素为非金属元素C.在元素周期表中114号元素的上一周期同一族元素的原子序数是82D.目前使用的元素周期表中,最长的周期含36种元素
答案 C解析 A项,若元素位于元素周期表的左边第ⅠA族、第ⅡA族,则同一主族相邻两个周期的元素的原子序数差等于上一周期所含元素种数,若位于第ⅢA族到第ⅦA族,则同一主族相邻两个周期的元素的原子序数差等于下一周期所含元素种数,错误;B项,11号元素是钠,为金属元素,错误;C项,在元素周期表中114号元素位于第七周期,该周期排满应该是32种元素,所以它的上一周期同一族元素的原子序数是114-32=82,正确;D项,目前使用的元素周期表中,最长的周期含32种元素,错误。
1.科学家预测第114号元素具有良好的力学、光学、电学性质,将它命名为“类铅”。推断该元素在周期表中的位置,推断其主要化合价。提示 第七周期稀有气体元素的原子序数为118,可知114号元素位于第七周期第ⅣA族,为金属元素,第ⅣA族元素主要化合价为+2、+4价。
2.元素周期表中同主族某相邻两元素的原子序数相差是多少?提示 2或8或18或32。
【深化拓展】1.由原子序数推导元素在周期表中位置的方法(1)熟记稀有气体元素的原子序数
(2)比大小定周期比较该元素的原子序数与0族元素的原子序数的大小,找出与其相邻近的两种0族元素,那么该元素就和原子序数大的0族元素处于同一周期。
(3)确定纵列和族序数的关系,准确找出周期表中每个纵列对应的族序数(所有族从左到右的顺序)。(4)求差值定族数①若某元素的原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的第ⅠA族或第ⅡA族,如88号元素,88-86=2,则其应在第七周期第ⅡA族。②若某些元素的原子序数比相应的0族元素少1、2、3、4、5,则这些元素应分别处在与该0族元素同周期的第ⅦA、ⅥA、ⅤA、ⅣA、ⅢA族,如84号元素,86-84=2,应在第六周期第ⅥA族。③若差其他数,则由相应差数找出相应的族。
2.由位置推导原子序数的方法(1)同周期
(2)同族若A、B为同主族元素,A所在周期有m种元素,B所在周期有n种元素,A在B的上一周期,设A的原子序数为a。①若A、B位于第ⅠA族或第ⅡA族(位于过渡元素左边的元素),则B的原子序数为(a+m)。②若A、B位于第ⅢA~ⅦA族(位于过渡元素右边的元素),则B的原子序数为(a+n)。
3.元素周期表中特殊位置的元素根据原子结构、元素周期表的知识及相关已知条件,可推算原子序数,判断元素在元素周期表中的位置等。(1)族序数等于周期数的元素:H、Be、Al等。(2)族序数等于周期数2倍的元素:C、S。(3)族序数等于周期数3倍的元素:O。(4)周期数是族序数2倍的元素:Li、Ca等。(5)周期数是族序数3倍的元素:Na、Ba。(6)最高正价与最低负价代数和为零的短周期元素:C、Si。(7)最高正价是最低负价绝对值3倍的短周期元素:S。(8)除H外,原子半径最小的元素:F。
4.利用“阴上阳下”推断原子序数的关系具有相同电子层结构的离子,如X(n+1)+、Yn+、Z(n+1)-、Mn-的电子层结构相同,在周期表中位置关系为则它们的原子序数关系为X>Y>M>Z。
(1)W的简单离子的结构示意图为 ,Y元素在元素周期表中的位置是 。 (2)写出实验室制W元素单质的离子方程式: 。 (3)W与Z形成的液体化合物Z2W2,该物质可与水反应生成ZO2气体,1 ml Z2W2参加反应时转移1.5 ml电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为 。
【素能应用】典例3(2020辽宁大连八中高一阶段测试)X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如下表所示,其中X、Y均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
答案 (1) 第二周期第ⅥA族(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(3)2S2Cl2+2H2O === SO2↑+3S↓+4HCl
解析 X、Y、Z、W是元素周期表中的短周期元素,根据它们的相对位置可知,X、Y是第二周期的元素,Z、W是第三周期的元素,Y、Z是同一主族的元素,Z的原子序数是Y的2倍,可知Y是O元素,Z是S元素,则X是N元素,W是Cl元素。(1)W是Cl,是17号元素,Cl获得1个电子变为Cl-,Cl-结构示意图为 ;Y是O元素,O元素在元素周期表中位于第二周期第ⅥA族。(2)在实验室用浓盐酸与MnO2混合加热制取氯气,反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。(3)W与Z形成的液体化合物Z2W2是S2Cl2,该物质与水反应生成的ZO2气体是SO2,1 ml Z2W2参加反应时转移1.5 ml电子,该反应中只有一种元素化合价发生改变,则S2Cl2与水反应的化学方程式为2S2Cl2+2H2O === SO2↑+3S↓+4HCl。
变式训练3-1下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高正化合价之和为8。下列说法错误的是( )A.Z的最高正化合价是+5价B.常温常压下,Y单质为固态C.W气态氢化物水溶液显碱性D.X的最高价氧化物的水化物是强碱
答案 D解析 W与X的最高正化合价之和为8,结合二者在表中位置可知,X的最高正化合价为+3价,W的最高正化合价为+5价,分别属于第ⅢA族和第ⅤA族,又4种元素均为短周期元素,则W为N,X为Al,Y为Si,Z为P。P的最高正化合价为+5价,A项正确;常温常压下Si是固体,B项正确;氨水显碱性,C项正确;Al的最高价氧化物的水化物是两性氢氧化物,D项错误。
变式训练3-2短周期元素A、B、C在元素周期表中的位置如图所示。已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C是( )A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P答案 C解析 短周期元素A、B、C,设A的原子序数为m,则B、C的原子序数分别为m+8-1和m+8+1,由题意知(m+8-1)+(m+8+1)=4m,则m=8,故选C。
1.下列是几种粒子的结构示意图,有关说法错误的是( )A.①和②属于同种元素B.②属于稀有气体元素C.①和③属于同一主族D.④属于金属元素答案 B解析 ①和②都是氧元素,A项正确;②为氧元素,不是稀有气体元素,B项错误;③为硫元素,和氧元素是同主族元素,C项正确;④为钠元素,D项正确。
2.已知R原子有b个中子,R2+核外有a个电子。则R原子的质量数为( )A.bB.a+b-2C.a+b+2D.a+b答案 C解析 R2+核外有a个电子,则R原子的质子数为a+2,质量数为a+b+2。
3.(2020山东潍坊中学高一化学阶段检测)假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素在( )A.第ⅢB族B.第ⅠB族C.第ⅢA族D.第ⅡA族答案 C解析 元素周期表中第ⅡB族之后相邻的族为第ⅢA族,第ⅡB 族某元素原子序数为x,则原子序数为x+1的元素位于第ⅢA族,故选C。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表图文ppt课件: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表图文ppt课件,共45页。
2021学年第一节 原子结构与元素周期表课文课件ppt: 这是一份2021学年第一节 原子结构与元素周期表课文课件ppt,共39页。
人教版 (2019)必修 第一册第二节 元素周期律背景图ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律背景图ppt课件,共40页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,课堂小结等内容,欢迎下载使用。













