
高中化学苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表学案
展开1、了解元素周期表的发现历程,并能知道元素周期表的发现对化学科学发展的重要意义。
2、初步理解和掌握元素周期表的结构,周期和族的概念以及元素的“位-构”关系。
元素周期表的基本结构、周期、族的概念,以及周期、主族序数和原子结构的关系。
提问:
什么是元素周期律,包括哪些内容?
原子序数与核电荷数、原子的核外电子、核内质子数有什么关系?
写出钠、镁、铝的原子结构示意图。
一、元素周期表
1、排列原则:
(1)横行原则:____数目相同的元素,按______递增的顺序从左到右排列,称为_____。
(2)纵行原则:不同横行中_________相同的元素,按______递增的顺序由上而下排列,称为族。
(3)原子序数:按照元素在周期表中的顺序给元素编的序号。
(4)原子序数与元素的原子结构之间的关系:原子序数=__________=_______=___________。
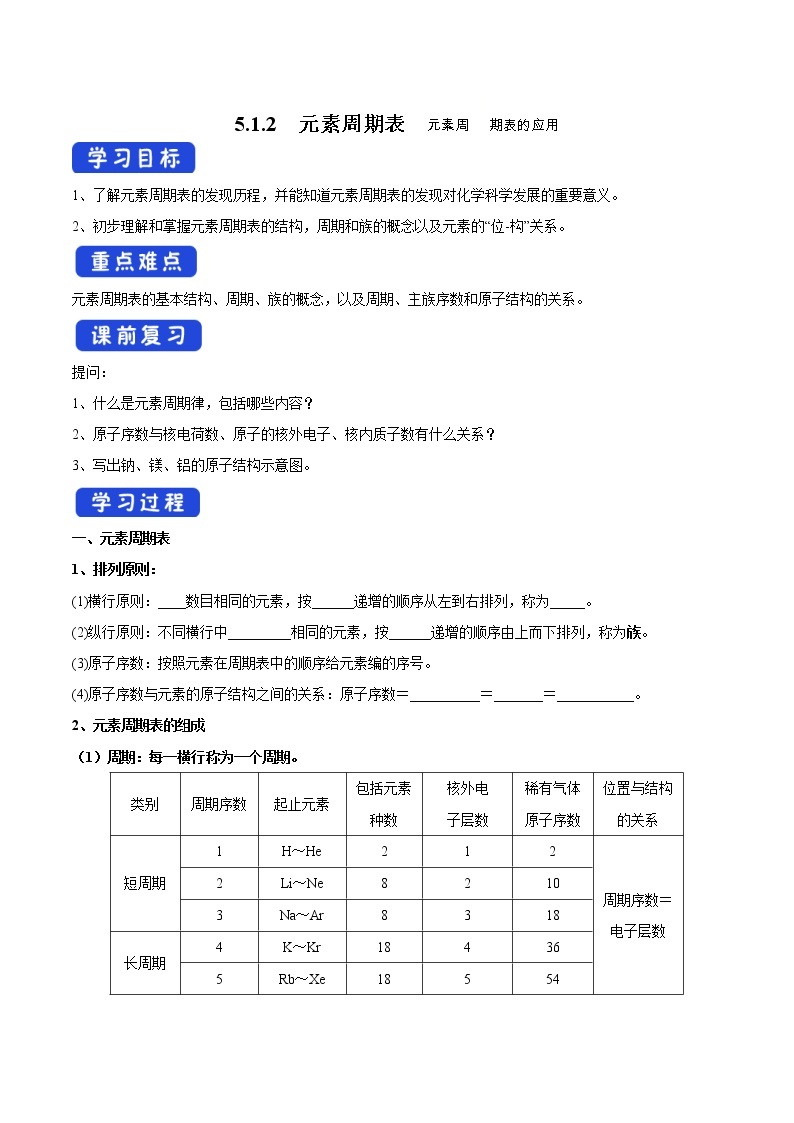
2、元素周期表的组成
(1)周期:每一横行称为一个周期。
(2)族
讲解:元素周期表有18个纵行,它们被划分为16个族,
①7个主族,依次为_____________________________________
②7个副族,依次为____________________________________
③1个第Ⅷ族:包括第___________三个纵行
④1个0族,包括的元素有__________________________________________
整理归纳:
1、氦及最外层电子数为8的元素化学性质不活泼,把它们的化合价定为0,称为0族。
2、同一主族的元素的最外层电子数相同,元素的性质具有相似性,但电子层数由上到下递增,性质也呈现出一定的递变性。
3、人们根据同一族中元素的性质的特点,给一些族以特殊的名字:例:IA族(除H外)称为碱金属,VIIA族称为卤素。
思考1、碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),它们的物理性质、化学性质具有一定的相似性。除了绝外,碱金属都是银白色的单质,硬度小,延展性好、密度比较小,熔点比较低。它们原子的最外层都只有1个电子,在化学反应中易失去1个电子、成为带一个单位正电荷的简单离子。分析下表,找出碱金属元素金属性的变化规律。
IA族(除氢外)金属性强弱变化规律___________________________________________________
思考2、写出下列反应的化学方程式
氯水与溴化钠溶液反应___________________________________________________
氯水与碘化钾溶液反应___________________________________________________
溴水与碘化钾溶液反应__________________________________________________
卤素的非金属性变化规律:随着核电荷数的增多,卤素单质的_______逐渐减弱。
整理归纳
1、同一主族元素的原子最外层电子数相同,随着核电荷数的递增,电子层数逐渐增加,原子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
2、同一周期元素(稀有气体元素除外)的原子,核外电子层数相同,随着核电荷数的递增,最外层电子数逐渐增加,原子半径逐渐减小,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。因此,同一周期的元素(稀有气体元素除外),从左到右金属性逐渐减弱,非金属性逐渐增强。
3、
二、元素周期表的应用
1、化学基本理论研究提供了依据,还可以指导新型材料的开发和应用。
2、根据元素在周期表中的位置,推测元素的原子结构,预测未知元素的主要性质。
3、指导人们寻找新材料和稀有矿产。
4、借助元素周期表制备具有特定性质的新物质。
学生活动:教材第124页“学以致用”
小结:
1、元素周期表和元素周期律的应用
(1)可以由元素在周期表中的位置推测其结构和性质。
(2)根据元素的结构和性质,推测它在周期表中的位置。
(3)指导新元素的发现及预测它们的性质。
(4)指导其他与化学相关的科学技术。如在周期表中金属元素和非金属元素分界线附近,可以找到半导体材料。在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
2、
1、下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第2周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第3周期ⅡA族
A.①② B.①③ C.②④ D.③④
2.镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
4、下列各组元素中,按最高正价递增的顺序排列的是( )
A.C、N、O、F B.K、Mg、Si、S
C.F、Cl、Br、I D.Li、Na、K、Rb
类别
周期序数
起止元素
包括元素种数
核外电
子层数
稀有气体原子序数
位置与结构的关系
短周期
1
H~He
2
1
2
周期序数=电子层数
2
Li~Ne
8
2
10
3
Na~Ar
8
3
18
长周期
4
K~Kr
18
4
36
5
Rb~Xe
18
5
54
6
Cs~Rn
32
6
86
7
Fr~112号
26
7
苏教版 (2019)第一单元 元素周期律和元素周期表导学案及答案: 这是一份苏教版 (2019)第一单元 元素周期律和元素周期表导学案及答案,共15页。
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表第2课时导学案及答案: 这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表第2课时导学案及答案,共11页。学案主要包含了元素周期表,元素周期表的应用等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表第四课时学案: 这是一份苏教版 (2019)必修 第一册第一单元 元素周期律和元素周期表第四课时学案,共8页。













