






高中化学人教版 (新课标)选修4 化学反应原理第二节 燃烧热 能源教课课件ppt
展开1.定义:在稀溶液中,强酸和强碱发生中和反应生成1mlH2O(l),这时的反应热叫做中和热。
2. 单位: KJ/ml
3. 注意 ①必须是稀溶液,如浓硫酸稀释或NaOH固体溶解时放热; ②强酸和强碱反应 ③标准:生成1mlH2O(l)放出的热量.
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3KJ/ml KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l) △H=-57.3KJ/mlBa(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) △H=-114.6KJ/ml
H+ (aq)+OH- (aq) = H2O(l)
△H=-57.3KJ/ml
4.(1)强酸、强碱的稀溶液: H+(aq)+OH- (aq)=H2O(l) △H=-57.3 kJ/ml
(3)若反应过程中有其他物质生成(沉淀、难电离物质等),这部分反应热不属于中和热。
(2)有弱酸(或弱碱)参加中和反应,中和热一般低于57.3 kJ/ml,因为电离吸热。
Ba(OH)2(aq)+H2SO4 (aq)=BaSO4(s)+2H2O(l) △H=-1584.2KJ/ml
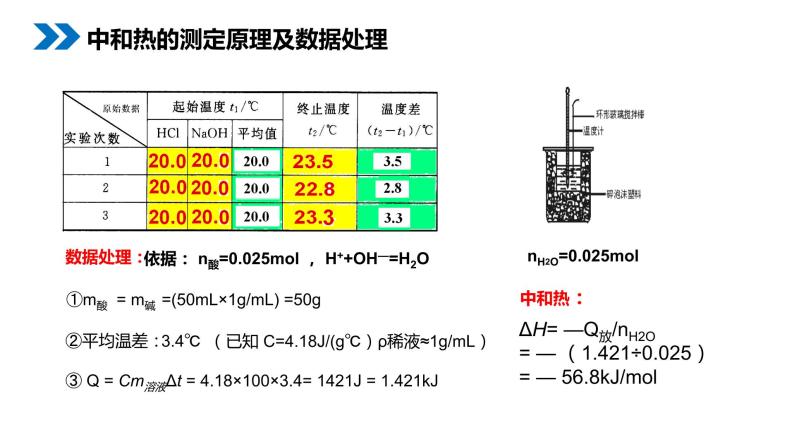
已知温度均为t1℃的50g稀盐酸与50g稀NaOH溶液混合后溶液的温度升至t2℃,问酸与碱的溶液混合前、后的温度为何会升高?此热量值为多少KJ?【设溶液比热容:4.18J/(g.℃ )】
=4.18 J/(g.℃)×(50+50)g×(t2-t1)℃
因为中和反应放出热量使得溶液温度升高!
=0.418 ×(t2-t1) KJ
中和反应放出总热量:Q放 = c ×m混液×Δt = c×(V酸ρ酸+V碱ρ碱)×(t2-t1) 其中 Q放 : 反应放出的总热量。 m: 溶液的总质量。 C:溶液的比热容,为4.18J/ (g·℃) △t:反应前后溶液温度的差值 稀酸或稀碱溶液中:ρ酸≈ρ碱≈1g/mL
HCl(aq)+ NaOH (aq)= NaCl (aq) +H2O (l) ΔH<0
实验测定中和热所需的数据:稀的酸及碱的量、反应前后混合溶液的温度、比热容、反应生成水的物质的量
实验目的:测定强酸与强碱反应的反应热
学习重点:中和反应反应热的测定原理和方法。
实验用品 大烧杯(500 mL)、小烧杯(100 mL) 温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。0.50 ml/L 盐酸、0.55 ml/L NaOH溶液
①m酸 = m碱 =(50mL×1g/mL) =50g
③ Q = Cm溶液Δt = 4.18×100×3.4= 1421J = 1.421kJ
ΔH= —Q放/nH2O= — (1.421÷0.025)= — 56.8kJ/ml
依据: n酸=0.025ml , H++OH—=H2O
(已知 C=4.18J/(g℃)ρ稀液≈1g/mL)
nH2O=0.025ml
中和热的测定原理及数据处理
1.大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议?
两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失; 填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
2.本实验至少使用温度计多少次?为减少误差最好使用同一支温度计测温度,每次测温度前为何要用水将温度计冲洗干净?冲洗后的溶液是否要倒入装有反应溶液的烧杯中?
共6次;若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。
3.为什么采用环形玻璃棒搅拌混合液,可不可以用普通玻璃棒?能不能用铁制或铜制的环形玻璃棒代替?
环形玻璃棒的优点在于:上下移动搅拌的面积大、范围广,混合均匀,普通玻璃棒显然不具有这种优点。
金属材料的玻璃棒均不可用,因为金属具有导热性,使反应热损失,还可能与溶液反应。
4.酸、碱混合时,为何要把量筒中的NaOH溶液一次性很快倒入小烧杯而不能缓缓倒入?
因为本实验的关键是测反应的反应热,若动作迟缓或多次加入,将会使热量损失而使误差增大。
为了保证盐酸完全被NaOH中和,故使碱稍稍过量。 不宜用盐酸过量:因为在空气中盐酸相对碱稳定,碱极易与空气中CO2反应,故如果盐酸过量,此时所用的碱很难保证完全与HCl反应。
5.实验中用50mL0.5ml/L稀盐酸和50mL0.55ml/LNaOH溶液,物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗?
1.量取溶液的体积时有误差2.读取温度计的读数时有误。3.实验过程中有液体洒在外面。4.混合酸、碱溶液时,动作缓慢,导致实验误差。5.隔热操作不到位,致使实验过程中热量损失而导致误差。6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。
H+ (aq) + OH — (aq) =H2O(l) ΔH=- 57.3kJ/ml
本实验测定结果: 56.8kJ/ml
1.本实验中若把50 mL 0.50 ml/L的盐酸改为50 mL 0.50 ml/L醋酸,所测得中和热是否会有所变化?为什么?(假设操作完全一致)
结果是放出热量较少,中和热值较小,但ΔH却较大。因为醋酸是弱酸,其电离时需要吸收能量。
2、判断下列实验操作或用量对中和热测定的数值有何影响?
①大烧杯上没有盖硬纸板②用相同浓度和体积的氨水代替NaOH溶液进行实验 ③用相同体积的浓硫酸代替稀盐酸溶液进行实验 ④实验中改用100 mL 0.25 ml/L硫酸跟 100 mL 0.55 ml/L NaOH溶液进行实验⑤实验中改用50 mL 0.50 ml/L盐酸跟 50 mL 0.50 ml/L NaOH溶液进行实验
3、实验中改用100 mL 0.50 ml/L 的盐酸跟100mL 0.55 ml/L的NaOH溶液进行反应,与上述实验相比, 所放出的热量 (填“相等”或“不相等”),理由是 ; 若实验操作均正确,所求中和热的数值会 ; (填“相等”或“不相等”),理由是: ;
因为酸、碱发生中和反应放出的热量与酸、碱的用量有关
因为中和热是指酸跟碱发生中和反应生成1 ml H2O所放出的能量,与酸碱的用量无关
(1)H2(g)+½O2(g)=H2O(g) ∆H=- 241.8kJ/ml (2)H2(g)+ ½O2(g)=H2O(l) ∆H =- 285.8kJ/ml (3)2H2(g)+O2(g)=2H2O(l) ∆H=- 571.6kJ/ml 哪一个是H2的燃烧热? ————
1﹑定义:101kpa时,1ml纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。 2、单位:kJ/ml3、可通过实验用仪器测 定。
书写乙炔燃烧热的热化学方程式。C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1299.6kJ/ml书写乙炔燃烧的热化学方程式。
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1299.6kJ/ml 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599.2kJ/ml
⑴恒压条件下的反应热。⑵放热,△H<0。⑶以1ml可燃物为标准配平,其余可用分数。⑷物质在O2中燃烧。
理解燃烧热的定义应注意:
⑴比较H2、CH4谁的热值高。⑵比较CH4和C2H5OH谁更环保。⑶为什么我国使用乙醇作为汽油的待用品?
(4)应根据什么标准来选择燃料?
讨论 比较燃烧热与中和热的异同
能源——常规能源——新能源——一级能源——二级能源——
煤、石油、天然气、电能、水能、柴草。
太阳能、氢能、风能、地热能、海洋能和生物质能。
来自自然界未经转化的能源。
由一级能源经过转化得到的能源。
1、下列属于一级能源的是( )2、属于二级能源的是( ) A、风能 B、电能 C、氢能 D、阳光 E、天然气
(1) 目前使用的主要能源是何种能源。 (2) 我国的能源储量如何。(3) 我国的人均能源拥有量如何。(4) 进年来我国能源的总消费量与人均消费量情况如何。
讨论 我国的能源状况如何
1.2燃烧热 能源 课件-高二上学期人教版化学选修四: 这是一份1.2燃烧热 能源 课件-高二上学期人教版化学选修四,共1页。
高中人教版 (新课标)第三章 水溶液中的离子平衡综合与测试授课ppt课件: 这是一份高中人教版 (新课标)第三章 水溶液中的离子平衡综合与测试授课ppt课件,共26页。PPT课件主要包含了学习目标,指示剂的选择,酸碱中和滴定,c酸V酸c碱V碱,c待=,c标·V标,仪器及其使用,酸式滴定管,碱式滴定管,2滴定管的构造等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算说课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算说课ppt课件,共17页。PPT课件主要包含了根据下列反应计算,盖斯定律的内容,盖斯定律模型,△H=△H1+△H2,盖斯定律,盖斯定律的应用,加减消元法,求未知反应焓变的方法,可逆反应焓变等内容,欢迎下载使用。













