2022届高三高考化学一轮实验专题突破20——气体收集与制备装置图考查
展开www.ks5u.com
备战2022届高考化学一轮实验专题突破20——气体收集与制备装置图考查
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(共20题)
1.下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000mol·L-1的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容
B
探究维生素C的还原性
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取干燥纯净的氢气
向稀盐酸中加入锌粒,将生成的气体依次通过浓硫酸、NaOH溶液,然后收集
D
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
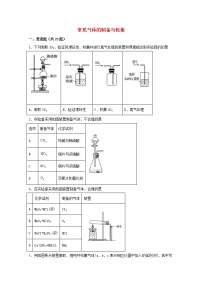
2.图中装置或操作不能达到实验目的的是
A.图1中的实验现象能证明非金属性:
B.图2可结合秒表测量锌与稀硫酸的反应速率
C.图3中,气体从口进入时,可用于收集、、等气体
D.图4可验证甲烷和氯气能发生反应
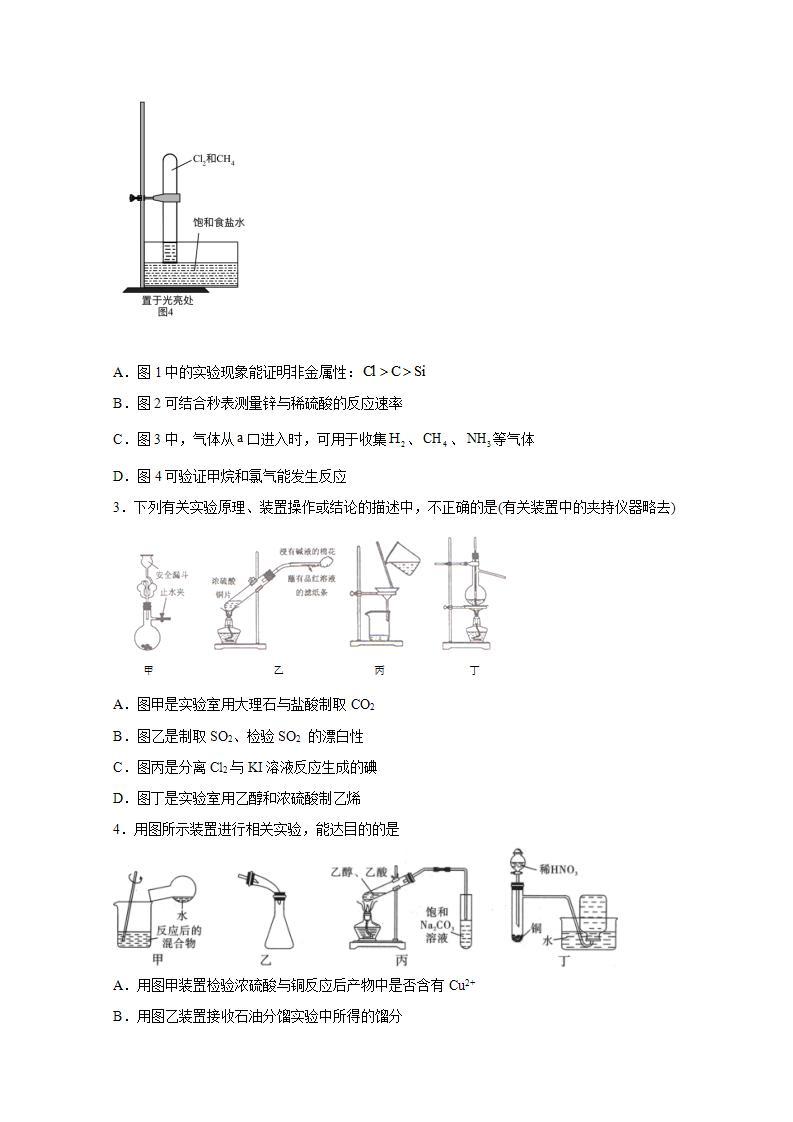
3.下列有关实验原理、装置操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去)
A.图甲是实验室用大理石与盐酸制取CO2
B.图乙是制取SO2、检验SO2 的漂白性
C.图丙是分离Cl2与KI溶液反应生成的碘
D.图丁是实验室用乙醇和浓硫酸制乙烯
4.用图所示装置进行相关实验,能达目的的是
A.用图甲装置检验浓硫酸与铜反应后产物中是否含有Cu2+
B.用图乙装置接收石油分馏实验中所得的馏分
C.用图丙装置制取乙酸乙酯
D.用图丁装置制备NO
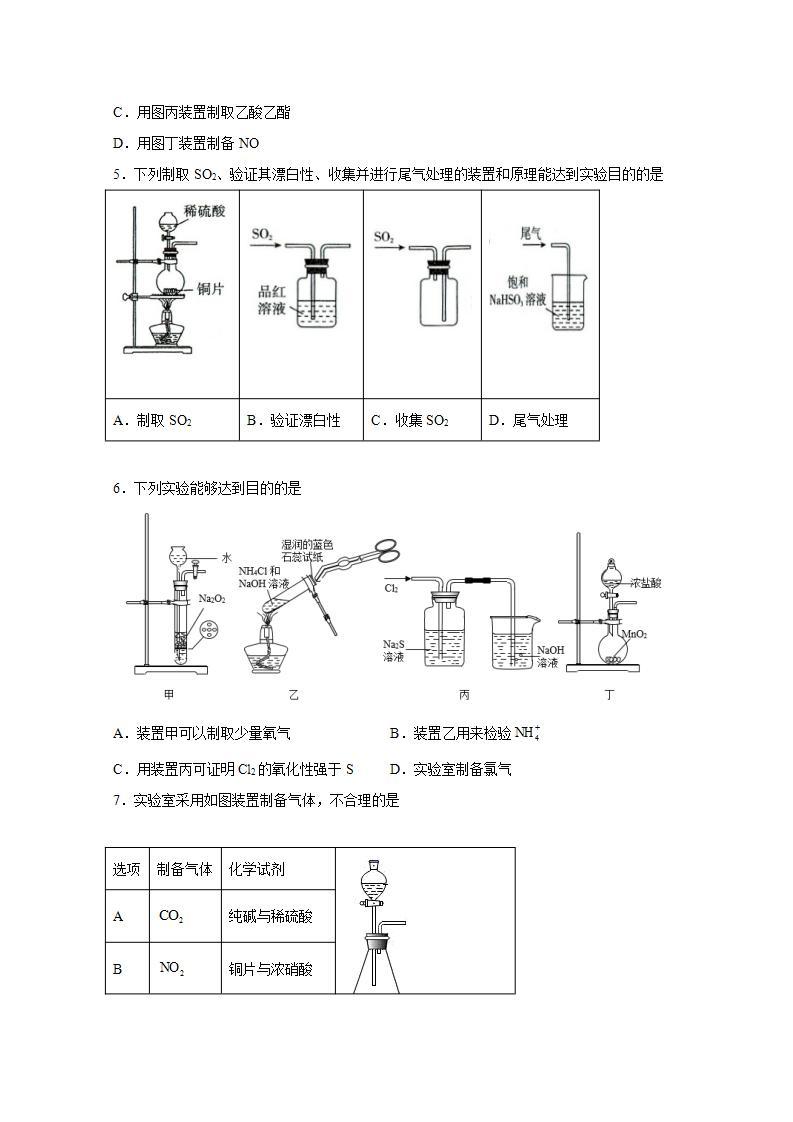
5.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
A.制取SO2
B.验证漂白性
C.收集SO2
D.尾气处理
6.下列实验能够达到目的的是
A.装置甲可以制取少量氧气 B.装置乙用来检验
C.用装置丙可证明Cl2的氧化性强于S D.实验室制备氯气
7.实验室采用如图装置制备气体,不合理的是
选项
制备气体
化学试剂
A
纯碱与稀硫酸
B
铜片与浓硝酸
C
铜片与浓硫酸
D
双氧水和氯化铁
8.下列实验方案中,实验装置正确且能达到实验目的的是
选项
A
B
C
D
实验
装置
实验
目的
氨气溶于水的喷泉实验
制备乙酸乙酯
收集并处理尾气
稀释浓硫酸
9.利用下图装置制备、收集纯净气体,能达到实验目的的是
气体
装置a
装置b
A
浓盐酸
固体
B
70%的浓硫酸
固体
C
浓氨水
生石灰
D
NO
稀硝酸
Cu
10.下列制取或收集气体装置中棉花作用不正确的是
A
B
C
D
名称
加热高锰酸钾制取氧气
制取并收集氨气
铜与浓硫酸反应制取SO2
铁粉与高温下的水蒸气反应
装置
作用
防止高锰酸钾颗粒进入导气管,造成堵塞
吸收过量的氨气,防止氨气泄漏到空气中
吸收过量的二氧化硫,防止二氧化硫污染空气
提供水蒸气
11.用下列图示实验装置进行实验,能达到相应实验目的的是
A.用图①所示装置灼烧碎海带 B.用图②所示装置制取并收集O2
C.用图③所示装置制取乙酸乙酯 D.用图④所示装置分离溴和苯
12.下列实验方案设计不合理的是
A
B
C
D
排空气法收集CO2
实验室制取蒸馏水
验证酸性:H2CO3>H2SiO3
分离饱和Na2CO3溶液与CH3COOC2H5
13.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,合理的选项是
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硫酸
Zn
H2
NaOH溶液
D
H2O2
MnO2
O2
NaOH溶液
A.A B.B C.C D.D
14.下列实验装置能达到相应实验目的的是
实装验置
实目验的
A.除去中的
B.制备并收集NO
C.测定中和反应的反应热
D.制取
15.下列实验能达到目的的是
A
B
C
D
方案
目的
吸收多余尾气
检验和收集
干燥
配制一定物质的量浓度的溶液
A.A B.B C.C D.D
16.利用下列装置进行实验,能达到实验目的的是
A.配制0.1 mol·L-1NaCl(aq) B.收集SO2并吸收尾气
C.制取C2H4 D.蒸干MnC12溶液制MnC12·4H2O
17.关于下列装置图的叙述中,正确的是( )
A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集NO、NH3、Cl2、HCl、NO2
C.装置③可用于分离沸点相差较大的互溶的液体混合物
D.装置④可用于干燥、收集氯化氢并吸收多余的氯化氢
18.用下列实验装置能达到相关实验目的的是
A
B
C
D
实验装置
实验目的
除去Fe(OH)3胶体中混有的NaCl溶液
制备并收集少量NO2
实验室灼烧Na2CO3·10 H2O
测定中和反应的反应热
19.以CO2和Na2O2为原料制取纯净干燥的O2实验装置如图:
下列说法不正确的是
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
20.能利用图示装置及物质制取和收集相应气体的是(除杂及尾气处理装置已略去)
选项
a中的物质
b中的物质
c中最终收集的气体
A
稀硫酸
Zn
H2
B
浓硫酸
Cu
SO2
C
稀盐酸
CaCO3
CO2
D
浓硝酸
Fe
NO2
第II卷(非选择题)
二、填空题(共7题)
21.研究小组利用如图所示装置制备CO2气体,其中K为止水夹,多孔塑料板固定在试管的某一位置。请问答以下问题:
(1)当止水夹K打开时,大理石即可与稀盐酸反应产生CO2气体;当止水夹关闭后,该反应可随后停止。起到这种随关随停作用的主要原因是__________
(2)实验室可以利用上述装置制备某些气体,能达到随开随用,随关随停的有__________
A.锌粒和稀硫酸制氢气B.浓盐酸和二氧化锰制取氯气
C.Na2SO3固体和硫酸反应制备SO2D.利用FeS块状固体与稀硫酸反应制备H2S气体
(3)请你选用如图所示的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是__________(填仪器的编号)
22.已知2H2O22H2O+O2↑,实验室中利用该反应,选用下图所示装置可制取氧气。请回答下列问题:
(1)制取并收集干燥的氧气时,所选用装置的导管接口顺序为(填字母)_____________;
(2)若将丁装置充满水,就可用排水法收集氧气,此时装置最合理的连接顺序为(填字母) ______________________;
(3)MnO2是H2O2分解反应的催化剂,可以回收再利用,采用___________方法,可从反应后的混合物中分离出MnO2;
(4)气体发生装置的选择是由反应条件(是否需要加热)和_____决定的。
23.实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_________;检查C装置气密性是否良好的操作方法是_________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计的收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______。
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________。
24.氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2==Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。
(1)A中发生反应的离子方程式为____________。
(2)F中发生反应的化学方程式为_________。
(3)盛装碱石灰的仪器名称为________,其作用为__________。
(4)整个装置的仪器连接顺序为A→________(装置不能重复使用)。该实验的不足之处是__________。
(5)E中短导管a通入的气体是__________,导管ab采用长短不同的原因是__________。
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为__________
三、实验题
25.镍的全球消费量仅次于铜、铝、铅、锌,属有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:,实验室用如图所示装置制取。
已知:;熔点为-25℃,沸点为43 ℃,60 ℃以上与空气混合易爆炸;熔点为-20 ℃,沸点为103 ℃。回答下列问题:
(1)装置A是用来制取CO,写出发生反应的化学方程式为_________。
(2)装置C用于合成 (夹持装置略),最适宜选用的装置为______(填标号)。
(3)实验过程中为了防止CO及与装置中空气混合在加热条件下会发生爆炸,所以要先观察到________(填实验现象)再加热C装置。
(4)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中装有粗镍粉。再充入CO气体,通过一系列实验操作后,则高纯镍粉在封管的_______温度区域端生成(填“323 K”或“473 K”)。(提示323 K是49.85 ℃,473 K是199.85 ℃)
(5)假设实验中有参加反应,C装置参加反应镍的质量为2.95 g,E装置中盛有溶液100 mL,则溶液的物质的量浓度至少为______。
26.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应: 2NaClO2 + Cl2 = 2ClO2 + 2NaCl.下图是实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体(用于除去ClO2中未反应的Cl2)
(1)仪器P的名称是______
(2)写出装置A中烧瓶内发生反应的化学方程式: _________________
(3)B装置中所盛试剂是________; C装置所盛试剂的作用是__________________
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是___________(填接口字母)。
(5) NaClO2中氯元素的化合价是_________。
27.某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。(查阅资料):NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOHNaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。
(1)连接好装置,滴加浓硝酸之前的操作依次是:____________,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________、____________。
(3)装置①中发生反应的化学方程式为____________。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________。
(5)根据实验设计,装置②中盛放的试剂是____________。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________。
参考答案
1.B
【详解】
A.n(NaOH)==0.1mol,NaOH在烧杯中溶解,冷却至室温再转移至500mL容量瓶中定容,得到溶液的物质的量浓度为=0.2 mol·L-1,故A不选;
B.氯化铁具有氧化性,维生素C具有还原性,二者发生氧化还原反应,溶液的黄色消失,观察溶液颜色能够达到实验目的,故B选;
C.生成的气体依次通过浓硫酸可干燥氢气,NaOH溶液除HCl,气体中会混入水蒸气,不能达到实验目的,故C不选;
D.将NaOH浓溶液滴加到饱和FeCl3溶液中,发生复分解反应生成氢氧化铁沉淀,不能得到氢氧化铁胶体,故D不选;
故选B。
2.A
【详解】
A.盐酸易挥发,盐酸与硅酸钠也能反应,且盐酸为无氧酸,不能比较非金属性的强弱,故A选;
B.秒表测定时间,针筒测定气体的体积,则图中装置可测量锌与硫酸的反应速率,故B不选;
C.H2、CH4、NH3密度比空气小,应用向下排空法收集,气体需要短进长出,能够达到实验目的,故C不选;
D.甲烷与Cl2在光照条件下发生取代反应可得到各种氯代产物和氯化氢,气体的体积减小,可验证甲烷和氯气的反应,故D不选;
故选A。
3.C
【详解】
略
4.D
【详解】
A.铜与浓硫酸反应后的产物中含有浓硫酸,加入顺序为酸入水,故A错误;
B.装置为密闭装置,蒸馏时气压过大,液体不能正常流下,可能引起爆炸,故B错误;
C.制取乙酸乙酯需要用到浓硫酸,故C错误;
D.铜与稀硝酸反应生成NO,NO用排水法收集,故D正确;
故选D。
5.B
【详解】
A.Cu与稀硫酸不能反应,与浓硫酸混合加热可以制取二氧化硫气体,因此不能制取得到SO2气体,A错误;
B.SO2具有漂白性,能够与品红溶液结合产生无色物质,因此使用该装置可以验证其漂白性,B正确;
C.SO2气体的密度比空气大,应该使用向上排空气方法收集,导气管应该是长进短出,C错误;
D.SO2是大气污染物,但SO2与NaHSO3溶液不能反应,不能用该溶液进行尾气处理,应该使用NaOH溶液进行吸收, D错误;
故合理选项是B。
6.C
【详解】
A.该装置要求固体药品为块状,不溶于水,Na2O2是粉末状药剂,无法实现固液分离要求,不符题意;
B.检验NH3等碱性气体应使用湿润的红色石蕊试纸,检验试剂错误,不符题意;
C.Cl2通入洗气瓶,瓶中溶液出现浑浊,发生反应,Cl2做氧化剂,S是氧化产物,氧化剂氧化性大于氧化产物氧化性,描述正确,符合题意;
D.二氧化锰与浓盐酸反应制氯气反应必须加热才能进行,仪器选择错误,不符题意;
综上,本题选C。
7.C
【分析】
由图可知,该装置为固液不加热制备气体的装置。
【详解】
A.纯碱固体能与稀硫酸反应生成硫酸钠、二氧化碳和水,则该装置能用于制备二氧化碳气体,故A不符合题意;
B.铜片与浓硝酸反应生成硝酸铜、二氧化氮和水,则该装置能用于制备二氧化氮气体,故B不符合题意;
C.铜片与浓硫酸共热反应生成硫酸铜、二氧化硫和水,则该装置不能用于制备二氧化硫气体,故C符合题意;
D.在氯化铁做催化剂作用下,过氧化氢发生分解反应生成水和氧气,则该装置能用于制备氧气,故D不符合题意;
故选C。
8.A
【详解】
A.极易溶于该溶液的气体能发生喷泉实验,氨气极易溶于水,所以能做喷泉实验,能实现实验目的,故A选;
B.制备乙酸乙酯时,收集乙酸乙酯的导管不能插入饱和碳酸钠溶液中,以防止倒吸,故B不选;
C.收集要用向上排空集气法,进气导管长,出气导管短,故C不选;
D.稀释浓硫酸,应将浓硫酸倒入水中,故D不选;
故选A。
9.B
【详解】
A.浓盐酸有挥发性,制取的氯气中含有HCl杂质气体,缺少除杂装置,故A错误;
B.Na2SO3固体和质量分数为70%的浓硫酸反应生成二氧化硫通过浓硫酸干燥收集,二氧化硫比空气重,用向上排气法收集,剩余氢氧化钠溶液吸收,吸收时倒扣在液面上的漏斗防止倒吸,故B正确;
C.氨气和浓硫酸反应,不能用浓硫酸干燥,故C错误;
D.以Cu、稀硝酸为原料生成的一氧化氮和空气中氧气反应,收集NO不能用排空气法收集,故D错误;
故选:B。
10.B
【详解】
A.加热高锰酸钾制取氧气时,在导管口塞上棉花可以防止高锰酸钾颗粒进入导气管,造成堵塞,故A正确;
B.该实验中棉花的作用是防止空气在试管口形成对流,以提高所收集的氨气的纯度,若要吸收氨气则需要用湿棉花,故B错误;
C.浸有碱液的棉花可以吸收过量的二氧化硫,防止二氧化硫污染空气,故C正确;
D.红热的铁粉与水蒸气在高温下可以反应,所以湿棉花可以提供水蒸气,故D正确;
答案选B。
11.B
【详解】
A.灼烧应该用坩埚,烧杯用于液体加热,A项错误;
B.反应可以生成氧气,密度大于空气,向上排空气法正确,B项正确;
C.碳酸钠处导气管应该在液面上方,防止倒吸,C项错误;
D.溴的化学式为Br2,其容易挥发,沸点58.78℃,苯是无色液体,沸点80.1℃,二者互溶,可利用蒸馏方法,用60-70℃水浴加热先馏出液溴,剩下的是苯,溴会溶于苯,D项错误;
答案选B。
12.C
【详解】
A.CO2的密度大于空气,可用导管长进短出的排空气法收集,A与题意不符;
B.用蒸馏的方法制取蒸馏水,使用直形冷凝管,且冷却水为下进上出,B与题意不符;
C.浓盐酸易挥发,与硅酸钠反应的为二氧化碳或HCl,不能证明碳酸的酸性大于硅酸,C符合题意;
D.碳酸钠溶液与乙酸乙酯互不相溶,可用分液漏斗分离,D与题意不符;
答案为C。
13.B
【详解】
A.浓氨水与氧化钙混合生成氨气,氨气的密度比空气小,不能使用向上排空气法收集氨气,故A错误;
B.浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,氢氧化钠能够吸收尾气中的二氧化硫,防止污染空气,故B正确;
C.稀硫酸与锌反应生成氢气,氢气的密度比空气小,不能使用向上排空气法收集氢气,也不能用NaOH溶液进行尾气处理,故C错误;
D.双氧水滴入二氧化锰固体中,分解放出氧气,氧气密度大于空气,能用向上排空气法收集,氧气不需要进行尾气处理,故D错误;
故选B。
14.C
【详解】
A.氯气和氯化氢都能溶于水,且氯气与水反应,洗气应该长进短出,故A不能达到实验目的;
B.铜和稀硝酸反应生成一氧化氮,集气瓶中含有空气,能氧化一氧化氮生成二氧化氮,不能用排空气法收集一氧化氮,故B不能达到实验目的;
C.装置中隔热层防止热量散失,温度计测量反应温度,有环形玻璃搅拌棒,装置符合测定中和反应的反应热要求,故C能达到实验目的;
D.装置中的长颈漏斗应插入液面一下,才能防止二氧化碳从长颈漏斗逸出,否则无法收集二氧化碳,故D不能达到实验目的;
答案选C。
15.D
【详解】
A.氯气难溶于饱和食盐水,所以不能用饱和氯化钠溶液吸收氯气,应选用氢氧化钠溶液吸收,故A不选;
B.二氧化硫为有毒有害且密度比空气密度大的气体,所以收集二氧化硫应选用向上排空气法收集,且该装置无尾气处理装置,故B不选;
C.碳酸氢钠受热易分解,所以不能采用C装置干燥碳酸氢钠,故C不选;
D.配置一定物质量浓度的溶液定容时,胶头滴管悬空在离瓶口1cm左右处,视线要与刻度下处于同一水平,故选D。
答案选D。
16.B
【详解】
A.固体药品的溶解应在烧杯中进行,故A项错误;
B.SO2密度比空气大,利用向上排空气法收集,过量的二氧化硫用NaOH溶液吸收,同时可以防倒吸,故B项正确;
C.温度计应伸入到液面以下,故C项错误;
D.蒸发过程中锰离子会发生水解,故D项错误;
故本题选B。
17.A
【详解】
A.根据电流方向可知a为电源的正极,电解时c作阳极,氯离子在阳极放电生成Cl2,氯气具有氧化性,可以用湿润的淀粉KI试纸,A正确;
B、NO易与空气中的O2反应,不能用排空气法收集,B错误;
C、蒸馏时温度计水银球应该放在蒸馏烧瓶的支管出口处,C错误;
D、氯化氢密度大于空气,不能用图示的排空气法收集,D错误;
答案选A。
18.D
【详解】
A. 胶体和溶液中的分散质都可以通过滤纸,除去Fe(OH)3胶体中混有的NaCl溶液应该用渗析,故A错误;
B.二氧化氮能与水反应,不能用排水法收集二氧化氮 ,应用排空气法收集,故B错误;
C.实验室灼烧固体应该在坩埚中 ,蒸发皿是蒸发溶液的,故C错误;
D.符合中和热实验的测定装置,故D正确;
故选:D。
19.C
【分析】
CO2和Na2O2反应生成碳酸钠和氧气,①中盛放的是过氧化钠,②中溶液用于吸收多余的二氧化碳,盛放的是氢氧化钠溶液,③中是浓硫酸,④是收集氧气的装置,采用向上排空气法收集,据此分析。
【详解】
A.②中溶液用于吸收多余的二氧化碳,则装置②中试剂可以是NaOH溶液,故A正确;
B.③中是浓硫酸,用于干燥氧气,故B正确;
C.④是收集氧气的装置,氧气的密度比空气大,则应该选择装置b,故C错误;
D.装置②、③之间应增加盛澄清石灰水的洗气瓶,用于检验二氧化碳是否被完全吸收,故D正确;
故答案为C。
20.C
【详解】
A.Zn与稀H2SO4反应生成ZnSO4和H2,即Zn+H2SO4=ZnSO4+H2↑,生成的气体氢气密度比空气小,不能用向上排空气收集,故A错误;
B.铜和浓硫酸需要在加热的条件下才能反应,生成CuSO4、SO2和H2O,图示装置不能加热,故B错误;
C.石灰石与稀盐酸发生反应,生成CaCl2、CO2和H2O,即CaCO3+2HCl=CaCl2+CO2↑+H2O,反应不需要加热,生成气体二氧化碳密度大于空气,用向上排空气收集,故C正确;
D.常温下,Fe在浓HNO3中产生钝化现象,不能制取NO2,故D错误;
答案为C。
21.当止水夹关闭后,继续反应产生的CO2导致试管内部的压强增大,使盐酸和大理石不再接触,反应停止 AD ①③④⑤
【分析】
图中的装置原理与启普发生器类似,可以视作简易的启普发生器;颗粒状的固体放在多孔筛板上,由于颗粒较大,所以不会从筛板上掉下;当想制备气体时,打开止水夹,并通过长颈漏斗注入溶液使其没过多孔筛板上的固体,开始反应;当想停止制备气体时,关闭止水夹,装置内的压强越来越大,在气压的推动下,使得溶液和固体分离,反应停止,气体不再产生;因此,利用此装置实现即开即停,固体一定要是颗粒状的,并且不能溶解;此外,由于此装置无法加热,对于需要加热的反应也不适用。
【详解】
(1)此装置能实现即开即停的原因是:当止水夹关闭后,继续反应产生的CO2导致试管内部的压强增大,使盐酸和大理石不再接触,反应停止;
(2)A.锌粒是颗粒状且不溶解的固体,该反应也不需要加热,所以能用此装置实现即开即停,A项正确;
B.浓盐酸与MnO2制氯气需要加热条件,所以不能用此装置进行,B项错误;
C.亚硫酸钠能溶于水,所以不能用此装置实现即开即停,C项错误;
D.FeS是不溶于水的块状固体,该反应也不需要加热,所以可以用此装置实现即开即停,D项正确;
答案选AD;
(3)铁架台①起到固定作用,③和⑤组装构成整个装置的核心,竖直放置球形干燥管,利用干燥管出口端较细,起到类似多孔筛板的作用;制备气体时,打开止水夹,并将溶液倒入烧杯中并没过球形干燥管的出口端与内部装填的固体颗粒接触反应生成气体;当制备结束后,关闭止水夹,随着球形干燥管内压强增大,实现固液分离,达到停止反应的目的。
22.acbg afg 过滤 反应物的状态
【分析】
(1)依据常用的气体干燥(除水)装置及实验装置的连接来解答;
(2)依据排水集气法的原理及实验装置的连接来解答;
(3)依据物质的分离和提纯方法来解答;
(4)根据气体发生装置的选择条件分析解答.
【详解】
(1)先干燥后收集,用浓硫酸吸收水蒸气时,气体从长导管c进从短导管b出;氧气密度比空气大,选用向上排空气法收集,氧气从长导管g进入集气瓶底部,空气从短导管f排出;
答案为:a→c→b→g;
(2)气体密度比液体小,排水法收集气体时,气体存储于集气瓶上部,水在集气瓶下部。因此,应让气体从短导管通入集气瓶,水从长导管排出;
答案为:afg;
(3) MnO2是不溶性固体,固液分离可采用过滤的方法;
答案为:过滤;
(4)气体发生装置的选择是由反应条件(是否需要加热)和反应物的状态;
答案为:反应物的状态。
23. 浓氨水和氧化钙(或碱石灰、固体氢氧化钠等) 将导气管通入水槽中,用手或热毛巾捂圆底烧瓶,导气管口有气泡产生,松开手或移走热毛巾后,导气管口形成一段稳定的液柱,则说明气密性良好 ②④ bc ③ 吸取尾气,防止产生污染
【解析】本题分析:本题主要考查实验室制取气体的方法。
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);检查C装置气密性是否良好的操作方法是将导气管通入水槽中,用手或热毛巾捂圆底烧瓶,导气管口有气泡产生。
(2)气体的密度、溶解性、是否与氧气反应是气体收集方法选择的主要依据。下列性质与收集方法无关的是②④。
其中b使用排空气法收集气体,气体没有出口,无法收集;c的试管中未充满水,收集的气体不纯净。故选bc。
(3)若用A装置与D装置相连制取收集X气体,X气体在加热条件下生成,使用向上排气法收集,则X可能是下列气体中的③。
其中在D装置中连接小烧杯的目的是吸取尾气,防止产生污染。
24.MnO2+4H++2Cl-Mn2++2H2O+Cl2↑ NH3·H2O+CaONH3↑+Ca(OH)2 U形管 干燥氨气 D→B→E←C←F 无尾气处理装置 氯气 氯气的密度大于空气,氨气的密度小于空气,采用逆流原理,使氯气、氨气、汞充分混合
【分析】
(1)装置A中利用浓盐酸和MnO2混合加热制氯气,结合守恒法写出发生反应的离子方程式;
(2)装置F中浓氨水加入到CaO中生成氨气和Ca(OH)2,结合原子守恒即可写出发生反应的化学方程式;
(3)碱石灰能吸收水蒸气和酸性气体,根据仪器结构确定盛装碱石灰的仪器名称;
(4) 整个装置分成两部分,一部分是由A装置中的氯气经除杂并干燥后得到干燥的氯气,一部分是由F装置生成的氨气经干燥后得到干燥的氨气,最后将干燥的氯气和氨气一起通入E中制得Hg(NH2)Cl;氯气、氨气和汞蒸气都是有毒气体,需要进行尾气处理;
(5)结合气体充分混合的目的,根据氯气和氨气的密度相对大小分析;
(6)已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色),得Hg(NH2)Cl~~ Hg2+~~4I—,结合关系式并根据滴定时消耗的KI溶液的体积即可计算样品的纯度。
【详解】
(1)装置A中利用浓盐酸和MnO2混合加热制氯气,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++2H2O+Cl2↑;
(2) 装置F中浓氨水加入到CaO中生成氨气和Ca(OH)2,发生反应的化学方程式为NH3·H2O+CaONH3↑+Ca(OH)2;
(3) 根据仪器结构确定盛装碱石灰的仪器名称为U形管;碱石灰能吸收水蒸气和酸性气体,因此利用碱石灰干燥氨气;
(4)整个装置分成两部分,一部分是由A装置中的氯气经除杂并干燥后得到干燥的氯气,一部分是由F装置生成的氨气经干燥后得到干燥的氨气,最后将干燥的氯气和氨气一起通入E中制得Hg(NH2)Cl,则整个装置的仪器连接顺序为A→D→B→E←C←F,该实验的不足之处是没有尾气处理装置;
(5) 氯气的密度大于空气,氨气的密度小于空气,采用逆流原理,可使氯气、氨气、汞充分混合,故装置E中短导管a通入的气体是氯气,也是导管ab采用长短不同的根本原因;
(6)已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色),得Hg(NH2)Cl~~ Hg2+~~4I—,滴定时消耗的KI溶液V mL,KI的物质的量为V×10-3L×0.1mol/L=0.1V×10-3mol,则样品的纯度为=。
25. ③ E装置中产生黑色沉淀 473 K 0.50
【详解】
(1) 装置A中甲酸与浓硫酸在加热条件下生成CO和H2O,反应的化学方程式为。
(2)由制取原理可知,温度在50~80 ℃的时候利于的生成,水浴加热可以更好的控制温度,且可以避免温度过高,所以选用装置③。
(3) CO及与装置中空气混合在加热条件下会发生爆炸,E装置中生成黑色沉淀Pd的时候说明装置中的空气已经排尽,此时可以加热装置C。
(4) 323 K是49.85 ℃,473 K是199.85 ℃,根据可知,在180~200 ℃的时候生成Ni单质,所以高纯镍粉在封管的473 K温度区域端生成。
(5) n(HCOOH)=11.5 g÷46 g/mol=0.25 mol,参加反应n(Ni)= 2.95 g÷59 g/mol=0.05 mol,则消耗n(CO)= 0.05 mol×4=0.2 mol,剩余的n(CO)=0.05 mol用PdCl2来吸收,根据可知,消耗n(PdCl2)=0.05 mol,其浓度为0.05 mol÷0.1 L=0.50 mol/L。
26.分液漏斗 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 ② d +3
【分析】
根据题中图示信息可知,装置A为制取Cl2的发生装置;装置B是除去Cl2中的HCl气体;装置C是干燥Cl2;装置D是制取ClO2气体装置;装置E除去ClO2中的Cl2装置;装置F是收集ClO2气体装置;装置G是安全瓶的作用;最后接一个尾气吸收装置;据此解答。
【详解】
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,由图可知,仪器P的名称是分液漏斗;答案为分液漏斗。
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;答案为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(3)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水;答案为饱和食盐水,浓硫酸。
(4)F为ClO2收集装置,因ClO2气体的密度比空气密度大,且易溶于水,应选用的装置是②,其中与E装置导管相连的导管口是d;答案为②,d。
(5)钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得(+1)+x+(-2)×2=0,则x=+3价;答案为+3。
27.检查装置的气密性 排出装置内残留的空气(或:防止装置内残留空气中的O2将NO氧化) 250mL容量瓶 玻璃棒 Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O 3NO2+H2O2HNO3+NO 3mol·L-1稀硝酸 氢氧化钠溶液 装置②中液面上方气体仍为无色,装置③中液面上方气体由无色变为红棕色
【分析】
①装置是浓硝酸与铜片反应制取NO2,然后与水反应,将NO2转化为NO。②装置与③装置是用来验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,所以②装置盛有稀硝酸,若液面上方气体仍为无色,则证明稀硝酸不能氧化NO,④用来处理NO尾气; ③装置盛有浓硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2,⑤装置盛有氢氧化钠溶液,用来处理尾气NO2。
【详解】
(1)制取气体的装置在使用之前要先检查装置的气密性。因为NO易被空气氧化,所以在牵涉到物质能与装置中的空气反应时,一定要先排出装置内残留的空气。
(2)配制一定物质的量浓度的溶液时,需要用到的玻璃仪器有量筒、烧杯、胶头滴管、一定规格的容量瓶、玻璃棒。
(3) ①装置是浓硝酸与铜片反应制取NO2,所以其反应为Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O。
(4) ①装置生成了NO2,然后NO2与水反应。
(5) 由分析可知②装置与③装置是用来验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,所以②装置盛有稀硝酸
(6)由分析可知③装置盛有稀硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2,⑤装置盛有氢氧化钠溶液,用来处理尾气NO2。
(7) ②装置盛有稀硝酸,若液面上方气体仍为无色,则证明稀硝酸不能氧化NO;③装置盛有浓硝酸,若液面上方气体由无色变为红棕色,则证明浓硝酸能将NO氧化成NO2。
【点睛】
验证某个物质的性质,首先要制取该物质,然后验证性质,最后要考虑尾气处理。在牵涉到物质能与装置中的空气反应时,为了避免空气对实验物质的影响,要先排出装置内残留的空气。
2024届高三化学一轮专题训练:常见气体的制备与收集: 这是一份2024届高三化学一轮专题训练:常见气体的制备与收集,共20页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
2022届高三化学一轮复习化学实验专题细练13常见气体制备收集实验流程含解析: 这是一份2022届高三化学一轮复习化学实验专题细练13常见气体制备收集实验流程含解析,共21页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
2022届高三化学一轮复习化学实验专题细练12常见气体的制备与收集含解析: 这是一份2022届高三化学一轮复习化学实验专题细练12常见气体的制备与收集含解析,共24页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。