

专题讲座(十二) 晶胞参数、坐标参数的分析与应用(精讲)-2022年高考化学一轮复习讲练测
展开智能点一、常见晶体结构分析
1.常见原子晶体结构分析
2.常见分子晶体结构分析
3.常见金属晶体结构分析
(1)金属晶体的四种堆积模型分析
(2)金属晶胞中原子空间利用率计算
空间利用率=eq \f(球体积,晶胞体积)×100%,球体积为金属原子的总体积。
①简单立方堆积
如图所示,原子的半径为r,立方体的棱长为2r,则V球=eq \f(4,3)πr3,V晶胞=(2r)3=8r3,空间利用率=eq \f(V球,V晶胞)×100%=eq \f(\f(4,3)πr3,8r3)×100%≈52%。
②体心立方堆积
如图所示,原子的半径为r,体对角线c为4r,面对角线b为eq \r(2)a,由(4r)2=a2+b2得a=eq \f(4,\r(3))r。1个晶胞中有2个原子,故空间利用率=eq \f(V球,V晶胞)×100%=eq \f(2×\f(4,3)πr3,a3)×100%=eq \f(2×\f(4,3)πr3,\f(4,\r(3))r3)×100%≈68%。
③六方最密堆积
如图所示,原子的半径为r,底面为菱形(棱长为2r,其中一个角为60°),则底面面积S=2r×eq \r(3)r=2eq \r(3)r2,h=eq \f(2\r(6),3)r,V晶胞=S×2h=2eq \r(3)r2×2×eq \f(2\r(6),3)r=8eq \r(2)r3,1个晶胞中有2个原子,则空间利用率=eq \f(V球,V晶胞)×100%=eq \f(2×\f(4,3)πr3,8\r(2)r3)×100%≈74%。
④面心立方最密堆积
如图所示,原子的半径为r,面对角线为4r,a=2eq \r(2)r,V晶胞=a3=(2eq \r(2)r)3=16eq \r(2)r3,1个晶胞中有4个原子,则空间利用率=eq \f(V球,V晶胞)×100%=eq \f(4×\f(4,3)πr3,16\r(2)r3)×100%≈74%。
(3)晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 ml该晶胞中含有x ml 微粒,其质量为xM g(M为微粒的相对分子质量);若该晶胞的质量为ρa3 g(a3为晶胞的体积),则1 ml晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
4.常见离子晶体结构分析
智能点二、原子分数坐标参数
1.概念
原子分数坐标参数,表示晶胞内部各原子的相对位置。
2.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
3.金刚石晶胞中碳原子坐标的确定
以金刚石晶胞结构为例,金刚石晶体整体上是正四面体立体网状结构。每个碳原子L能层的4个电子采用sp3杂化,形成4个等同的杂化轨道,相邻的两个碳原子之间形成σ键。这样每个碳原子与周围4个碳原子形成4个σ键,每个碳原子都是直接相连的4个碳原子的重心。
在一个金刚石晶胞中有8个碳原子位于立方体的顶点,6个碳原子位于面心,4个碳原子位于晶胞内部。每个晶胞中8个顶点中有4个顶点、6个面心和4个晶胞内部的碳原子形成4个正四面体,每个正四面体的4个顶点分别是一个晶胞顶点和这个顶点所在平面的面心,正四面体中心是晶胞内的1个碳原子。
用解析几何知识研究晶体中各个微粒间的位置关系更具体更直接。以底面一个顶点的碳原子(通常取后左下)为原点建立一个三维坐标系。
原点上的原子坐标为(0,0,0),晶胞边长参数看作1,并据此分析坐标参数。在晶胞进行“无隙并置”时,可以看出,8个顶点的原子都可以作为原点,注意看清楚,与这个原点原子重合的是晶胞上哪一个顶点的碳原子。所以顶点上的8个原子坐标都是(0,0,0),这与纯粹立体几何不同,所以高中阶段我们只标注顶点以外的晶胞内和晶胞上点的坐标;棱心和面心坐标点中数据中不会出现“1”。
以下是晶胞中各点碳原子对应的三维坐标和晶体中坐标的对应关系。
(1)6个面心坐标
(2)12个棱中心坐标
(3)晶胞内部4个碳原子的坐标
金刚石晶胞有两种取向,由于金刚石晶胞内部有4个碳原子,在空间分布是不对称的,所以从不同方向观察晶胞时,内部的4个碳原子的位置是不相同的。我们把左边的图叫作取向1,右边的图叫作取向2
它们各自绕竖直中心轴旋转90°,就能够变为对方。金刚石晶胞内4个碳原子坐标:
取向1:
取向2:
所以金刚石晶胞的取向不同时,晶胞内部不对称的4个原子的坐标会发生改变。
4.常见晶胞的原子坐标
1)金刚石晶胞的原子坐标
(1)取向一:
金刚石晶胞中碳原子的坐标:
8个顶点碳原子的坐标:0,0,0;
6个面中心碳原子的坐标:1/2,0,1/2;1/2,1/2,0;0,1/2,1/2;
4个内部碳原子的坐标:1/4,1/4,3/4;3/4,1/4,1/4;3/4,3/4,3/4;1/4,3/4,1/4;
(2)取向二:
金刚石晶胞中碳原子的坐标:
8个顶点碳原子的坐标:0,0,0;
6个面中心碳原子的坐标:1/2,0,1/2;1/2,1/2,0;0,1/2,1/2;
4个内部碳原子的坐标:1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4;
注:金刚石晶胞的取向不同时,即使都是取前左下的顶点原子作原点,晶胞内部不对称的4个碳原子的坐标,也会发生改变。
2)氟化钙晶体:
每个CaF2晶胞有4个Ca2+和8个F-原子分数坐标如下:
3)氯化钠晶胞:
每个晶胞含有4个Cl-和4个Na+,它们的原子分数坐标为:
注:碱金属的卤化物、氢化物,碱土金属的氧化物、硫化物、硒化物、碲化物,过渡金属的氧化物、硫化物,以及间隙型碳化物、氮化物都属NaCl型结构。
智能点三、宏观晶体密度与微观晶胞参数的关系
1.密度的计算式:
2.计算类型
晶体的密度有两种计算形式,一种是知道晶胞边长和晶胞结构进行的计算,一种是知道原子或离子半径和晶胞结构进行的计算。
1)知道晶胞边长和晶胞结构进行的计算
若晶胞为正方体,边长为a pm,含有b个分子,分子的相对分子质量为M,则密度的计算过程为(别记结论,学会计算过程)
晶胞的体积为:(a×10-12m)3= a3×10-36m3
晶胞中分子的总质量为:m=nM=(b/NA)M= bM/6.02×1023g
ρ=M/V=(bM/6.02×1023g) /( a3×10-36m3)=(bM×1013)/(6.02×a3)g/m3
(1)CO2分子晶体的密度计算:
已知CO2分子晶体的结构如下图(面心立方),晶胞边长为572pm(计算数据)。
①晶胞中的分子数目计算:8×1/8+6×1/2=4
一个晶胞中有4个CO2。
②晶体密度计算:
m=nM=[4/(6.02×1023/ml)]×44g/ml=2.9236×10-22g
V=(572×10-12)3m3=1.8715×10-28m3
ρ=m/V=2.9236×10-22g /1.8715×10-28m3=1.562×106g/m3=1.562g/ cm3。
(2)P(钋),相对原子质量为209,晶胞边长为336pm。
①晶胞中原子数目计算:8×1/8=1。
②密度计算:
m=nM=[1/(6.02×1023/ml)]×209g/ml=3.472×10-22g
V=(336×10-12)3m3=3.7933×10-29m3
ρ=m/V=3.472×10-22g /3.7933×10-29m3=9.153 ×106g/m3=9.153g/cm3
2)知道原子或离子半径和晶胞结构进行的计算
先用原子或离子的半径计算出晶胞的边长,然后再进行密度计算。
(1)Na的体心立方
Na的原子半径r=186pm。
①晶胞中的原子数目计算:8×1/8+1=2。
②密度计算:
先计算晶胞的边长a:根据体对角线=√3a=4r,
边长a=4r/√3=4×186pm/√3=429.56pm。
m=nM=[2/(6.02×1023/ml)]×23g/ml=7.6412×10-23g
V=(429.56×10-12)3m3=7.9263×10-29m3
ρ=m/V=7.6412×10-23g /7.9263×10-29m3=9.64 ×105g/m3=0.964g/cm3
(2)Zn的六方堆积:
Zn的范德华半径为139pm。
①正六棱柱中原子数目计算:12×1/6+2×1/2+3=6
②密度计算:六方最密堆积不是正方体晶胞,不能用正方体的公式计算。
用上面的正六棱柱计算,正六棱柱的边长为278pm。
若边长为r,体积为24√2 r3。(计算式见空间利用率计算的(3))
V=24√2 r3=24√2×(139×10-12m)3=9.1153×10-29m3
m=nM=[6/(6.02×1023/ml)]×65.38g/ml=6.5163×10-22g
ρ=m/V=6.5163×10-22g /9.1153×10-29m3=7.15 ×106g/m3=7.15g/cm3
(3)金刚石原子晶体的结构
①晶胞中的原子数目计算:8×1/8+6×1/2+4=8
②密度计算:以金刚石结构为例,C的共价半径为77pm。
大立方体的边长为8r/√3,即355.65 pm。(计算式见空间利用率计算的(4))
m=nM=[8/(6.02×1023/ml)]×12g/ml=1.5947×10-22g
V=(355.65×10-12)3m3=4.4985×10-29m3
ρ=m/V=1.5947×10-22g /4.4985×10-29m3=3.545 ×106g/m3=3.545g/cm3
(4)离子晶体的密度计算:
①NaCl:Na+的离子半径为95pm,Cl-的离子半径为181pm
晶胞边长的计算:2r(Na+)+2r(Cl-)=552pm。
其中含Na+4个,Cl-4个。
m=nM=[4/(6.02×1023/ml)]×23g/ml+[4/(6.02×1023/ml)]×35.45g/ml=3.8837×10-22g
V=(552×10-12)3m3=1.682×10-28m3
ρ=m/V=3.8837×10-22g /1.682×10-28m3=2.309×106g/m3=2.309g/cm3
②CsCl:Cs+的离子半径为169pm,Cl-的离子半径为181pm。
晶胞边长的计算:[2r(Cs+)+2r(Cl-)]/√3=404.15pm。
其中含Cs+1个,Cl-1个。
m=nM=[1/(6.02×1023/ml)]×132.9g/ml+[1/(6.02×1023/ml)]×35.45g/ml=2.7965×10-22g
V=(404.15×10-12)3m3=6.6013×10-29m3
ρ=m/V=2.7965×10-22g /6.6013×10-29m3=4.236×106g/m3=4.236g/cm3
③CaF2:Ca2+的离子半径为99pm,F-的离子半径为136pm。
右侧为晶胞的八分之一
晶胞边长计算为2{[2r(Ca2+)+2r(F-)]/√3}=542.71pm。
其中含Ca2+4个,F-8个,则密度为
M=nm=[4/(6.02×1023/ml)]×40g/ml+[8/(6.02×1023/ml)]×19g/ml=5.1827×10-22g
V=(542.71×10-12)3m3=1.5985×10-28m3
ρ=m/V=5.1827×10-22g /1.5985×10-28m3=3.242×106g/m3=3.242g/cm3
知能点四 晶体中堆积方式不同的棱长与原子半径的关系
1.面心立方最密堆积,金属原子之间的距离为面对角线的一半,r为金属原子的直径。
如果边长为acm,半径r=(/4)acm ,
2.体心立方最密堆积,金属原子之间的距离为体心对角线的一半,为金属原子的直径。
如果边长为acm,则半径r=(/4)acm
3.六方最密堆积
4.简单立方堆积
立方体的边长为acm,则r=a/2 cm。
5.金刚石
图中原子均为碳原子,这种表示为更直观。如边长为acm,碳原子的半径为(/8)acm。
智能点五 空间利用率的计算
1、空间利用率的计算式
若原子的半径为R,晶胞中原子有n个,立方晶胞的边长为a:
单个原子的体积为4πr3/3,立方晶胞的体积为a3。
则空间利用率为
2、各种晶胞的空间利用率计算
(1)金属晶体的简单立方
①晶胞中原子数目计算:8×1/8=1。
②空间利用率计算:设球的半径为r,则正方体的边长为2r。
原子的总体积为4πr3/3。正方体的体积为8r3。
空间利用率为(4πr3/3)/(8 r3)=π/6=52.36%
(2)金属晶体的体心立方
①晶胞中的原子数目计算:8×1/8+1=2。
②空间利用率计算:在体心立方中,设为球半径为r,
则正方体的体对角线为4r。
又因为正方体的体对角线是边长的√3倍,则边长为4r /√3。
原子的总体积为2×4πr3/3,正方体的体积为64r3/3√3。
空间利用率为(2×4πr3/3)/(64r3/3√3)=π√3/8= 68.02%
(3)金属晶体的六方堆积
左图的粉色区域代表一个晶胞
由于1个正六棱柱相当于3个晶胞,所以用六棱柱的1/3进行计算。
①正六棱柱中原子数目计算:12×1/6+2×1/2+3=6。
则晶胞中的原子数目为6×1/3=2。
②空间利用率计算:设球的半径为r,则面上正六边形的边长为2r。
正六棱柱的高的计算:
正六棱柱的高为两个边长为2r的正四面体的高。边长2r的正四面体的体高为2√6r/3,则正六棱柱的高为4√6r/3。
正六边形的面积为6×√3r2=6√3r2。
正六棱柱的体积为(6√3r2)×(4√6r/3)=24√2 r3。
晶胞体积为正六棱柱的1/3,为8√2r3。
原子的总体积为2×4πr3/3=8πr3/3。
空间利用率为(8πr3/3)/(8√2r3)=π/3√2= 74.05%
(4)金刚石原子晶体的结构
①晶胞中的原子数目计算:8×1/8+6×1/2+4=8
②空间利用率计算:根据两个C之间紧密相邻,若C的原子半径为r,则C-C为2r。
大立方体切8个小立方体,其中一个如右图。中间球位于小立方体的中心。小立方体的体对角线为4r(自己思考一下),则小立方体的边长为4r/√3。
求得大立方体的边长为8r/√3,体积为512r3/3√3。
大立方体内的碳原子数为8,碳原子的总体积为8×4πr3/3=32πr3/3。
所以空间利用率为(32πr3/3)/(512 r3/3√3)=π√3/16=34.01%
【典例剖析】
高频考点1 晶胞参数与晶体密度间的互算
例1.(2019·全国卷Ⅰ·节选)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=________pm,Mg原子之间最短距离y=________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是____________g·cm-3(列出计算表达式)。
【变式训练】 (2020·河南六市高三第二次联合调研检测节选)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a nm、b nm和c nm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。
据此推断该晶胞中Cs原子的数目为________;CsSiB3O7的摩尔质量为M g·ml-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为________g·cm-3(用含字母的代数式表示)。
高频考点2 原子空间利用率的计算
例2.(2016·全国卷Ⅲ·节选)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·ml-1和MAs g·ml-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
【变式训练】(2020·哈尔滨三中模拟)铁原子有两种堆积方式,相应地形成两种晶胞(如图甲、乙所示),其中晶胞乙的堆积方式是________,晶胞甲中原子的空间利用率为________(用含π的代数式表示)。
高频考点3 晶胞中原子坐标的确定
例3.某金属晶体中原子的堆积方式如图所示,已知该金属的原子半径为a cm,晶胞的高为b cm,A、C、D三点原子的坐标参数分别为A(0,0,0)、C(2a,0,0)、D(0,0,b),则B点原子的坐标参数为________。
【变式训练】如图所示为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0),B为(eq \f(1,2),0,eq \f(1,2)),C为(eq \f(1,2),eq \f(1,2),0)。则D原子的坐标参数为________。
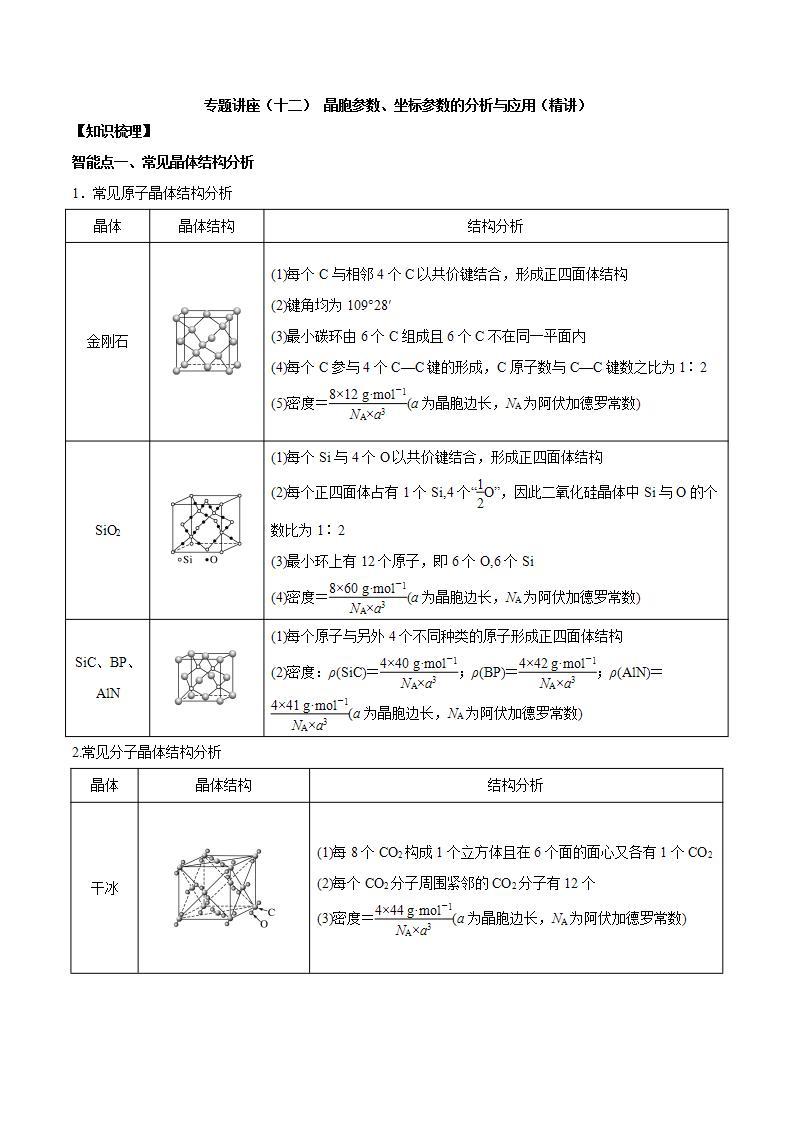
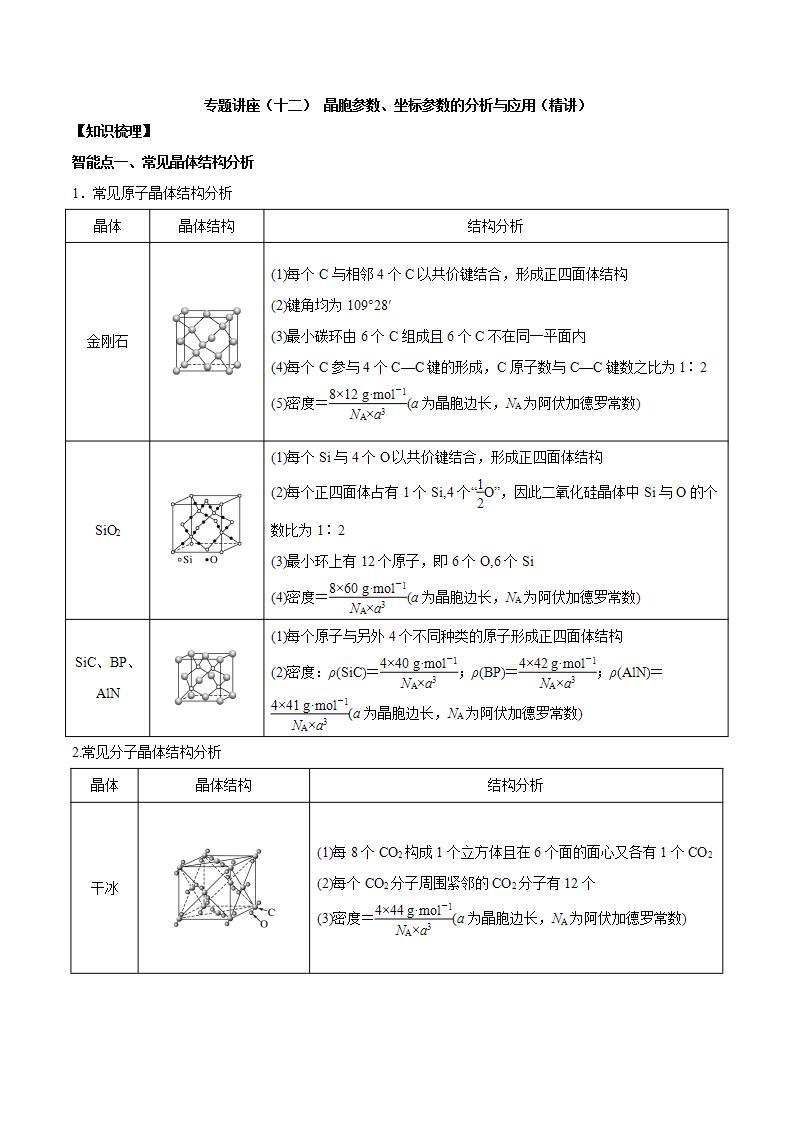
晶体
晶体结构
结构分析
金刚石
(1)每个C与相邻4个C以共价键结合,形成正四面体结构
(2)键角均为109°28′
(3)最小碳环由6个C组成且6个C不在同一平面内
(4)每个C参与4个C—C键的形成,C原子数与C—C键数之比为1∶2
(5)密度=eq \f(8×12 g·ml-1,NA×a3)(a为晶胞边长,NA为阿伏加德罗常数)
SiO2
(1)每个Si与4个O以共价键结合,形成正四面体结构
(2)每个正四面体占有1个Si,4个“eq \f(1,2)O”,因此二氧化硅晶体中Si与O的个数比为1∶2
(3)最小环上有12个原子,即6个O,6个Si
(4)密度=eq \f(8×60 g·ml-1,NA×a3)(a为晶胞边长,NA为阿伏加德罗常数)
SiC、BP、AlN
(1)每个原子与另外4个不同种类的原子形成正四面体结构
(2)密度:ρ(SiC)=eq \f(4×40 g·ml-1,NA×a3);ρ(BP)=eq \f(4×42 g·ml-1,NA×a3);ρ(AlN)=eq \f(4×41 g·ml-1,NA×a3)(a为晶胞边长,NA为阿伏加德罗常数)
晶体
晶体结构
结构分析
干冰
(1)每8个CO2构成1个立方体且在6个面的面心又各有1个CO2
(2)每个CO2分子周围紧邻的CO2分子有12个
(3)密度=eq \f(4×44 g·ml-1,NA×a3)(a为晶胞边长,NA为阿伏加德罗常数)
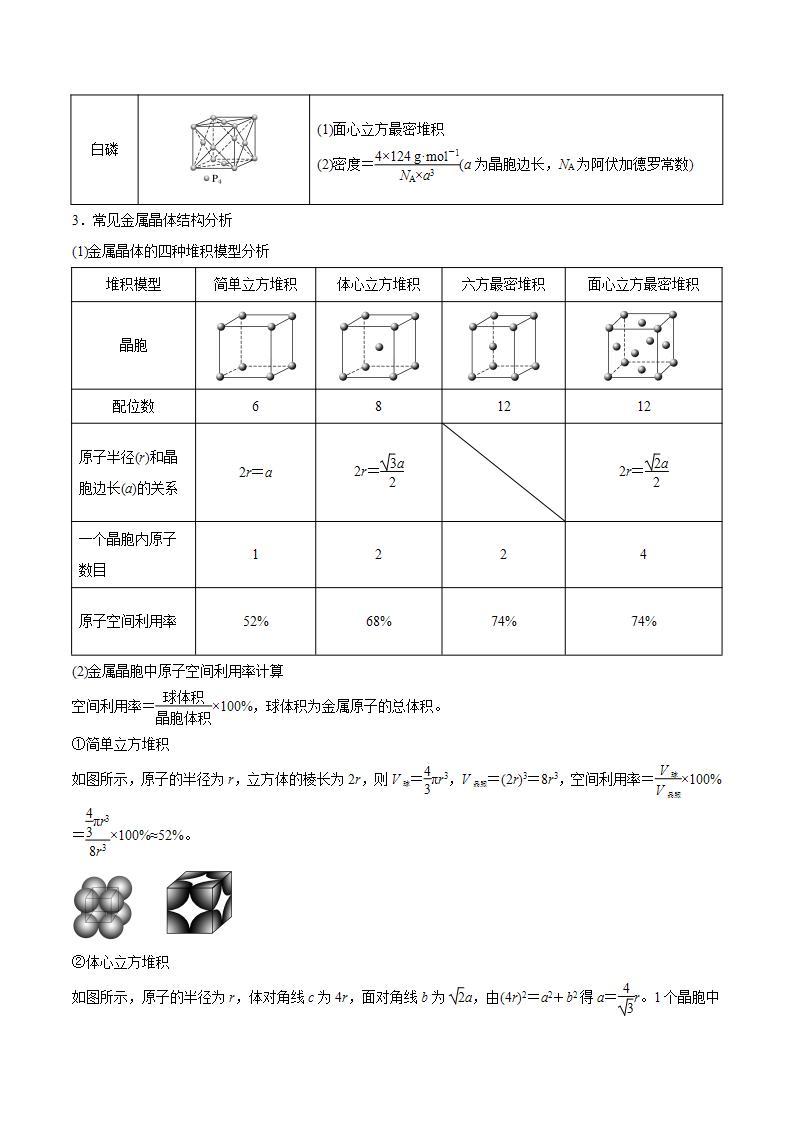
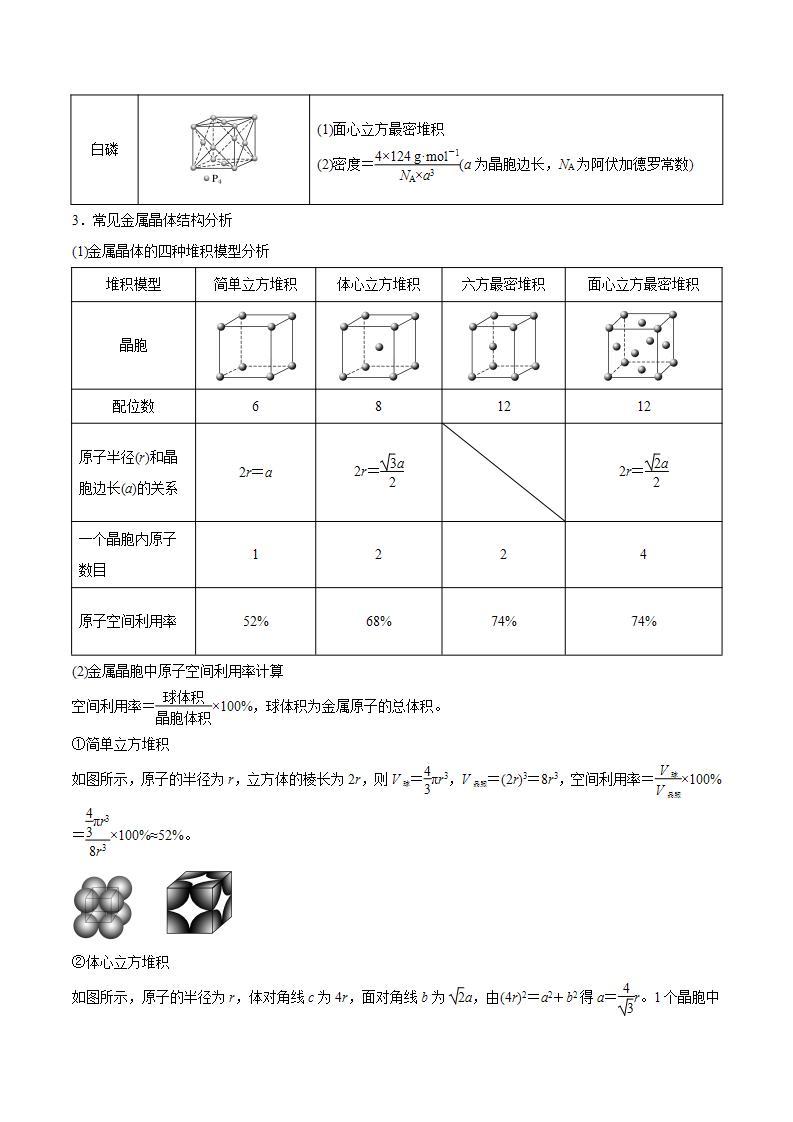
白磷
(1)面心立方最密堆积
(2)密度=eq \f(4×124 g·ml-1,NA×a3)(a为晶胞边长,NA为阿伏加德罗常数)
堆积模型
简单立方堆积
体心立方堆积
六方最密堆积
面心立方最密堆积
晶胞
配位数
6
8
12
12
原子半径(r)和晶胞边长(a)的关系
2r=a
2r=eq \f(\r(3)a,2)
2r=eq \f(\r(2)a,2)
一个晶胞内原子数目
1
2
2
4
原子空间利用率
52%
68%
74%
74%
NaCl型
CsCl型
ZnS型
CaF2型
晶胞
配位数及影响因素
配位数
6
8
4
F-:4;Ca2+:8
影响
因素
阳离子与阴离子的半径比值越大,配位数越多,另外配位数还与阴、阳离子的电荷比有关等
密度的计算(a为晶胞边长,NA为阿伏加德罗常数)
eq \f(4×58.5 g·ml-1,NA×a3)
eq \f(168.5 g·ml-1,NA×a3)
eq \f(4×97 g·ml-1,NA×a3)
eq \f(4×78 g·ml-1,NA×a3)
上面心
下面心
左面心
右面心
前面心
后面心
三维坐标
晶体中坐标
上面四条棱
三维坐标
晶体中坐标
下面四条棱
三维坐标
晶体中坐标
垂直底面四条棱
三维坐标
晶体中坐标
Ca2+:
0,0,0
1/2,1/2,0
1/2,0,1/2
0,1/2,1/2
F-:
1/4,1/4,1/4
3/4,1/4,1/4
1/4,3/4,1/4
1/4,1/4,3/4
3/4,3/4,1/4
3/4,1/4,3/4
1/4,3/4,3/4
3/4,3/4,3/4
Na+:
1/2,1/2,1/2
1/2,0,0
0,1/2,0
0,0,1/2
Cl-:
0,0,0
1/2,1/2,0
0,1/2,1/2
1/2,0,1/2
高考化学一轮复习讲练 第12章 专题突破38 晶胞参数、坐标参数的分析与应用 (含解析): 这是一份高考化学一轮复习讲练 第12章 专题突破38 晶胞参数、坐标参数的分析与应用 (含解析),共5页。试卷主要包含了晶胞有两个基本要素,铜与氧元素形成的晶胞如下图所示等内容,欢迎下载使用。
新高考化学一轮复习讲义 第5章 第31讲 热点强化11 晶胞参数、坐标参数的分析与应用: 这是一份新高考化学一轮复习讲义 第5章 第31讲 热点强化11 晶胞参数、坐标参数的分析与应用,共6页。试卷主要包含了全面,扎实训练学科基本技能,培养学生积极的学习态度,有计划等内容,欢迎下载使用。
2022年高考化学一轮复习讲义第12章第55讲 微专题30 晶胞参数、坐标参数的分析与应用 (含解析): 这是一份2022年高考化学一轮复习讲义第12章第55讲 微专题30 晶胞参数、坐标参数的分析与应用 (含解析),共4页。试卷主要包含了原子分数坐标参数等内容,欢迎下载使用。













