
苏教版选修6 实验化学课题1 原电池达标测试
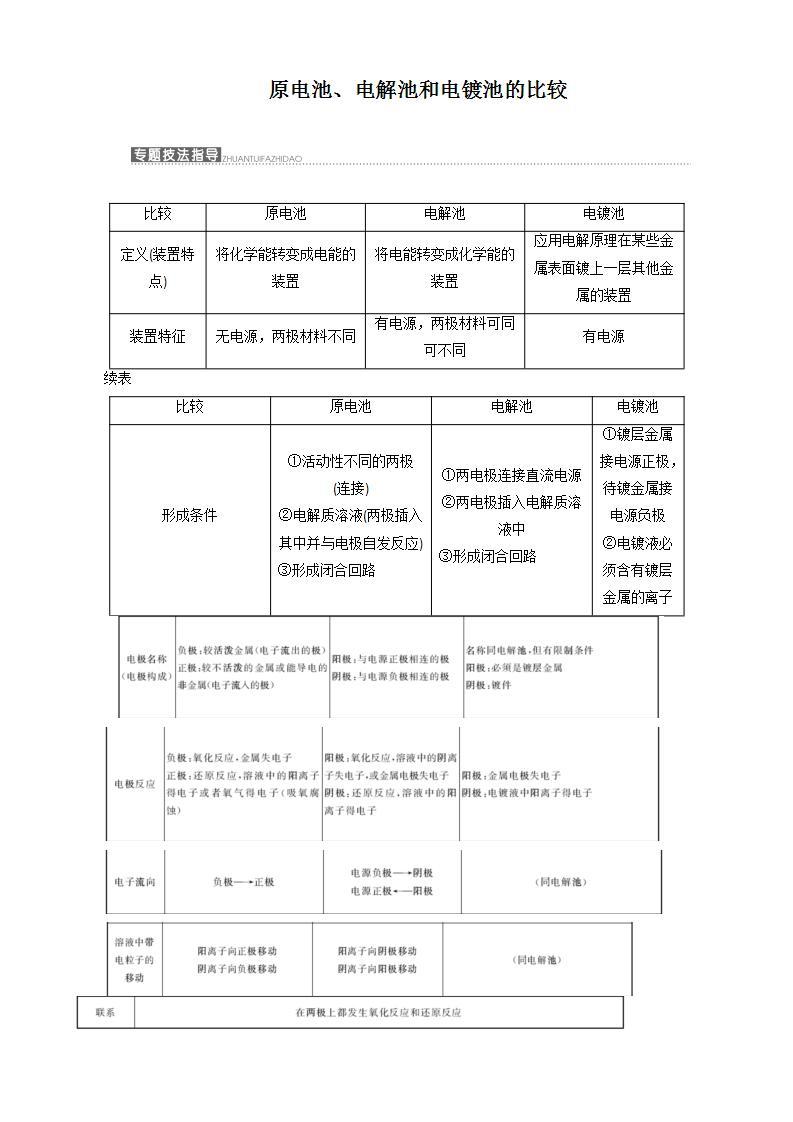
展开原电池、电解池和电镀池的比较
比较 | 原电池 | 电解池 | 电镀池 |
定义(装置特点) | 将化学能转变成电能的装置 | 将电能转变成化学能的装置 | 应用电解原理在某些金属表面镀上一层其他金属的装置 |
装置特征 | 无电源,两极材料不同 | 有电源,两极材料可同可不同 | 有电源 |
续表
比较 | 原电池 | 电解池 | 电镀池 |
形成条件 | ①活动性不同的两极 (连接) ②电解质溶液(两极插入其中并与电极自发反应) ③形成闭合回路 | ①两电极连接直流电源 ②两电极插入电解质溶液中 ③形成闭合回路 | ①镀层金属接电源正极,待镀金属接电源负极 ②电镀液必须含有镀层金属的离子 |
[例] 如图所示:(1)当K1、K2断开时,________片上有气泡产生,生成气体对应的离子方程式为________。
(2)仅K1闭合时,________片上有气泡。生成气体对应的反应式为_______________。
(3)仅K2闭合时,________片上有气泡,总电极反应为_____________________。
[解析] (1)此时锌与稀盐酸直接反应产生H2。
(2)仅K1闭合时,Zn、Cu和盐酸构成原电池,Cu为正极,电极反应为2H++2e-===H2↑,因此铜片上产生气体。
(3)此时为电解池,Cu为阳极,失电子,电极反应为Cu-2e-===Cu2+,H+在锌片上得电子产生H2,总电极反应为Cu+2HCl通电,CuCl2+H2。
[答案] (1)锌 Zn+2H+===Zn2++H2↑
(2)铜 2H++2e-===H2↑
(3)锌 Cu+2HClCuCl2+H2
1.氢镍电池是近几年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式为:H2+NiOOHNi(OH)2。根据此反应式判断,下列叙述中正确的是( )
①电池放电时,电池负极周围溶液的pH不断增大
②电池放电时,镍元素被氧化
③电池充电时,氢元素被还原
④电池放电时,H2在负极上反应
A.①② B.②③
C.③④ D.①④
解析:选C 放电时,H2在原电池负极被氧化为H+,其周围溶液的pH减小。充电时,H+被还原成H2。
2.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②中铜片应与电源负极相连
C.装置③中外电路电流方向:b极→a极
D.装置④中阴极反应:2Cl--2e-===Cl2
解析:选C 装置①是电解池,红色的Cu应在阴极析出,A项错误;电镀时铜片应做阳极,与电源的正极相连,B项错误;氢氧燃料电池是以氢氧燃烧反应为基础的:2H2+O2===2H2O,氢气发生氧化反应为负极(a极),氧气为正极(b极),电子流向从负到正(a→b),电流方向与电子流动方向相反,C项正确;2Cl--2e-===Cl2↑,为氧化反应,故为阳极反应,D项错误。
3.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
下列说法正确的是( )
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O===CO+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28 g固体
解析:选D 从图可知,甲池为原电池(化学能转化为电能)作为外接电源,对乙池、丙池两串联电解池进行电解,电能转化为化学能,A项错误;甲池中通甲醇的一极为负极,电极反应式为:CH3OH-6e-+8OH-===CO+6H2O,B项错误;乙池的石墨电极为阳极,反应方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4,根据“缺啥补啥”可知,电解一段时间后应向乙池加CuO,使CuSO4溶液恢复到原浓度,C项错误;根据电子守恒,甲池中耗氧量与乙池中阴极析出固体(铜)的关系为O2~2Cu,224 mL O2物质的量是0.01 mol,1.28 g铜的物质的量是0.02 mol,D项正确。
高中苏教版第一单元 卤代烃习题: 这是一份高中苏教版第一单元 卤代烃习题,共5页。试卷主要包含了在烃分子中引入卤素原子的方法,卤代烃的作用等内容,欢迎下载使用。
苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护第3课时同步达标检测题: 这是一份苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护第3课时同步达标检测题,共8页。试卷主要包含了金属腐蚀由快到慢的顺序等内容,欢迎下载使用。
高中化学苏教版选修4 化学反应原理专题三 溶液中的离子反应第二单元 溶液的酸碱性第1课时练习题: 这是一份高中化学苏教版选修4 化学反应原理专题三 溶液中的离子反应第二单元 溶液的酸碱性第1课时练习题,共9页。试卷主要包含了常温下,水的离子积常数是多少?等内容,欢迎下载使用。













