



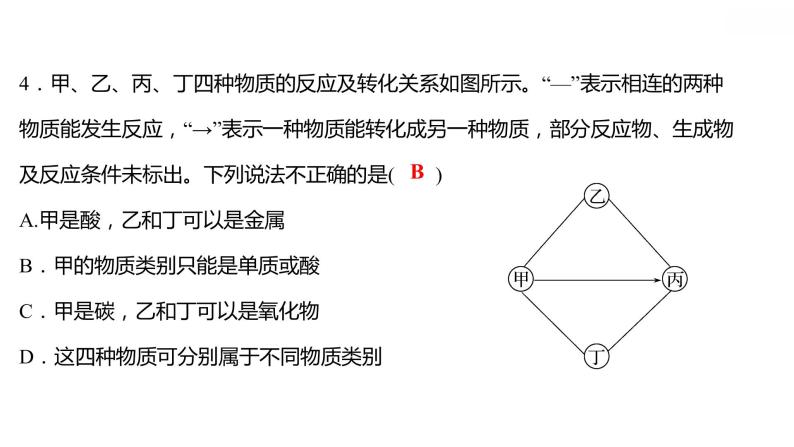

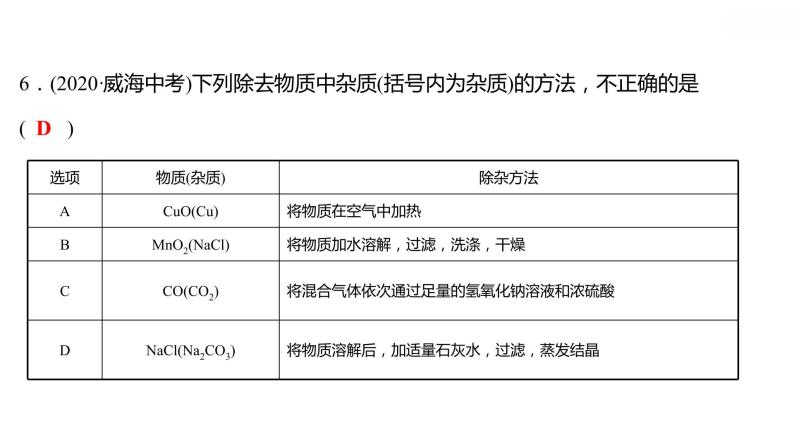
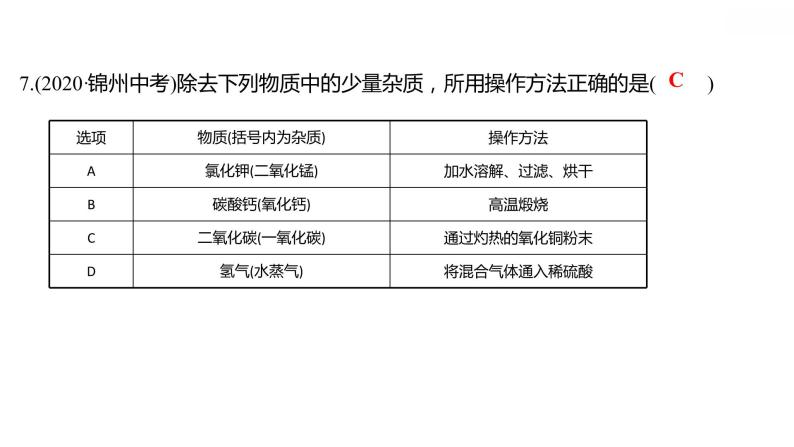
专项训练6 酸、碱、盐之间的转化 习题课件 2021-2022学年科粤版化学九年级
展开烧碱(或火碱、苛性钠)
黑色固体溶解,溶液变蓝
(2)若A、B属于同种类别物质,B为人体胃酸的主要成分,可帮助消化;C为单质;D为氧化物。D的化学式为________;A→B的化学方程式为__________________________________。
BaCl2===BaSO4↓+2HCl
11.(2020·北部湾中考)广西蕴藏丰富的铝土资源,铝工业是广西传统优势产业。某工厂用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取Al2O3,提取流程如图所示:已知:Ⅰ.NaOH+Al(OH)3===NaAlO2+2H2OⅡ.NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
(1)“酸浸”前,通常将铝土矿进行粉碎处理,“粉碎”的主要目的是_________________________________________________________________。(2)经检验,滤渣Ⅰ的主要成分是SiO2。由此可推知SiO2的性质有_________(填序号)。A.难溶于水 B.化学性质很活泼C.不能与盐酸反应 D.不能与NaOH溶液反应
的接触面积,使反应更充分(或加快反应速率,合理即可)
NaOH、NaAlO2、NaCl(缺一不可)
根据上述实验,回答下列问题(1)样品中肯定不存在的物质是__________(写化学式,下同)。(2)白色沉淀乙的化学式为__________。(3)写出图中加入足量稀硝酸产生气体的化学方程式___________________________________________。(4)样品中不能确定是否存在的物质是__________,理由是________________________________________________________________________。
BaCO3+2HNO3===
Ba(NO3)2+H2O+CO2↑
也显碱性,与氯化钡反应有剩余时,也能使酚酞试液变红色
13.(2020·黔东南中考)做“中和反应”实验时,小聪同学向盛有氢氧化钠溶液的烧杯中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止滴加稀硫酸。同学们对反应后溶液中含有哪些溶质展开了讨论。【提出问题】上述实验中发生反应的化学方程式为____________________________________,那反应后溶液中的溶质是什么?【提出猜想】猜想一:溶质是Na2SO4猜想二:溶质是Na2SO4 和NaOH猜想三:溶质是___________________
2NaOH+H2SO4===
Na2SO4+2H2O
Na2SO4 和H2SO4
【查阅资料】Na2SO4 溶液呈中性【实验探究】小聪同学设计如下的实验方案
【方案评价】同学们对小聪的实验方案讨论后认为:①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是 __________________________________ 。 ②方案二也不能证明猜想三是正确的,理由是 __________________________________________ 。 ③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并讨论除此方案外,还可以向烧杯的溶液中加入活泼金属或碳酸盐等物质进行证明。【实验反思】在分析化学反应后所得物质成分时,还需考虑反应物的用量。
硫酸钠也能和氯化钡反应生成
14.(2020·贵港覃塘期末)日常生活中,每位同学都会接触到硬水。某化学兴趣小组同学对硬水进行了一些探究实验,请完成填空。【查阅资料】水的硬度是由水中溶解的可溶性钙、镁化合物引起的。(1)日常生活中常用煮沸的方法将硬水软化,这种方法可靠吗?小组同学设计了如下实验。
实验结论是_________________________________。(2)小组同学对某硬水中为什么含有碳酸氢钙非常感兴趣,当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O===Ca(HCO3)2。小组同学向碳酸钠溶液中通入一定量的二氧化碳,所得溶液的溶质是什么?于是他们对此开展实验探究(不考虑二氧化碳和碳酸作为溶质的情况)。【查阅资料】碳酸氢钠与氯化钙不反应。【提出猜想】猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为_____________________。
用煮沸的方法可以降低水的硬度
Na2CO3和NaHCO3
【设计实验】写出实验步骤a中发生反应的化学方程式:____________________________________。
Na2CO3+CaCl2===CaCO3↓+
化学九年级下册8.5 化学肥料图片课件ppt: 这是一份化学九年级下册<a href="/hx/tb_c12511_t3/?tag_id=26" target="_blank">8.5 化学肥料图片课件ppt</a>,共26页。PPT课件主要包含了新课导入,常用化肥,尿素CONH22,氮肥壮叶,灰色能溶于水,灰色部分溶于水,磷肥壮果,氯化钾KCl,钾肥壮茎,无色晶体易溶于水等内容,欢迎下载使用。
化学九年级下册8.3 酸和碱的反应集体备课课件ppt: 这是一份化学九年级下册<a href="/hx/tb_c94345_t3/?tag_id=26" target="_blank">8.3 酸和碱的反应集体备课课件ppt</a>,共23页。PPT课件主要包含了新课导入,溶液的导电性,酸与碱的中和反应,步骤与现象,解释与结论,不变色,非金属,中和反应的应用,改良酸性或碱性的土壤,废水处理等内容,欢迎下载使用。
安徽中考复习 人教版化学 教材基础 微型专题四 酸、碱、盐之间的转化 课件: 这是一份安徽中考复习 人教版化学 教材基础 微型专题四 酸、碱、盐之间的转化 课件,共16页。













