





高中化学第一节 化学反应与能量变化课堂教学课件ppt
展开【复习回顾】为什么有的化学反应吸热、有的反应放热?
因为反应物与生成物的总能量不一样高、或者旧键断裂吸收的总能量与新键生成所释放的总能量不相同。
一次能源:直接从自然界取得的能源。
二次能源:一次能源经过加工、转换得到的能源。
现代社会中使用最为普遍的能源?
电能——又称电力(二次能源)电力是怎样产生的?
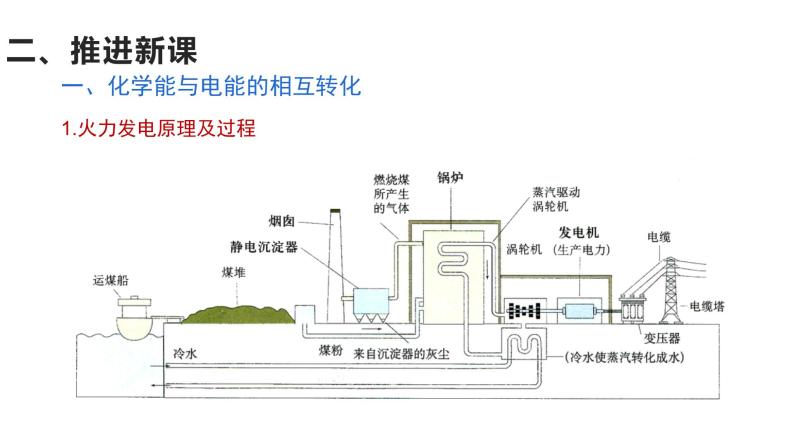
1.火力发电原理及过程
一、化学能与电能的相互转化
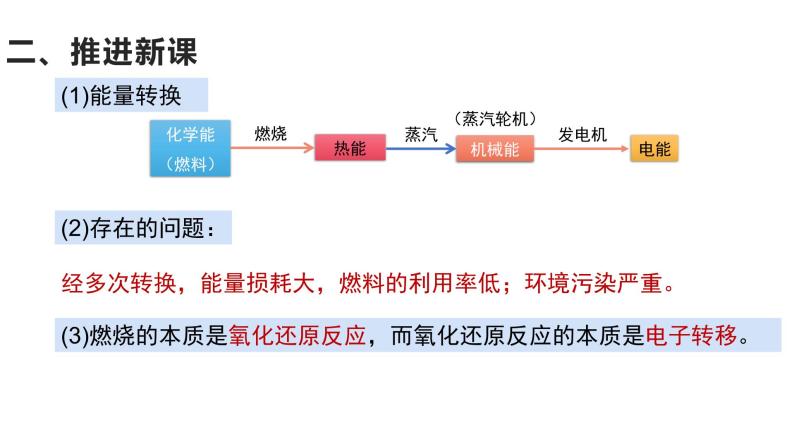
经多次转换,能量损耗大,燃料的利用率低;环境污染严重。
(3)燃烧的本质是氧化还原反应,而氧化还原反应的本质是电子转移。
什么样的化学反应才具备将化学能转化为电能的前提呢?请说明原因。
考虑火力发电的利弊,研究新的发电方式方式之一就是尝试将化学能直接转化为电能---就像电池。其好处就是减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便。
【实验6-3】(1)分别将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。(3) 用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
锌表面有气泡产生,铜表面无明显现象
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子?
2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子?
用导线将锌表面的电子引出来
大量气泡从铜片逸出,锌片部分溶解
1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.你怎样才能知道导线中有电子通过?
Cu起传导电子的作用。
可用电流表(灯泡)测电流及方向。
锌表面无气泡,铜表面有气泡,电流表发生偏转。
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
【实验现象】铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
【实验结论】导线中有电流通过(产生电能)
(1)定义:将化学能转变成电能的装置叫做原电池。
电子流入的电极,通常是不活泼金属或石墨电极现象:有气泡产生或质量增加作用:导电
电子流出的电极,通常是活泼金属现象:质量减小或溶解作用:提供电子
Zn – 2e- = Zn2+ 氧化反应
2H+ +2e- = H2↑ 还原反应
(4)总反应式(两个电极反应之和)
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4(稀) = ZnSO4 + H2↑
原电池反应的本质是:氧化还原反应。
(5)原电池原理:负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,从而产生电流,使化学能转变成电能。(电流方向呢?)
Zn极 电子:从Zn极流出 电流:经导线流入Zn极 电极:负极(-) 电极反应:Zn - 2e- = Zn2+ 反应类型: 氧化反应
Zn极:Zn变成Zn2+进入溶液中Zn极周围溶液的电荷:有多余的正电荷离子移向:阳离子(Zn2+、H+)移向正极
Cu极电子:经导线流入Cu极电流:从Cu极流出电极:正极(+)电极反应:2H+ + 2e- =H2 反应类型:还原反应
Cu极:表面上有气泡产生Cu极周围的电荷:有多余的负电荷离子移向:阴离子(SO42-、OH-)移向负极
阴阳离子作定向移动 (电解质导电)
电子(电流)流动方向:电解质溶液中离子的移动方向:阴离子向负极移动,阳离子向正极移动。
原氧负,电还阴;带负电的(阴离子)移向化合价升高的一极(负极);电子不下溶液,离子不上导线。
“负极出电子,电子回正极”
(1)氧化反应(负极)、还原反应(正极)分别在两极上发生。有电流产生(电能)。利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。
(2)正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
(4)电极: 负极有损耗(金属溶解或燃料气体失去电子变成离子进入溶液中)。 正极有新物质生成(阳离子或非金属单质得到电子被还原成气体或金属单质或生成离子进入溶液中)。
(3)加快反应速率。例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
【探究】构成原电池的条件
形成条件一:通常用活泼性不同的两种材料作电极
负极:较活泼的金属正极:较不活泼的金属或非金属(如石墨等)
形成条件二:两极之间填充电解质溶液;
形成条件三:必须形成闭合回路
形成条件四:必须存在自发的氧化还原反应
4.构成原电池的条件:
(1) 有自发进行的氧化还原反应(化学能)→关键。(2) 有活性不同的两极。(3) 有电解质溶液(内电路)。(4) 电极、电解质溶液必形成闭合回路。
5.判断原电池正、负极的方法
*由组成原电池的两极材料判断:
一般是活泼的金属为负极活泼性较弱的金属或能导电的非金属为正极
*根据电流方向或电子流动方向判断:
电流是由正极流向负极;电子流动方向是由负极流向正极。
*根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
质量减小或溶解的一极为负极;质量不变有气泡产生或质量增加的为正极。
1.下列装置中,能组成原电池的是( )
原电池中正负极的判断(原氧负)一般是活泼的金属为负极
2.下列装置是不是原电池?若是,指出正负极。
失e,沿导线传递,有电流产生
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
人教版 (2019)选择性必修2第一节 共价键教学ppt课件: 这是一份人教版 (2019)选择性必修2第一节 共价键教学ppt课件,共60页。PPT课件主要包含了知识点一,共用电子对,非金属,知识点二,头碰头,轴对称,肩并肩,镜面对称,σ键与π键的比较,随堂练学以致用等内容,欢迎下载使用。
高中化学第二章 分子结构与性质第一节 共价键图片课件ppt: 这是一份高中化学第二章 分子结构与性质第一节 共价键图片课件ppt,共11页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 共价键优秀课件ppt: 这是一份人教版 (2019)选择性必修2第一节 共价键优秀课件ppt,共18页。PPT课件主要包含了先变小后变大,共价键的本质,共价键的形成条件,共价键的表示方法,共价键的类型,活动与探究,σ键和π键的比较,强度大不易断裂,强度较小易断裂,课堂练习等内容,欢迎下载使用。













